12.4: Odpařování a Kondenzace
Odpařování
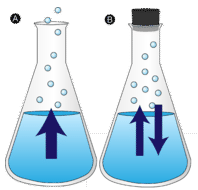
kaluže vody a bylo tak ponecháno nakonec zmizí. Kapalné molekuly unikají do plynné fáze a stávají se vodní párou. Odpařování je proces, při kterém je kapalina přeměněna na plyn. Odpařování je přeměna kapaliny na její páru pod teplotou varu kapaliny. Je-li voda místo uchovávány v uzavřené nádobě, molekuly vodní páry nemají šanci uniknout do okolí, a tak vodní hladina se nemění. Jak se některé molekuly vody stávají párou, stejný počet molekul vodní páry kondenzuje zpět do kapalného stavu. Kondenzace je změna stavu z plynu na kapalinu.
aby pro kapalné molekuly uniknout do plynu stát, molekuly musí mít dostatečnou kinetickou energii k překonání mezimolekulárních přitažlivých sil v kapalině. Připomeňme, že daný vzorek kapaliny bude mít molekuly se širokou škálou kinetických energií. Kapalné molekuly, které mají tuto určitou prahovou kinetickou energii, unikají z povrchu a stávají se párou. Výsledkem je, že kapalné molekuly, které nyní zůstávají, mají nižší kinetickou energii. Při odpařování se teplota zbývající kapaliny snižuje. Pozorovali jste účinky odpařovacího chlazení. V horkém dni molekuly vody ve vašem potu absorbují tělesné teplo a odpařují se z povrchu pokožky. Proces odpařování opouští zbývající chladič potu, který zase absorbuje více tepla z vašeho těla.
daná kapalina se při zahřátí rychleji odpaří. Je to proto, že proces ohřevu vede k tomu, že větší část molekul kapaliny má potřebnou kinetickou energii k úniku z povrchu kapaliny. Níže uvedený obrázek ukazuje distribuci kinetické energie kapalných molekul při dvou teplotách. Počty molekul, které mají potřebnou kinetickou energii k odpařování, jsou zobrazeny ve stínované oblasti pod křivkou vpravo. Kapalina s vyšší teplotou \(\left (T_2 \right)\) má více molekul, které jsou schopné unikat do fáze páry, než kapalina s nižší teplotou \(\left (T_1 \ right)\).
Na 29.029 stop \(\left( 8848 \: \text{m} \right)\), Mount Everest v Himálajské oblasti na hranici mezi Čínou a Nepálem je nejvyšší bod na zemi. Jeho nadmořská výška představuje horolezcům mnoho praktických problémů. Obsah kyslíku ve vzduchu je mnohem nižší než na hladině moře, takže je nutné přivést kyslíkové nádrže (i když několik horolezců dosáhlo vrcholu bez kyslíku). Dalším problémem je vařící voda na vaření jídla. Ačkoli voda vaří na \(100^\text{o} \text{C}\) na hladině moře, bod varu na vrcholu Mount Everestu je pouze asi \(70^\text{o} \text{C}\). Tento rozdíl velmi ztěžuje získání slušného šálku čaje(což určitě frustrovalo některé Britské horolezce).