17.3: Tvorbu Komplexních Iontů
Vliv na Tvorbu Komplexních Iontů na Rozpustnost
Co se stane na rozpustnost málo rozpustné soli-li ligand, který vytváří stabilní komplexní iont je přidán do roztoku? Jeden takový příklad se vyskytuje v konvenční černobílé fotografii. Připomeňme, že černobílý fotografický film obsahuje mikrokrystaly AgBr citlivé na světlo nebo směsi AgBr a dalších halogenidů stříbra. AgBr je mírně rozpustná sůl s Ksp 5,35 × 10-13 při 25°C. Když spoušť fotoaparátu se otevře, světlo z objektu, který je fotografoval údery některé krystaly na film a iniciuje fotochemické reakce, která převádí AgBr černé Ag kov. Dobře tvarované, stabilní negativní obrazy se objeví v odstínech šedé, odpovídající počtu zrna AgBr převedeny, s oblastí vystaveni nejvíce světla nejtemnější. Jak opravit obraz a zabránit více krystaly AgBr z převáděna na Ag kovu při zpracování filmu, nezreagovaného AgBr na filmu je odstraněna pomocí komplexace reakci k rozpouštění málo rozpustných solí.
reakce na zrušení bromidu stříbrného je následující:
\
s
\
rovnováha leží daleko na levé straně, a rovnovážná koncentrace Ag+ a Br− iontů jsou velmi nízké (7.31 × 10-7 M). V důsledku toho by odstranění nezreagované AgBr z jediné role filmu pomocí čisté vody vyžadovalo desítky tisíc litrů vody a spoustu času. Princip Le Chatelier nám však říká, že můžeme řídit reakci doprava odstraněním jednoho z produktů, což způsobí rozpuštění více AgBr. Bromidový ion je obtížné odstranit chemicky, ale stříbrné iontové formy různých stabilní dva-koordinovat komplexy s neutrální ligandy, jako čpavek, nebo s aniontové ligandy, jako jsou kyanid, nebo thiosíranu (S2O32−). Při fotografickém zpracování se přebytek AgBr rozpustí za použití koncentrovaného roztoku thiosíranu sodného.
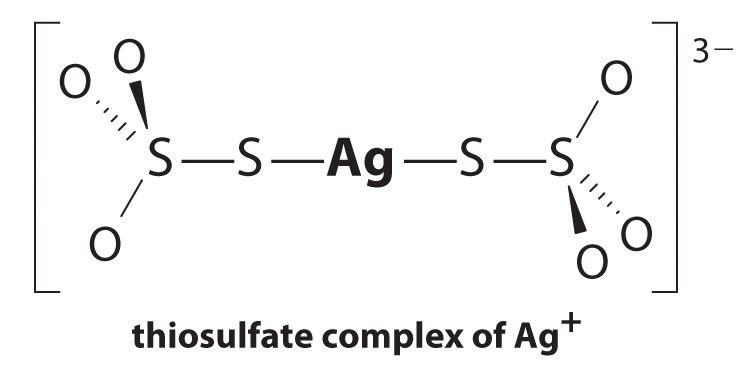
reakce Ag+ s thiosíranu je následující:
\^{3−}_{(aq)} \label{17.3.5a}\]
s
\
velikost rovnovážné konstanty znamená, že téměř všechny Ag+ iontů v roztoku bude ihned komplexu s thiosíranu k formuláři 3−. Můžeme vidět efekt thiosíranu na rozpustnost AgBr písemně příslušné reakce a sečíst je dohromady:
\\ \mathrm{Ag^+(aq)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}\hspace{3mm}K_\textrm f&=2.9\krát 10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=15\end{align} \label{17.3.6}\)
Srovnání K s Ksp ukazuje, že tvorba komplexu iontů, zvyšuje se rozpustnost AgBr o přibližně 3 × 1013. Dramatické zvýšení rozpustnosti v kombinaci s nízkými náklady a nízkou toxicitou vysvětluje, proč je thiosíran sodný téměř univerzálně používán pro vývoj černobílého filmu. Je-li to žádoucí, může být stříbro získáno z roztoku thiosíranu některým z několika způsobů a recyklováno.
pokud má komplexní iont velký KF, může tvorba komplexního iontu dramaticky zvýšit rozpustnost mírně rozpustných solí.
Například \(\PageIndex{2}\)
Vzhledem ke společné ion efekt, bychom mohli očekávat, že sůl jako AgCl být mnohem méně rozpustný v koncentrovaném roztoku KCl než ve vodě. Takový předpoklad by však byl nesprávný, protože ignoruje skutečnost, že stříbrný iont má tendenci tvořit dvousouřadnicový komplex s chloridovými ionty (AgCl2−). Vypočítejte rozpustnost AgCl v každé situaci:
- v čisté vodě
- 1.0 M KCl roztok, ignorování tvorby komplexních iontů
- stejné řešení jako v části (b) kromě s tvorbou komplexních iontů v úvahu, za předpokladu, že AgCl2− je pouze Ag+ komplex, který tvoří ve významných koncentracích
Při 25°C, Ksp = 1.77 × 10-10 pro AgCl a Kf = 1.1 × 105 pro AgCl2−.
Vzhledem k tomu,: Ksp z AgCl, Kf z AgCl2− a KCl koncentrace
Zeptal pro: rozpustnost AgCl ve vodě a v roztoku KCl s a bez tvorby komplexních iontů
Strategie:
- Napište součin rozpustnosti výraz pro AgCl a výpočet koncentrace Ag+ a Cl− ve vodě.
- Vypočítejte koncentraci Ag + v roztoku KCl.
- napište vyvážené chemické rovnice pro rozpouštění AgCl a pro tvorbu komplexu AgCl2. Přidejte dvě rovnice a vypočítejte rovnovážnou konstantu pro celkovou rovnováhu.
- napište rovnovážnou konstantní expresi pro celkovou reakci. Řešení pro koncentraci komplexního iontu.
Řešení
- Pokud bychom nechali, že x se rovná rozpustnost AgCl, pak při rovnováze = = x M. Dosazením této hodnoty do součin rozpustnosti výraz,
Tak rozpustnost AgCl v čisté vodě při 25°C je 1.33 x 10-5 M.
- B Když x se rovná rozpustnost AgCl v roztoku KCl, pak při rovnováze = M x a = (1.0 + x) M Dosazením těchto hodnot do součin rozpustnosti výraz a za předpokladu, že x << 1.0,
Pokud společný ion efekt byl jediný důležitý faktor, bychom předpovídají, že AgCl je zhruba o pět řádů méně rozpustné v 1.0 M KCl řešení, než ve vodě.
- C zohlednit účinky tvorbě komplexních iontů, musíme nejprve napsat rovnice rovnováhy pro obě rozpuštění a vzniku komplexních iontů. Přidání rovnic odpovídajících Ksp a Kf nám dává rovnici, která popisuje rozpuštění AgCl v řešení KCl. Rovnovážná konstanta pro reakci je tedy produktem Ksp a Kf:
\\ \mathrm{Ag^+(aq)}+\mathrm{2Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K_\textrm f&=1.1\krát 10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=1.9\krát 10^{-5}\end{align}\)
D Když jsme se nechat, že x se rovná rozpustnost AgCl v roztoku KCl, pak při rovnováze = x a = 1.0 − x. Dosazením těchto veličin do rovnovážná konstanta výraz pro čistý reakce a za předpokladu, že x << 1.0,
AgCl se rozpustí v 1,0 M KCl vyrábět 1,9 × 10-5 M roztoku AgCl2− komplexní ion. Předpovídáme tedy, že AgCl má přibližně stejnou rozpustnost v roztoku 1,0 M KCl jako v čisté vodě, což je 105krát větší než předpokládané na základě společného iontového efektu. (Ve skutečnosti je naměřená rozpustnost AgCl v 1,0 M KCl téměř faktorem 10 větším než v čisté vodě, z velké části v důsledku tvorby dalších komplexů obsahujících chloridy.)
Cvičení \(\PageIndex{2}\)
Vypočítejte rozpustnost rtuti(II) jodid (HgI2) v každé situaci:
- čistá voda
- 3.0 M roztoku NaI, za předpokladu, že 2− je pouze Hg-obsahující druhy, přítomné ve významných množstvích
Ksp = 2.9 × 10-29 pro HgI2 a Kf = 6.8 × 1029 za 2−.
Odpověď
- 1.9 × 10-10 M
- 1.4 M
Komplexotvorná činidla, molekuly nebo ionty, které zvyšují rozpustnost solí kovů tím, že tvoří rozpustné kovové komplexy, jsou běžné komponenty pracích prostředků. Karboxylové kyseliny s dlouhým řetězcem, hlavní složky mýdel, tvoří nerozpustné soli s Ca2+ a Mg2+, které jsou přítomny ve vysokých koncentracích v “tvrdé” vodě. Srážení těchto solí vytváří prstenec vany a dává oblečení šedý nádech. Přidání komplexotvorných agent, jako pyrofosforečnan (O3POPO34−, nebo P2O74−) nebo trifosfát (P3O105−) na prací prostředky brání hořečnatých a vápenatých solí z urychlovat, protože rovnovážná konstanta pro komplex-ion formace je velký:
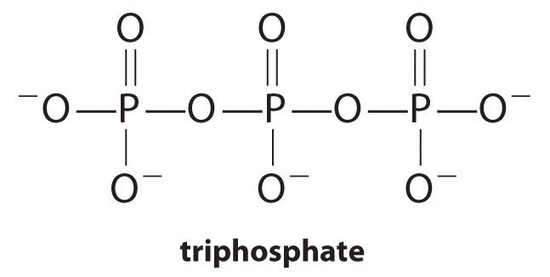
s
Nicméně, fosfátů může způsobit škody na životním prostředí tím, že podporuje eutrofizace, růst nadměrného množství řas v těle vodu, což může nakonec vést k velké snížení hladiny rozpuštěného kyslíku, které zabíjejí ryby a jiné vodní organismy. V důsledku toho mnoho států ve Spojených státech zakázalo používání detergentů obsahujících fosfáty a Francie zakázala jejich používání od roku 2007. Detergenty neobsahující fosfáty obsahují různé druhy komplexních činidel, jako jsou deriváty kyseliny octové nebo jiných karboxylových kyselin. Vývoj fosfátových náhražek je oblastí intenzivního výzkumu.
Komerční změkčovače vody také použít komplexotvorné činidlo k léčbě těžké vody při průchodu vody přes iontoměničové pryskyřice, které jsou komplexní sodné soli. Když voda protéká pryskyřicí, sodík se rozpustí a nerozpustné soli se vysráží na povrch pryskyřice. Takto upravená voda má slanější chuť díky přítomnosti Na+, ale obsahuje méně rozpuštěných minerálů.
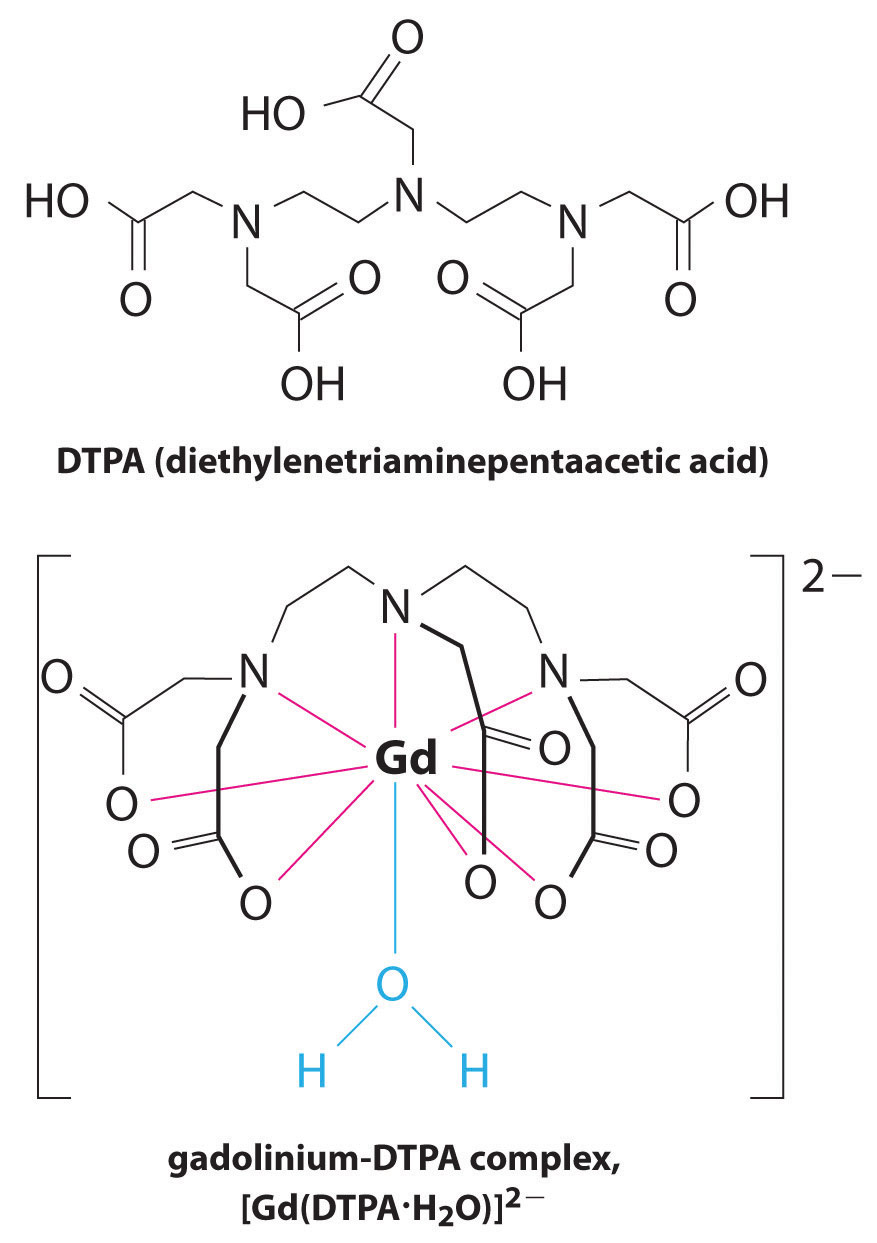
další aplikace komplexních činidel se nachází v medicíně. Na rozdíl od rentgenových paprsků může zobrazování magnetickou rezonancí (MRI) poskytnout relativně dobré obrazy měkkých tkání, jako jsou vnitřní orgány. MRI je založena na magnetických vlastnostech jádra 1h atomů vodíku ve vodě, což je hlavní složka měkkých tkání. Protože vlastnosti vody nezávisí moc na tom, zda je uvnitř buňky, nebo v krvi, je těžké získat detailní snímky z těchto tkání, které mají dobrý kontrast. K vyřešení tohoto problému vědci vyvinuli třídu kovových komplexů známých jako ” kontrastní látky MRI.”Vstřikování kontrastní látky pro MRI na pacienta selektivně ovlivňuje magnetické vlastnosti vody v buňkách normálních tkání, nádory, nebo v krevních cév a umožňuje lékaři, aby “vidět” každý z nich samostatně (viz Obrázek \(\PageIndex{2}\)). Jedním z nejdůležitějších kovových iontů pro tuto aplikaci je Gd3+, který je se sedmi nepárovými elektrony vysoce paramagnetický. Protože Gd3+(aq) je poměrně toxický, musí být podáván jako velmi stabilní komplex, který není oddělit v těle a může být vylučován beze změny ledvin. Komplexními činidly používanými pro gadolinium jsou ligandy, jako je DTPA5 – (diethylentriamin pentaoctová kyselina), jejichž plně protonovaná forma je zde ukázána.
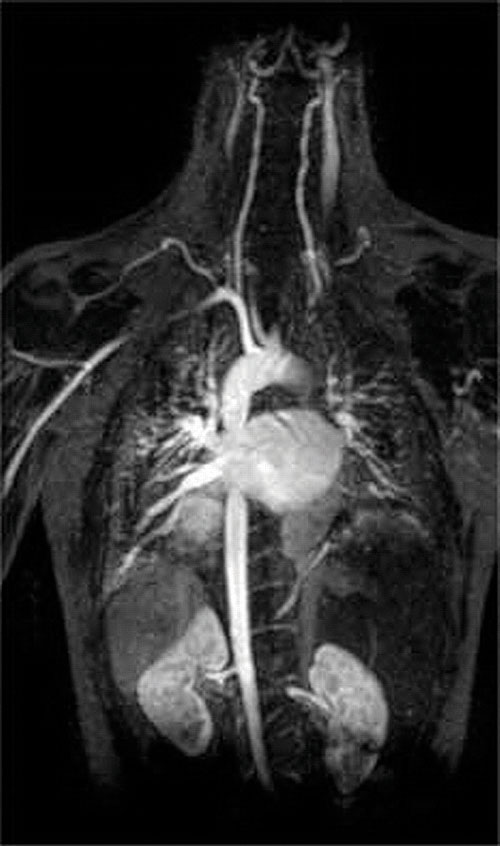
obrázek \(\PageIndex{2}\): MRI obraz srdce, tepen a žil. Když je pacientovi injikován paramagnetický kovový kation ve formě stabilního komplexu známého jako kontrastní činidlo MRI, mění se magnetické vlastnosti vody v buňkách. Protože různá prostředí v různých typech buněk reagují odlišně, může lékař získat podrobné obrazy měkkých tkání.