2.3: Oxid Uhelnatý a backbonding
Obecné Vlastnosti
CO je dativ, L-typu ligandu, který nemá vliv na oxidační stav kovu center na závazné, ale zvyšuje celkový elektronový počítat dvě jednotky. Nedávno jsme viděli, že v karbonylovém ligandu skutečně existují dvě vazebné interakce: interakce ligand-kov n → dσ a interakce kov-ligand dn → π*. Druhá interakce se nazývá backbonding, protože kov daruje elektronovou hustotu zpět do ligandu. Připomínat existenci backbonding, rád používám pravou rezonanční strukturu, kdykoli je to možné; nicméně, je důležité si uvědomit, k léčbě, CO jako L-typu ligandu bez ohledu na to, co rezonance forma je vypracován.

Orbitální interakce v M=C=O.
CO je silných σ-donor (nebo σ-base) a dobrý π-akceptor (nebo π-kyseliny). Vlastnosti ligovaného CO závisí hluboce na identitě kovového středu. Přesněji řečeno, elektronické vlastnosti kovového centra diktují důležitost backbondingu v kovových karbonylových komplexech. Většina bez obalu, více elektronově bohatých kovových Center je lepší v backbondingu k CO. Proč je důležité zjistit sílu backbondingu?
infračervená spektroskopie se skvěle používá k empirické podpoře myšlenky backbondingu. Níže uvedená tabulka uspořádá některé kovové karbonylové komplexy v “periodickém” pořadí a poskytuje frekvenci odpovídající režimu roztahování C=O. Všimněte si, že bez výjimky, každý komplexovaný CO má protahovací frekvenci nižší než frekvence volného CO. Na vině je Backbonding! Pořadí vazby C-O v komplexním oxidu uhelnatém je (téměř vždy) nižší než u volného CO.

c=o protahovací frekvence v kov-karbonylových komplexech. Nezdá se vám tu něco?
výše uvedený obrázek znázorňuje jasné zvýšení frekvence (zvýšení pořadí vazeb C-O), když se pohybujeme zleva doprava přes periodickou tabulku. Toto zjištění se může zdát zvláštní, pokud vezmeme v úvahu, že počet d elektronů v neutrálním kovu se zvyšuje, když se pohybujeme zleva doprava. Neměla by být kovová centra s více d elektrony lepší v backbondingu(a “elektronově bohatší”)? Co se to tu děje? Připomeňme si periodický trend v orbitální energii. Jak se pohybujeme zleva doprava, orbitální energie d se snižují a energie orbitalů dn a π* se oddělují. Výsledkem je, že zpětná orbitální interakce se zhoršuje (pamatujte, že silné orbitální interakce vyžadují dobře sladěné orbitální energie), když se pohybujeme směrem k elektronegativnějším pozdním přechodovým kovům! Můžeme nakreslit analogii k enaminům a enoletherům z organické chemie. Elektronegativnější atom kyslíku v enoleterech je horším donorem elektronů než atom dusíku enaminu.

význam backbondingu závisí na elektronegativitě kovu a jeho elektronové hustotě.
samozřejmě nelze zapomenout ani na příspěvek jiných ligandů na kovovém středu k backbondingu. Logicky, elektron-darování ligandy bude mít tendenci dělat backbond silnější (dělají kov lepší elektronový donor), zatímco elektron-odnímání ligandy zhorší backbonding. Přidání fosfinových ligandů bohatých na elektrony do kovového centra například snižuje frekvenci protažení CO díky zlepšenému backbondingu.
karbonylové ligandy jsou skvěle schopné přemostit více kovových Center. Lepení v překlenout karbonylové komplexy mohou být buď “tradiční” či delokalizována, v závislosti na struktuře komplexu a přemostění režimu. Rozmanitost překlenovacích režimů vychází z různých elektronových dárců a akceptorů přítomných na co ligandu (a možnosti delokalizované vazby). Známé přemostění režimy jsou znázorněny na obrázku níže.
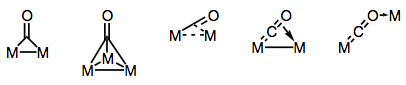
budování mostů s karbonylovými ligandy!