25.6: Koenzym B12 – Vitamin B12
Kobalamin, nebo Vitamin B12, je největší a nejsložitější ze všech druhů Vitamínů. Objev kobalaminu byl učiněn, když se vědci snažili najít lék na perniciózní anémii, anemické onemocnění způsobené nepřítomností vnitřního faktoru v žaludku. Kobalamin byl zkoumán, čistí, a shromážděné do malé červené krystaly, a jeho krystalizace struktura byla určena v průběhu X-ray analýzu experimentu, který provedla Vědec Hodkin. Struktura molekul kobalaminu je jednoduchá, přesto obsahuje mnoho různých odrůd a komplexů, jak je znázorněno na obrázku 1. Zkoumání molekulární struktury vitaminu pomáhá vědcům lépe porozumět tomu, jak tělo využívá vitamín B12 k budování červených krvinek a prevenci syndromů perniciózní anémie.
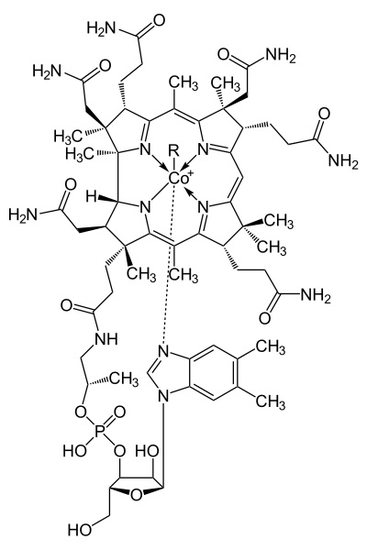
Obrázek 1
metalloenzyme struktuře Kobalaminu představuje corrin prsten s Kobalt, jediný kovu v molekule, který je umístěn přímo v centru strukturu o čtyři koordinované vazby dusíku ze čtyř pyrrolových skupin. Tyto čtyři podjednotky jsou rovnoměrně odděleny ve stejné rovině, přímo naproti sobě. Jsou také navzájem spojeny methylenovou vazbou C-CH3 na ostatních stranách, C-H na jedné straně a dvěma pyrroly, které se přímo spojují. Společně tvoří dokonalý corrinův kruh, jak je znázorněno na obrázku 2. Pátý ligand spojený s kobaltem je dusík pocházející z 5,6-dimethylbenzimidazolu. Prezentuje se jako axiální běží přímo dolů z kobaltu přímo pod corrin prsten. Tento benzimidazol je také připojen k pěti uhlíku cukru, který nakonec se připojí k fosfátové skupiny, a pak popruhy zpět, aby zbytek konstrukce. Protože je axiální táhla celou cestu dolů, lepení mezi Kobalt a 5,6-dimethylbenzimidazole je slabá a někdy může být nahrazen souvisejících molekul, jako jsou 5-hydrozyl-benzimidazol, adenin, nebo jakékoli jiné podobné skupiny. V šesté poloze nad Corrin prsten, aktivní stránky Kobaltu může přímo připojit k několika různými typy ligandů. To se může připojit ke KN k vytvoření Cyanocobalami, aby Methylová skupina k formě methylcobalaminu, na 5′-deoxy adenosy skupinu tvoří adenosylcobalamin, a OH, Hydroxycobalamin. Kobalt je vždy připraven k oxidaci z 1+ na 2+ a 3+, aby se vyrovnal s těmito skupinami R, které jsou k němu připojeny. Například hydroxokobalamin obsahuje kobalt, který má náboj 3+, zatímco Methyladenosyl obsahuje kobalt, který má náboj 1+.
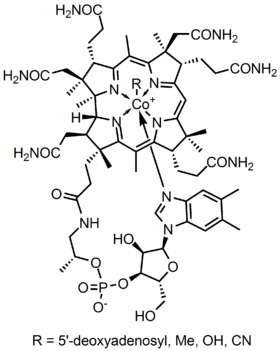
Obrázek 2
bod group konfigurace Kobalaminu je C4v. Za účelem určení této symetrie, musí vidět, že struktura je schopna otočit sám čtyřikrát a nakonec dorazil zpět do své původní polohy. Kromě toho neexistuje žádná rovina sigma h a žádná kolmá sekera C2. Nicméně, protože tam jsou sigma v rovinách, které prochází molekuly i do těch částí, je jasné, určit, že struktura Kobalamin je C4v. S Cobalt být středem kovové molekuly, Kobalamin provádí zkreslené oktaedrická konfigurace. Axiální, která spojuje kobalt s 5,6 dimethylbenzimidazolem, je natažena až dolů. Jeho vzdálenost je několikrát delší než vzdálenost od kobaltu a připojené skupiny R nad ním. To někdy může být také označováno jako tetragonální struktura. Celý tvar je celkově podobný oktaedrálu, ale obě axiální skupiny jsou odlišné a rozděleny do nerovných vzdáleností. Protože tam je jen jeden metalloenzyme center v systému, bod skupiny a konfigurace právě zmínil, je také přiřazena ke struktuře jako celku. Od metallocoenzyme struktura je natažené, je to velmi slabě koordinovaný a může být rozpadnout, nebo nahrazeny jinými skupinami, jak je uvedeno výše.
vědci ukázali, že k určení struktury molekuly byly použity IR i Ramanova spektroskopie. To je určeno pozorováním znakových tabulek bodové skupiny C4v, symetrie bodové skupiny kobalaminu. Na straně IR je vidět, že existují skupiny jako drz, (x, y), (rz, ry). Na druhé straně na Ramanově straně existují skupiny jako x square +y square, z square, x square-y square, xy, xz, yz. Ramanova strana naznačila, že v molekule existují protahovací režimy a vztahuje se zpět k protažení axiální dimethylbenzimidazolu 5,6, který je spojen přímo pod kovem kobaltu. Protahování je vidět na obrázku 3.
Obrázek 3
Kobalamin enzymy mohou katalyzovat několik různých typů reakcí. Jednou z nich je reakce intramolekulárních přestaveb. Během tohoto přeskupení se koenzym vyměňuje za dvě skupiny připojené k sousedním atomům uhlíku. Další reakce zahrnuje přenos metylové skupiny v určité metylace reakcím, jako jsou konverze homocysteinu na methionin, biosysnthesis cholinu a thymin atd. Tyto interakce mohou přinést prospěšné hodnoty biologickým tělům.
kobalamin má mnoho příznivých účinků, pokud jde o biologické existence. Hrají roli při udržování zdravého tělesného systému a pomáhají při produkci genetických materiálů těla. Kyanokobalamin, jeden typ kobalaminu, působí na tvorbu červených krvinek a léčí mnoho různých poškození nervového systému. Kobalamin také slouží jako zásadní role v metabolismu mastných kyselin nezbytných pro udržení myelinu. Studie ukázaly, že lidé s nedostatkem vitaminu B12 odhalí nepravidelné zničení myelinového zdraví, což vede k parlýze a smrti. Některé další příznaky nedostatku kobalaminu jsou špatný růst, megaloblastická kostní dřeně, Gastrointestinálního traktu změny, Leucoopenia a hyper-segmentované nutrophills, degenerativní změny míchy a nervový systém a vylučování methyl kyselina malonová a homocystin v moči.
v průběhu let se ukázalo, že Vitamin B12 je nezbytný pro fungování nervového systému a tvorbu červených krvinek. Studie provedená vědci z National Institutes of Health, Trinity College Dublin, naznačují, že nedostatek Vitaminu B12 může zvýšit riziko neurální trubice vady u dětí (Miller). Proto studiem struktury a funkce kobalaminu mohou vědci experimentovat a vytvářet vitamín B12 ve svých laboratořích a sloužit komunitě jako celku.