7.4: Komplex III
Komplex III přijme elektrony z obou Komplex i a Komplex II. Elektrony dorazí v podobě ubichinol, UQH2, který poskytuje dva elektrony a dva protony a je převeden zpět na ubichinon, UQ. Ubichinon se pak dopravuje zpět do komplexu I nebo komplexu II, aby shromáždil více elektronů.
- komplex III je cíl pro elektrony přicházející z komplexu I i komplexu II.
- Komplex III využívá energie uvolněné ve sjezdu elektron přenáší na čerpadlo více protonů přes vnitřní mitochondriální membránu.
- protonového gradientu napříč membránou se používá k pohonu tvorbu ATP na Komplexu V.
- Komplex III pak posílá své elektrony na Komplex IV..
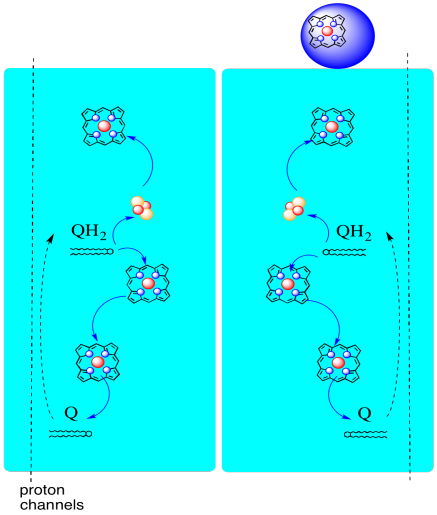
cesty elektronů přes Komplex III je uveden níže. Všimněte si, že komplex je dimerní struktura se dvěma ekvivalentními cestami: jedna je zobrazena vlevo a druhá vpravo. Elektrony jsou dodávány z uqh2, ubichinolu, uprostřed obrázku, směřující nahoru k mobilnímu cytochromu c nahoře. Druhá elektronová dráha umožňuje cestovat dolů na obrázku směrem k jiné molekule ubichinonu, která recykluje elektrony ve smyčce.
- komplex III má neobvyklou, rozbíhající se elektronovou dráhu.
- jeden elektron putuje na cytochrom c.
- druhý elektron je nakonec recyklován do jiného ubichinolu.
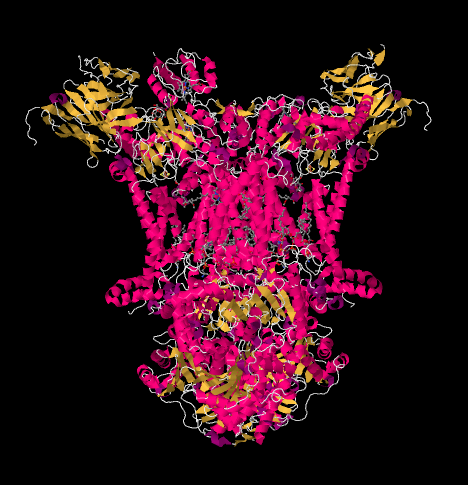
rentgenová struktura komplexu III je zobrazena v kreslené podobě níže. Vnitřní mitochondriální membrána by protínala horní střední část komplexu. Většina komplexních projektů níže, do matice (spodní část obrázku, v této orientaci) ačkoli významné množství také vyčnívá do intermembránového prostoru.
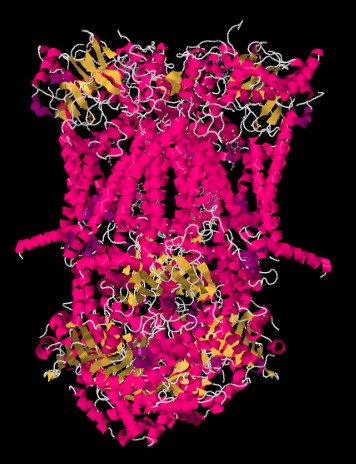
Komplex III pokračuje elektronového transportního řetězce, posílání elektrony na vyšší redukční potenciál (a nižší volná energie) a k setkání s molekulární kyslík v Komplexu IV. Protony jsou také čerpané z mitochondriální matrix přes vnitřní mitochondriální membránu do mezimembránového prostoru. Ve stejné době, druhý elektron trase výsledky v efektivní recyklaci polovina elektronů, které přicházejí do komplexu, zvýšení počtu protonů čerpána na elektron dorazí na Komplex III.
- To bylo navrhl, že elektron-recyklační smyčka poskytuje mechanismus pro kreslení více protonů z matrix.
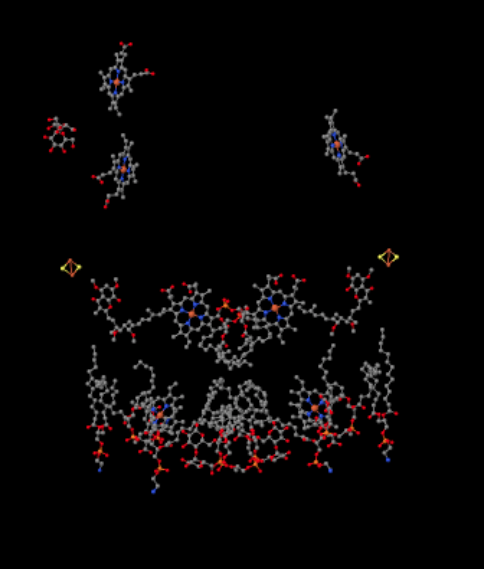
můžeme vidět toto neobvyklé uspořádání, pokud ignorujeme proteiny, abychom odhalili ligandy, níže. Komplex může být jasněji viděn jako dimer; levá polovina obrazu je přesně stejná jako pravá, i když se odráží opačně. Elektrony vstupují do komplexu přes mobilní nosič, ubichinol, viditelný na pravé a levé straně obrázku asi do poloviny dolů; můžete vidět prstencea řetěz visící z něj.
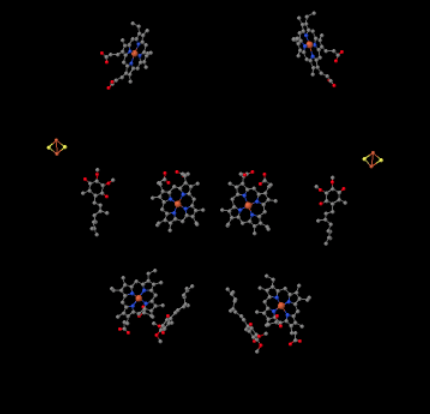
Když UQH2 váže na Komplex III, jeden elektron je poslal na FeS klaster, vzhledem k tomu, druhý je poslán na železo hemu center, tzv. hemové BL. Shluk FeS je viditelný těsně nad ubichinolem a na okraji obrázku. Hem BL je směrem ke středu obrazu.
ačkoli to není patrné na zobrazeném rentgenovém snímku, tento Fes cluster je jiný než ty, které jste viděli dříve. Ten je držen na místě s různými aminokyselinovými postranními řetězci. Na obrázku to není vidět, protože celý protein byl vynechán, spolu s těmi aminokyselinami, které se váží na shluk. Zatímco většina shluků FeS je držena výhradně cysteiny, tento shluk je držen na místě dvěma cysteieny na jedné straně, ale dvěma histidiny na druhé straně. Tento zvláštní Fes cluster se nazývá Rieske cluster.
Rieske klastry jsou důležité, protože se jedná o “klastry s vysokým potenciálem FeS”. To znamená, že mají mimořádně pozitivní redukční potenciály ve srovnání s jinými klastry FeS. Redukční potenciál jakéhokoli ligandu v proteinu je vysoce závislý na jeho prostředí, a proto ve většině případů existuje široká škála hodnot. To platí pro shluky síry železa; ty běžné mají redukční potenciály, které se pohybují od -1.0 V do o +0,05 V. Rieske klastry mají potenciály, které se pohybují asi od 0V do asi 0,4 V.
Z FeS clusteru, elektron je poslán na jinou železa hemu centrum v membráně vázané jednotky zvané cytochromu c1. Cytochrom c1 je vidět v horní části obrázku. Protože tento obraz je orientován stejným způsobem jako ostatní X-ray struktury respiračního komplexu, můžeme vidět, že tento elektron je stále přepravován k mezimembránového prostoru. Nakonec je tento elektron přenesen do jiného hemu,ale tento hem je vázán v malém mobilním proteinu zvaném cytochrom c. cytochrom c je další mobilní elektronový nosič. Přenáší elektron na komplex IV. vrátíme se k cytochromu c o něco později.
než se k tomu dostaneme, kam jde druhý elektron? Z hemu BL je druhý elektron předán do jiného komplexu porfyrinu železa, hemu BH. To je směrem ke spodní části obrázku, takže tento elektron je vlastně posílán zpět k matici. Čeká na heme BL, nicméně, tam je další ubichinon, UQ. Čeká na Elektron. To bude ve skutečnosti čekat na dva, pak nechte svůj ipod a jít zpátky na ubichinol (UQH2) závazné stránky dodávat elektrony znovu.
proč se obtěžovat? Proč ne jen poslat elektrony na cestě správně napoprvé? Zdá se, že se z nějakého důvodu recyklují. Předpokládá se, že toto odklonění umožňuje čerpání dalších protonů přes mitochondriální membránu. Když se druhý ubichinon sníží na ubichinol přijetím dvou elektronů, také zvedne další dva protony z matrice níže. Tyto protony se nakonec dostanou směrem k intermembránovému prostoru, když se ubichinol znovu oxiduje. Tato recyklace a vytlačování několika dalších protonů pro zvýšení gradientu protonů se nazývá Q smyčka.
výhoda Q-smyčky je vysvětlena v následujícím diagramu. V diagramu jsou vstupy do komplexu III zobrazeny červeně, výstupy jsou zobrazeny modře a recyklované prvky jsou zelené. Pokud by jeden ubichinol jednoduše dodal své elektrony a protony a byl hotový, byly by dodány dva protony na ubichinol. To je jeden protonový výstup na vstup.
druhý ubichinol by udělal přesně to samé. Tam by byly čtyři protony výstup pro čtyři elektrony zpočátku vstup. To je stále jeden protonový výstup na vstup elektronu.
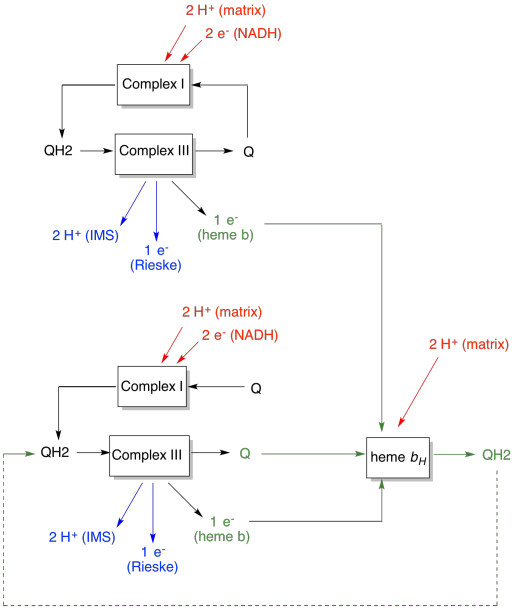
pokud je místo toho jeden elektron recyklován pokaždé, pak každý druhý ubichinol vede k dodávání dalšího páru protonů. To proto, že při vyzvednutí recyklovaných elektronů na ubichinon musel cestovat zpět do matrix straně membrány a vyzvednout další dva protony. Celkově to znamená, že šest protonů je dodáváno pro vstup čtyř elektronů nebo výstup 1,5 protonů na vstup elektronu. Od protonového gradientu, je to, co generuje ATP, pak zvýšením počtu protonů čerpána na elektron přicházející v, účinnost je zvýšena.
- Q-smyčka zvyšuje počet protonů čerpaných na vstup elektronu do systému.
Teď pojďme zpět na odchozí přenašeč elektronů-cytochrom c, který bude trajekt elektrony na Komplex IV. Na obrázku níže, z jiné rentgenové krystalové struktury, byl komplex nalezen s dokováním cyktochromu c v místě vazby. Cytochrom c je růžový globulární protein připojený v horní části obrázku, na levé polovině dimeru, jak se na to díváme zde. Sedí na okraji mezimembránového prostoru, což jsou vodná média. Na rozdíl od ubichinonu, který klouže podél lipidové dvojvrstvy membrány, se cytochrom c valí nebo klouže nebo plave přes vrchol na místo určení.
stejný pohled je uveden níže bez proteinu. Spodní část obrazu je dost přeplněná s lipidy, a tam je cukru visí kolem na horní levé straně, ale právě na samém vrcholu můžete vidět žehlička porfyrinu, který je zasazen uvnitř cytochromu c.
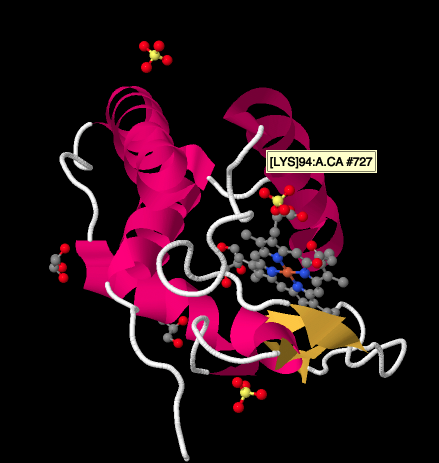
bližší pohled na X-ray struktury cyctochrome c, níže, ukazuje relativně jednoduchý obrázek ve srovnání s komplexy jsme byli při pohledu na. Existuje několik šroubovice, pár listů, některé smyčky, a že železný porfyrin nebo heme znovu. V okolí se vznáší několik síranových iontů, stejně jako několik molekul glycerolu, pravděpodobně zavedených během čištění nebo krystalizace proteinu. Všimněte si, že hem se nachází na okraji proteinu. Že umístění může dělat to jednodušší pro přenos elektronů z Komplexu III, nebo na Komplex IV..
- Cytochrom c je konečné místo určení elektrony pohybující se přes Komplex III.
- Cytochrom c je mobilní, jedno-elektronové nosiče.
- cytochrom c je vlastně malý hydrofilní protein.
- cytochrom c se nachází nad mitochondriální membránou, na okraji intermembránového prostoru.
co udržuje cyktochrome c od putování do intermembránového prostoru? Pokud by tak učinil, přerušil by efektivní tok elektronů. Je možné, že cytochrom c se pohybuje tam a zpět mezi komplexem III a komplexem IV prostřednictvím mechanismu zvaného “řízení”. Při řízení je nosič veden po dráze pomocí doplňkových nábojů. Například, pokud je membrána záporně nabitá kvůli polárním skupinám na povrchu membrány, pak pozitivní náboje na povrchu cytochromu c mohou omezit její pohyb na povrch membrány. To samo o sobě by snížilo jeho pohyblivost ze tří dimenzí (kdekoli v intermembránovém prostoru)na dva rozměry (kdekoli na povrchu membrány). Je možné, že další interakce ještě více snižují jeho pohyblivost na jednorozměrnou stopu mezi oběma komplexy.
- řízení, založené na doplňkových nábojích, zabraňuje ztrátě cytochromu c v intermembránovém prostoru.
Cvičení \(\PageIndex{1}\)
Navrhnout možné aminokyselinových zbytků na povrchu cytochromu c, které mohou pomoci zůstat na negativně nabité membrány povrchu.
Odpověď
Arginin a lysin jsou kladně nabité v neutrálním pH.
Cvičení \(\PageIndex{2}\)
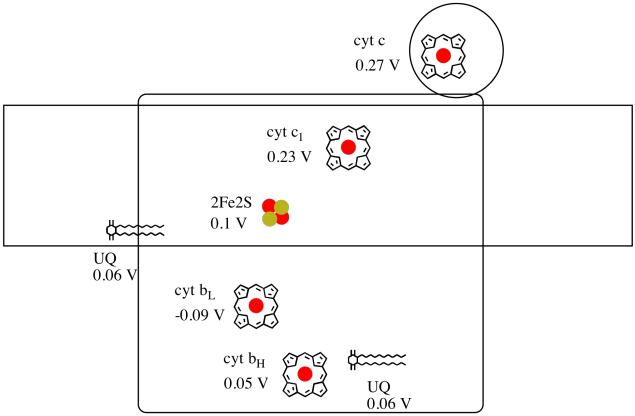
To je obtížné měřit potenciál snížení emisí jednotlivé stránky v rámci proteinu. Vědci však dokázali tyto hodnoty odhadnout měřením EPR spekter za různých podmínek. Za předpokladu, že snížení potenciálu níže nakreslete průběh reakce schéma pro transport elektronu z původní ubichinon dárce celou cestu k cytochromu c.
 Odpověď
Odpověď
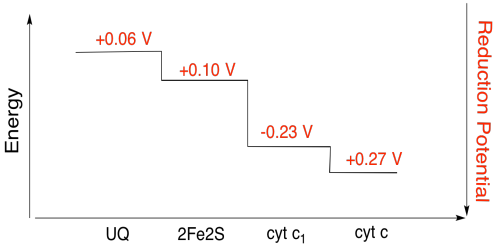
Cvičení \(\PageIndex{3}\)
Pomocí hodnot v obrázku výše, výpočet energie změnit, když elektron je přenesen z 2Fe2S clusteru do cytochromu c1.
Odpověď
za Předpokladu, redukční potenciály jsou:
2Fe2S(ox) + e- → 2Fe2S(červená) Eored = 0,10 V
cyt c1(ox) + e- → cyt c1(červená) Eored = 0.230 V
Pak rozdíl potenciálů pro reakce, ΔEo = 0.23 – (0.10) V = 0.13 V.
Faraday vztahu ΔG = – n. F ΔEo dává
ΔG = – 1 x 96,485 J V-1 mol-1 x 0,13 V = 12,543 J mol-1 = 12.5 kJ mol-1
Cvičení \(\PageIndex{4}\)
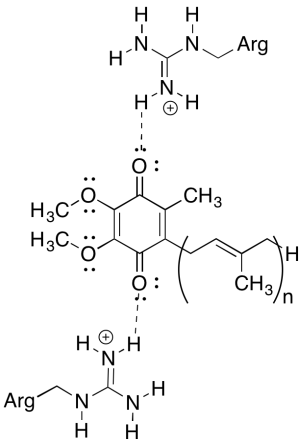
Jedním z matoucích věcí, o tomto komplexu je, že v elektron recyklační smyčky, přenos elektronů se zdá jít z počáteční ubichinonu na konečnou ubichinon, bez celkové hnací síly. Redukční potenciály jsou však velmi citlivé na životní prostředí. Ukažte, jak mohou rezidua argininu v okolí zvýšit potenciál redukce ubichinonu.
odpověď
pozitivní zbytky argininu by poskytly částečný kladný náboj ubichinonu vodíkovou vazbou; ubichinon by měl v důsledku toho pozitivnější redukční potenciál.
podívejte se na stránku zaměření na strukturu komplexu III v biochemii Online.
X-ray krystalové struktury Komplexu III od: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. Strukturální základ pro chinon snížení bc1 komplex: srovnávací analýza krystalové struktury mitochondriální cytochrom bc1 s navázanými substráty a inhibitory v Qi místě. Biochemie 2003, 4, 9067-9080. (1NTZ)
X-ray krystalové struktury Komplexu III s navázanými cytochromu c z: Solmaz, S. R., Hunte, C. Struktura komplexu III s navázanými cytochromu c v redukovaném stavu a definici minimální základní rozhraní pro electrontransfer. J.Biol. Cheme. 2008, 283, 17542-17549. (3CXH)
X-ray krystalové struktury cytochromu c z: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. a. Strukturální důkazy o přenosu protonu dráhy spolu s hem redukce cytochromu c” z Methylophilus methylotrophus. J.Biol. Inorg. Cheme. 2006 11, 189. (1OAE)
Attribution
Chris P Schaller, Ph.D., (Vysoká škola svatého Benedikta / univerzita svatého Jana)