7.5: Komplex IV
Komplex IV je konečné místo určení v elektrontransportním řetězci. Zde jsou elektrony, které putovaly přes ostatní členy dýchacího superkomplexu, konečně dodány do O2 a redukují je na vodu. To je opravdu úctyhodný výkon, protože řada reaktivních forem kyslíku, musí být vytvořen mezi počáteční kromě elektronu a konečné vydání vodou, ale reakce je řízena tak, aby možnost poškození buněk je minimální. Současně se přes vnitřní mitochondriální membránu čerpá více protonů.
- v komplexu IV jsou elektrony dodávány do konečného cíle, molekuly O2.
- O2 se redukuje na vodu.
cvičení \(\PageIndex{1}\)
napište vyváženou redoxní poloviční reakci, abyste ukázali, kolik elektronů je zapotřebí ke snížení molekuly kyslíku na vodu.
Odpověď
O2 → H2O
O2 → 2 H2O (O vyvážený)
O2 + 4H+ → 2 H2O (H vyvážené)
O2 + 4e- + 4H+ → 2 H2O (za poplatek vyvážené)
X-ray struktura Komplexu IV je uveden níže. Matice je opět na spodním konci obrázku a intermembránový prostor je nahoře. To je místo, kde doky cytochromu c, nahoře.
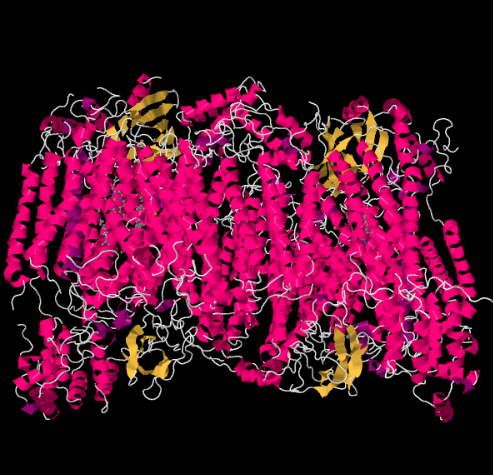
mobilní přenašeč elektronů-cytochrom c se váže na Komplex IV a přináší elektron na binuclear mědi stránky s názvem Čzu. Vidíme to dvojjaderné místo mědi, když se podíváme dovnitř proteinu, níže. Je vázán pouze na protein a nic jiného, takže vidíme dva ionty mědi samy o sobě v horní části obrázku. Tento pár atomů mědi posílá elektron na hem, cytochrom a, který můžete vidět níže a vlevo. Odtud elektron pokračuje do jiného dvojjaderného shluku, tentokrát sestávajícího z hemu vázaného železa (cytochrom a3) a blízké mědi (mládě). Toto dvojjaderné místo provádí redukci dioxygenu na vodu. Ve struktuře je molekula oxidu uhelnatého vázána v aktivním místě mezi cytochromem A3 a CuB. Atomy uhlíku jsou připojeny k železu a kyslík je připojen k mědi. Tam by se molekula kyslíku vázala a čekala by na redukci na vodu.
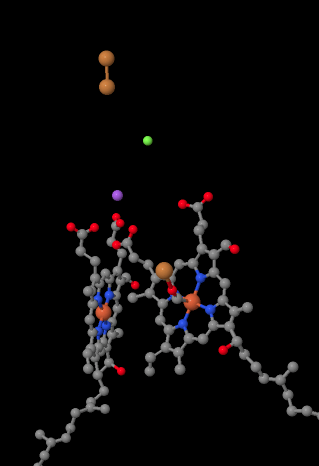
pokud o tom přemýšlíte, znamená to, že elektrony cestují opačným směrem, než jsme viděli v prvních třech komplexech. V Komplexech i a II, elektrony byly dodány z mitochondriální matrix a cestoval směrem do mezimembránového prostoru, zastavení na ubichinon v mitochondriální membráně. V komplexu III pokračovaly elektrony v tomto” vzestupném ” směru, od mitochondriální membrány po cytochrom c v intermembránovém prostoru. V komplexu IV jsou elektrony obráceny směrem zpět k mitochondriální matrici. Pamatujte, že mitochondriální matrice je n-dopována kvůli čerpání protonů, takže tyto elektrony putují z pozitivní strany membrány na negativní stranu. To musí být těžké.
- v komplexu IV je transport elektronů v opačném směru než ostatní komplexy.
- elektrony putují z intermembránové vesmírné strany na stranu mitochondriální matice proti gradientu náboje.
podívejme se ještě jednou na důležité ligandy pro komplex. Karikatura je uvedena níže. V karikatuře je molekula O2 zobrazena vazbou v této poloze mezi hem a3 a mládětem. Toto dinukleární kovové místo je místo, kde je molekula kyslíku redukována na vodu.
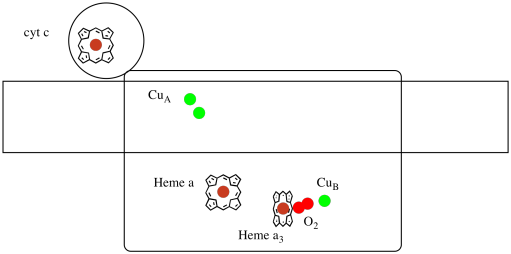
protože ke snížení O2 na H2O jsou zapotřebí čtyři elektrony, musí se čtyři molekuly cytochromu c vázat v komplexu IV, než může tato redukce pokračovat. Je pravděpodobné, že koordinaci prostředí molekulu kyslíku-mezi dvěma kovy, spíše než jen vázán na jedno-umožňuje být více rychle snížit celou cestu k vodě, spíše než tvořit reaktivní formy kyslíku, které přetrvávají v buňce, jako jsou peroxidy.
cvičení \(\PageIndex{2}\)
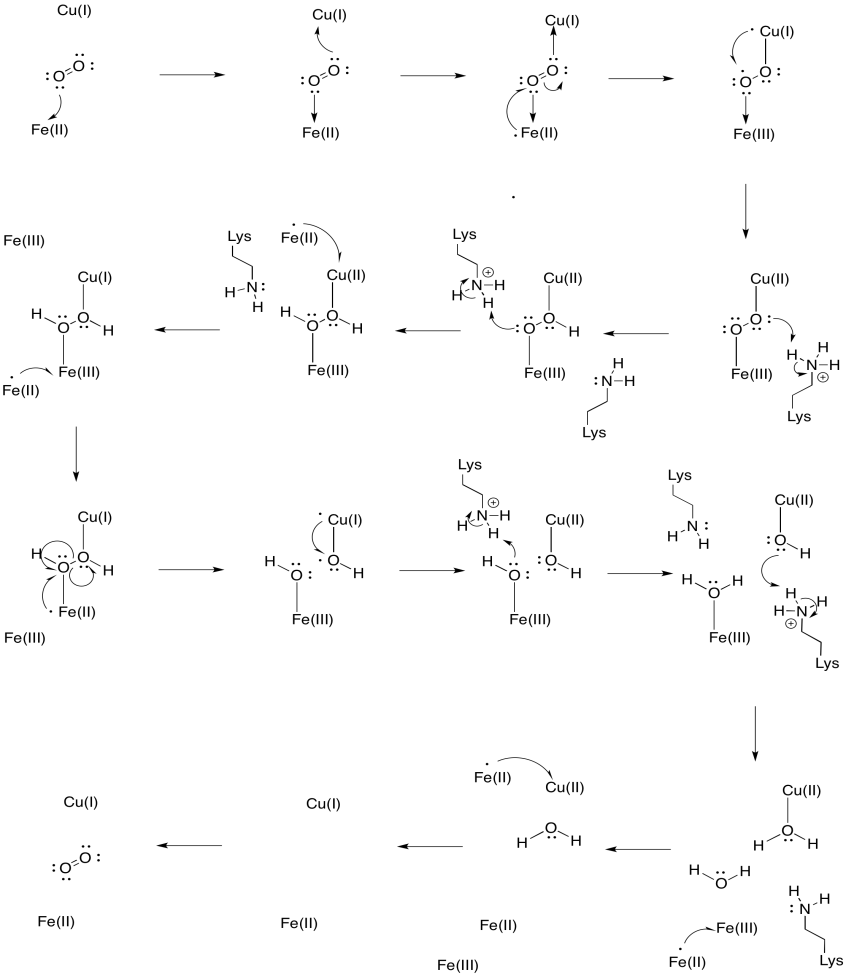
Předpokládejme, že železo v hemu a3 začíná ve sníženém stavu Fe (II) a mládě začíná ve sníženém stavu Cu (I). Zajistěte mechanismus pro redukci kyslíku na vodu s přidáním čtyř elektronů a čtyř protonů. Použijte Fe (II) jako dárce elektronů a lysin jako dárce protonů.
odpověď
kromě těchto dvou kovů existuje také modifikovaný konjugát histidin-tyrosinu vázaný na mládě. Bylo navrženo, že tento tyrosin poskytuje další zdroj okamžitých elektronů, které mohou být použity při redukci.
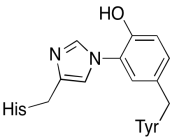
Cvičení \(\PageIndex{3}\)
Ukázat, proč tyrosin může být zdrojem protonu a elektronu v biochemických procesů.
Odpověď
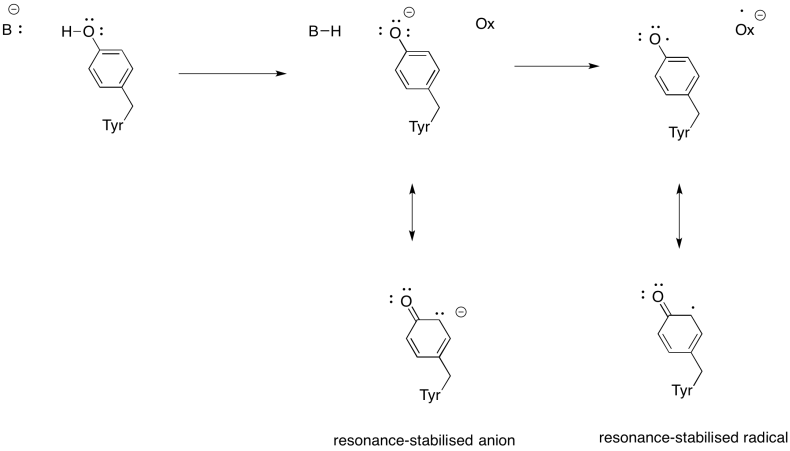
kromě toho je třeba snížit kyslíku do vody, Komplex IV také přispívá k protonového gradientu, další čerpání protonů přes mitochondriální membránu. Tento úkol představuje další výzvy. Jednoduchý spojovací mechanismus není možný, protože elektrony se pohybují v opačném směru. Je to však mechanismus zahrnuje konformační změny v proteinu, ke kterým dochází, když kovy mění oxidační stavy. Jemné změny v koordinačním prostředí mohou mít za následek vytěsnění aminokyselinových zbytků v okolí. Je snadné si představit, že pokud konkrétní aminokyseliny se posune nahoru směrem do mezimembránového prostoru, to může táhnout proton.
- čerpání protonů a transport elektronů probíhají v komplexu IV opačným směrem a musí být odpojeny.
- čerpání protonů v komplexu IV se musí spoléhat na konformační změny.
Cvičení \(\PageIndex{4}\)
CuA stránky obsahuje dva policajti, boound dva překlenovací cysteines. Oba jsou vázáni terminálními histidiny. Kromě toho je jedna měď vázána dalším methioninem, zatímco druhá je vázána karbonylem z proteinové páteře.
- nakreslete měďáky na jejich vazebná místa.
- popište geometrii každé mědi.
- pokud je každá měď Cu (I), jaký je počet koordinovaných elektronů na každé mědi v komplexu?
- pokud je každá měď Cu(I), jaký je celkový náboj komplexu?
Odpověď a)
)
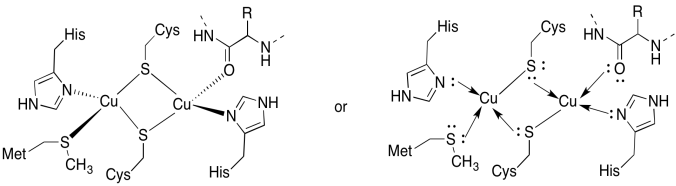
Odpověď b)
b) tetraedrické
Odpověď c)
c) Cu(I) = d10
4 dárci = 8 e-
celkem = 18e-
Odpověď d)
d) 2 x Cu(I) = 2+
2 x Cys-S- = 2-
Všechny ostatní neutrální
Celkem = 0
Cvičení \(\PageIndex{5}\)
měď v CuB stránky je vázán dvou histidines a histidin-tyrosin konjugát.
- nakreslete měď do vazebného místa.
- popište geometrii mědi.
- pokud je měď Cu (I), jaký je koordinovaný počet elektronů v komplexu?
- pokud je měď Cu (I), jaký je celkový náboj komplexu?
Odpověď a)
)
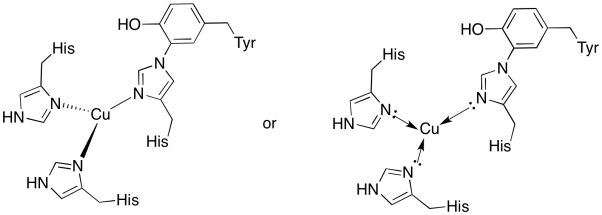
Odpověď b)
b) trigonal rovinné
Odpověď c)
c) Cu(I) = d10
3 dárci = 6 e-
celkem = 16 e-
Odpověď d)
d) Cu(I) = 1+
histidines neutrální
Celkem = 1+
Cvičení \(\PageIndex{6}\)
To je obtížné měřit potenciál snížení emisí jednotlivé stránky v rámci proteinu. Vědci však dokázali tyto hodnoty odhadnout měřením EPR spekter za různých podmínek. Za předpokladu, že snížení potenciálu níže nakreslete průběh reakce schéma pro transport elektronu celou cestu z cytochromu c na molekulární kyslík.
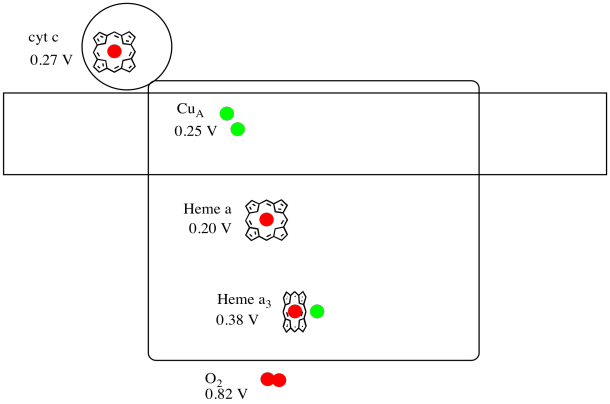 Odpověď
Odpověď
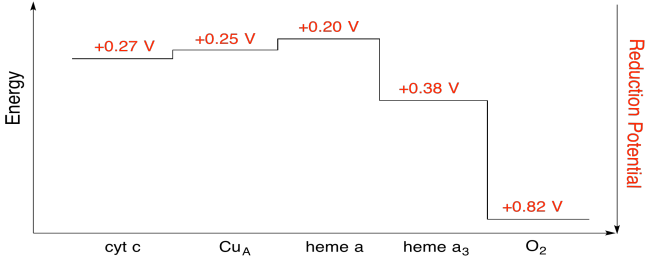
Cvičení \(\PageIndex{7}\)
Pomocí hodnot v obrázku výše, výpočet energie změnit, když elektron je přenesen z hem a hem a3.
Odpověď
za Předpokladu, redukční potenciály jsou:
hem a(ox) + e- → hemu(červené) Eored = 0,20 V
hem a3(ox) + e- → hem a3(červená) Eored = 0.38 V
Pak rozdíl potenciálů pro reakce, ΔEo = 0.38 – (0.20) V = 0.18 V.
Faraday vztahu ΔG = – n. F ΔEo dává
ΔG = – 1 x 96,485 J V-1 mol-1 x 0,13 V = 17,367 J mol-1 = 17.4 kJ mol-1
Atribuční
Chris P Schaller, Ph.d., (College of Saint Benedict / Saint John ‘ s University)