Aplikace bílkovin-fragment doplnění testy v buněčné biologii
- Úvod
- Princip
- Omezení
- Standardní Ovládací prvky pro DPS Studie
- Aplikace PCA na Bílkoviny Design: Knihovna Knihovna vs. Screening pro Optimální Interakci Proteinů
- Aplikace PCA na cDNA Knihovna Screening v Savčí Buňky
- Pomocí PCA jako Molekulární Pravítko: Receptor Studie
- Mapování Biochemické Sítí
- závěr
- poděkování
Úvod
Biochemické dráhy jsou opravdu systémů dynamicky montáž a demontáž proteinové komplexy, a tak, hodně z moderní biologický výzkum se zabývá tím, jak, kdy a kde proteiny interagovat s jinými proteiny zapojeny do biochemických procesů. Poptávka po jednoduchých přístupů ke studiu protein-protein interakcí, a to zejména ve velkém měřítku, se rozrostla v poslední době s pokrokem v genomu projekty, od příponu neznámého se známým genové produkty nabízí jedna zásadní způsob, kterým se funkce genu. S ohledem na tuto výzvu naše laboratoř vyvinula testy komplementace proteinových fragmentů (PCAs). V této strategii jsou dva zajímavé proteiny (proteiny a A B)fúzovány s komplementárními fragmenty reportérového proteinu (enzym, fluorescenční protein atd.). Pokud proteiny a a B interagují, reportér fragmenty jsou dohromady, složit do nativní struktury reportér a obnovil své aktivity (Obrázek 1). PCA reportér proteiny byly vybrány jako ty, které produkují různé detekovatelné aktivity, včetně fluorescenční, luminiscenční a barevné signály, stejně jako jednoduché přežití výběrové testy (1-14). Ukázali jsme, že strategie PCA má následující schopnosti: (i) umožňuje detekci interakcí protein-protein in vivo a in vitro v jakémkoli typu buněk; (ii) umožňuje detekci protein-protein interakcí ve vhodné buněčné prostory nebo organely; (iii) umožňuje detekci interakcí, které jsou specificky vyvolané v reakci na vývojové, nutriční, životního prostředí, nebo hormonálně indukované signály; (iv) umožňuje sledování kinetické a rovnovážné aspekty bílkovin sestavy v buňkách; a (v) umožňuje screening pro nové protein-protein interakcí v jakýkoliv typ buňky (2,3,6,9)(15-19).
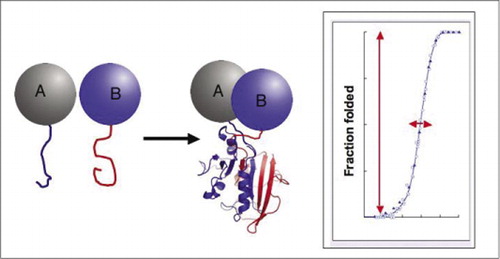
Pokud se dva proteiny interagují, reportér fragmenty jsou dohromady, složit do nativní struktury reportér bílkovin, a jeho činnost je rekonstituovaný (vlevo). Tyto protein-fragment doplnění analýz (Pca), mají fyzikální vlastnosti, které je činí zvláště užitečné jako reportéři dynamické proteinové komplexy. Vpravo je křivka skládání proteinů, kde osa x je nějaký proměnný parametr (např., koncentrace jednoho fragmentu vzhledem k druhému). Vysoká kooperativita tohoto procesu (velmi prudký nárůst zlomek složený druhů přes velmi úzký rozsah) znamená, že testy mají obrovský dynamický rozsah, což detekce komplexu virtuální all-or-none jev. To kontrastuje s metodami, jako je fluorescenční rezonanční přenos energie (FRET), který má velmi nízký dynamický rozsah a vyžaduje pečlivou optimalizaci řady parametrů. Naproti tomu měření tvorby proteinových komplexů pomocí PCA není obtížnější než měření aktivity intaktního reportérového enzymu.
Princip
Jsme ukázali princip PCA počínaje enzym dihydrofolátreduktázu (DHFR) jako reportér (1). Bylo zřejmé, že pokud skládací enzymu z jeho fragmentů (jako detekovány rozpuštění činnost) byla naprosto závislá na vázání spolu interagující proteiny, pak popsaný systém je, ve skutečnosti, detektor interakcí. My a další jsme už od prokázáno, že tento princip lze zobecnit do řady enzymů včetně Gaussia a Renilla luciferases, TEM β-laktamázy, stejně jako zelený fluorescenční protein (GFP) a jeho varianty (1-14). Klíčovým rysem PCA fragmentů je, že jsou navrženy tak, aby složit spontánně, aniž by byl přiveden do těsné blízkosti interakcí proteinů, které jsou pojistkou (1,20). Pokud by došlo k spontánnímu skládání, PCA by prostě nefungovala. Spontánní skládání by vést k falešně pozitivní signál, situace, která by beznadějně zkreslit interpretaci knihovna obrazovek in vivo (předpokládá se, že důležitou aplikaci). Na rozdíl od PCA, tam jsou zkoušky systémů na bázi β-galaktosidázy a rozdělit inteins, které se podobají PCA, ale které jsou koncepčně a prakticky jiný (21,22). V obou případech jsou známé přirozeně se vyskytující a spontánně sdružující podjednotky enzymů fúzovány s interakčními proteiny. Ústřední problém je, že podjednotky, i když slabě příponu, jsou vždy schopni do určité míry, což znamená, že tam je konstantní pozadí spontánní shromáždění.
Omezení
PCA strategie je obecné v tom smyslu, že není omezen na jediný enzym, reportér, a to byl navržen v několika různých formách, z nichž každá je nejvhodnější řešit konkrétní otázku. Například, jednoduché přežití-výběr těchto dohod, jako jsou ty založené na DHFR, jsou velmi užitečné pro knihovny výběr, zatímco luminiscenční nebo fluorescenční indikace Pca jsou nejlepší pro studium prostorové a časové dynamiky proteinových komplexů. Protože fúzní proteiny mohou být vyjádřeny v buňkách, které jsou relevantní modely pro studium určité biochemické dráhy, je pravděpodobné, že v jejich rodném biologického stavu včetně správná posttranslační modifikace (samozřejmě PCA fragmenty samy nesmí narušovat zaměření nebo modifikace proteinů, a to musí být testovány).
Mezi nejjednodušší a proto nejoblíbenější dohody O partnerství a spolupráci jsou založeny na fluorescenční proteiny (jako jsou GFP a varianty), protože signál je poskytována vnitřní fluorophore (7-9)(14,15,17,23). Nicméně, fluorescenční proteiny musí být vyjádřena na vysoké úrovni, aby se zajistilo, že signál je vyšší než pozadí buněčné fluorescence a fluorescenční protein Pca ukázaly být nezvratné, které mohou být užitečné (zachycení a vizualizaci vzácné komplexy), ale může také vést k nesprávnému výkladu obratu nebo lokalizace interakce proteinů (8,23,24). Na druhou stranu, dohody O partnerství a spolupráci založené na DHFR a β-laktamázy, jako reportéři byly prokázány, na základě nepřímých důkazů, reverzibilní po přerušení interakce, zatímco PCA založené na Gaussia luciferase bylo přímo prokázáno, že být reverzibilní (2,3,6). Reverzibilita PCA tak umožňuje detekci kinetických a rovnovážných aspektů sestavení a demontáže proteinových komplexů v živých buňkách (Obrázek 2).
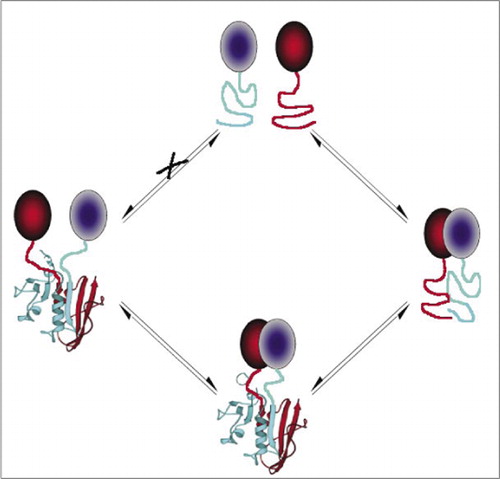
tím se zabrání spontánní asociaci fragmentů (cesta X), která může vést k falešnému signálu. Stejně tak jsou vybrány fragmenty, pro které by mělo dojít k spontánnímu rozvinutí fragmentů, když je proteinový komplex narušen(levá strana).
Standardní Ovládací prvky pro DPS Studie
PCA strategie vyžaduje fragmenty reportér protein sestavit a složit po proteiny zájmu tvořil komplex. Montáž a správné skládání reportér je závislá na využití strukturálních geometrie vnitřní reportéra proteiny a komplex vytvořený interakci proteinů. To je jeden z hlavních rozdílů DPS testech ve srovnání s fluorescenční rezonanční přenos energie (FRET) nebo bioluminiscence resonance energy transfer (BRET) nebo kvasinky dva-hybridní testy, a tato funkce nám umožnila provést struktury-na základě studie receptorem erytropoetinu (19). Obvykle vkládáme 10-aminokyselinový pružný polypeptidový linker sestávající z (Gly.Gly.Gly.Gly.Ser) 2 mezi sledovaným proteinem a fragmentem reportéru PCA (pro obě fúze). Tento linker byl vybrán, protože to je nejvíce flexibilní je to možné, a máme empiricky zjištěno, že linkery této délky jsou dostatečně dlouhé, aby se na fragmenty, aby se navzájem najít a složit, bez ohledu na velikost interakci proteinů, které fragmenty jsou zničeny (16).
aby nedošlo k nespecifickým reakcím, měla by být provedena sada kontrol. Tyto kontroly mohou zahrnovat následující, i když první je nejdůležitější: (i) neinteragující proteiny. Odpověď PCA by neměla být pozorována, pokud se jako partneři PCA používají neinteragující proteiny; nadměrná exprese samotného neinteragujícího proteinu by také neměla soutěžit o známou interakci. ii) mutace partnerského proteinového rozhraní. Bodová nebo deleční mutace partnera, o kterém je známo, že narušuje interakci, by také měla zabránit odpovědi PCA. iii) soutěž. PCA reakce by měla být snížena současným zvýšená exprese jednoho nebo druhého z interagujících proteinů, které není pojistkou k doplňkové DPS fragment. (iv) výměna fragmentů. Pozorovaná interakce mezi dvěma proteiny by měla nastat, i když jsou proteiny vyměněny s příslušnými reportérovými fragmenty.
Aplikace PCA na Bílkoviny Design: Knihovna Knihovna vs. Screening pro Optimální Interakci Proteinů
Mezi první aplikace PCA byla k proteinu konstrukční problém. Na DHFR PCA testu byl použit v Escherichia coli na obrazovce dvě knihovny doplňkově navržen tak, leucin zipper-tvoří sekvence s 1010 potenciální interakce párů, které jsme mohli prakticky kryt 106. Prokázali jsme, že PCA obrazovky, vybrané jak pro optimální vazebné specifičnosti, jakož i rozpustnost a výraz v interakci zipy (18,25). Nejdůležitějším rysem tohoto přístupu je, že bylo možné současně obrazovce dvě knihovny proti sobě, proces není snadno dosáhnout se srovnatelnou droždí two-hybrid obrazovky. Jednoduchost tohoto přístupu a specifické povahy informací získaných o návrhu strategie naznačují široké nástroj pro DHFR PCA na bílkoviny designu a řízené evoluce experimenty. To také ukazuje, že PCA doplňuje phage display strategií, protože celý výběr, optimalizace a přísnosti testů se provádí in vivo, což činí tento přístup jednoduše popraven.
Aplikace PCA na cDNA Knihovna Screening v Savčí Buňky
prvním krokem při definování funkce román genový produkt je určit její interakce s jinými genových produktů. Nicméně, čistě proteinové interakce založené na screening (jako jsou kvasinky two-hybrid) je omezená, protože je to jen vám řekne, že dva proteiny interagují, a zároveň neposkytuje žádné další informace, které by mohly mít vazbu proteinu na jeho funkci. Proto jsme ukázali, že PCA lze použít ve screeningové strategii knihovny cDNA, která kombinuje jednoduchou obrazovku interakce proteinů na bázi buněk se specifickými funkčními testy, které poskytují počáteční validaci biologického významu interakce (9). Prvním krokem je screening fyzických interakcí mezi návnadou a knihovnou kořistních proteinů kódovaných cDNA sledováním rekonstituce reportéru PCA v neporušených živých buňkách. Důležitým rysem této první krok je, že interakce mohou být detekovány přímo a mezi full-délka bílkovin v buňkách, v nichž návnada bílkovin obvykle funkce, tedy zajištění, že třeba subcelulární cílení, posttranslační modifikace, a interakce s jinými proteiny mohou nastat. Je zřejmé, že pro experimentální platnost musí být prokázáno, že fragmenty PCA neinterferují s cílením nebo modifikací proteinů. Ve druhém kroku může být interakce s proteiny funkčně validována následovně: za prvé, protein interakce, zjištěn PCO, musí být rozrušený tím, že látky, například hormony nebo specifické inhibitory, které je známo, modulují specifické biochemické cesty, v nichž se bílkoviny účastní. Prokázali jsme to pro DHFR PCA a použili jsme tuto vlastnost k mapování signálních drah v živých savčích buňkách (16). Za druhé, subcelulární lokalizace proteinové interakce, opět detekovaná PCA, může být změněna látkami, které modulují cestu. Screeningová strategie založená na PCA tedy kombinuje jednoduchý screeningový krok s přímými funkčními testy. My a další jsme použili tuto strategii k identifikaci nových substrátů nebo regulátorů serin / threonin protein kinázy, PKB / Akt (9,15,26,27).
Pomocí PCA jako Molekulární Pravítko: Receptor Studie
speciální funkce PCA strategie je, že pokud víme, tří-dimenzionální struktury reportér enzymu, je možné přesně předpovědět, jak blízko k sobě fragmenty musí být se ujistit, že enzym bude složit správně a mají měřitelné činnosti. Tento fakt byl dán k práci na testování strukturálních alosterický model pro aktivaci dimerní receptor erytropoetinu (EpoR) pomocí DHFR PCA, a tento přístup by mohl být rozšířen na studium alosterický přechody v dimerní nebo multimeric bílkovin rozhraní (19). V případě EpoR bylo prokázáno, že transmembránové domény dimeru receptoru jsou odděleny 73 Å, jak bylo pozorováno v krystalové struktuře neignatovaného Eporu. To bylo odůvodněné, že pokud to neaktivním stavu existuje na membráně živých buněk, pak DHFR úlomky přilepené k C termini z transmembránové domény by složit pouze v případě ligandem indukované konformaci změny, které umožňují fragmenty přijít dostatečně blízko, aby vás ujistit, že přesné trojrozměrné struktury DHFR mohla být vytvořena (19,28). To by vyžadovalo, aby N termini fragmentů byly 8 Å od sebe. Vložení flexibilní linker peptidy mezi transmembránové domény a DHFR fragmenty nám umožnilo sondy, vzdálenost mezi body vložení extracelulární domény dimeru a potvrdit, že linkery dost dlouho, aby span 73 Å byly potřebné pro DHFR složit z jeho fragmenty.
Mapování Biochemické Sítí
Buněčné biochemické strojů pro metabolismus, signální kaskády a buněčného cyklu jsou příklady dynamicky montáž a demontáž makromolekulární komplexy. Ty jsou definovány seskupením interakčních proteinů podle jejich podobných odpovědí na soubor poruch (hormony, metabolity, inhibitory enzymů atd.). Interakce Protein-protein lze použít k propojení proteinu neznámé funkce s proteiny, o nichž je známo, že jsou zapojeny do známého biochemického procesu. Prokázali jsme, že farmakologické profilování (sledování účinků cesta-specifických léků, a proteinové hormony na protein-protein interakce) a stanovení buněčné umístění protein-protein interakcí může být dosaženo pomocí Pca (9)(15-17)(26). Analýza tyto výsledky umožňují pro znázornění, jak biochemické sítě se vyvíjejí v čase a prostoru a v reakci na specifické podněty. Jako důkaz principu, jsme informovali uplatňování této strategie mapování transdukce signálu cestou zprostředkované receptory tyrozinkináz (RTKs) (16). Farmakologické profily a buněčné umístění interakcí, které jsme pozorovali, nám umožnily umístit každý genový produkt do příslušného bodu v drahách (obrázek 3). Z výsledků naší analýzy se objevila mapa organizace sítě RTK, která byla v souladu se stávajícími modely, ale zahrnovala také několik nových interakcí. Schopnost monitorovat síť proteinových interakcí v živých buňkách obsahujících všechny složky studované základní cesty odhalila skrytá spojení, která nebyla dříve pozorována, navzdory intenzivní kontrole této sítě. Předložené výsledky ukazují, že strategie PCA má vlastnosti nezbytné pro obecnou validaci genových funkcí a strategii mapování cest. Nedávné aplikace většího souboru Pssh umožnila rozvoj obecného přístupu na odkaz akce léčiv na specifické signální dráhy a zjištění nepředvídaných činností drog (17).
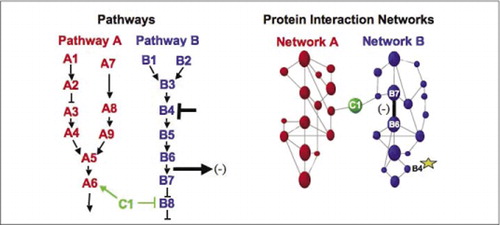
(Vlevo) akce inhibiční rušivé činidlo, které působí na bílkoviny B4 (T-bar), je detekován navazující změnou v interakci proteinů B6 a B7 s sebou (šipka). V tomto případě je účinkem poruchy snížení počtu interakčních proteinů ( – ) detekovaných reportérem této interakce (výstupní signál interakce detekovaný například PCA sentinel). Účinek by však mohl být stejně pozitivní v závislosti na důsledcích inhibice upstream proteinu. (Vpravo) V proteinové interakce sítě pro cestu B, rozrušení bílkovin B4 (hvězda) nějak se šíří prostřednictvím sítě nějak ovlivňují odkaz (široký pruh) mezi proteiny, B6 a B7. To neznamená, že protein B4 fyzicky interaguje buď s B6 nebo B7; šíření vliv skrze proteinové interakce sítě, může být v důsledku přímého fyzického spojení, nebo enzymatických procesů, které nejsou zřejmé v síti.
závěr
vývoj a aplikace PCA stále probíhá. Například, kromě omezeného, i když informativní, sady aplikací zde popsaných, strategie se aplikuje na rozsáhlý screening celých genomů. Sofistikovanější problémy bílkovin design a skládání bílkovin jsou zkoumány, včetně studií z faktorů, které řídí výběr sekvence pro optimální interakce mezi proteiny, bílkoviny a nukleové kyseliny, proteiny a malých organických molekul. PCA je velmi obecný a flexibilní experimentální přístup, a proto bychom měli v blízké budoucnosti očekávat rostoucí počet nových aplikací tohoto základního nástroje pro molekulární a buněčnou biologii.
poděkování
Stephen Michnick je držitelem kanadského výzkumného křesla v integrační genomice. Výzkum citovaný z naší laboratoře byl financován kanadskými instituty výzkumu zdraví.
- 1. Pelletier, J. N., F. X. Campbell-Valois, a W Michnick. 1998. Oligomerization domain-režie montáž aktivní dihydrofolátreduktázu z racionálně konstruované fragmenty. Proc. Natle. Acad. Věda. USA 95: 12141-12146.Crossref, Medline, CAS, Google Scholar
- 2. Remy, I.A S. W. Michnick. 1999. Klonální selekce a in vivo kvantifikace proteinových interakcí s komplementačními testy protein-fragment. Proc. Natle. Acad. Věda. USA 96: 5394-5399.Crossref, Medline, CAS, Google Scholar
- 3. Galarneau, A., M. Primeau, L. E. Trudeau, a W Michnick. 2002. Beta-laktamázový proteinový fragment komplementační testy jako in vivo a in vitro senzory interakcí proteinových proteinů. Adresa. Biotechnol. 20:619–622.Crossref, Medline, CAS, Google Scholar
- 4. Wehrman, T., B.Kleaveland, J. H. Her, R. F. Balint a H. M. Blau. 2002. Interakce Protein-protein sledované v buňkách savců prostřednictvím komplementace fragmentů enzymu beta-laktamázy. Proc. Natle. Acad. Věda. USA 99: 3469-3474.Crossref, Medline, CAS, Google Scholar
- 5. Spotts, J. M., R. E. Dolmetsch, a. M. E. Greenberg. 2002. Časosběrné zobrazování dynamické interakce protein-protein závislé na fosforylaci v savčích buňkách. Proc. Natle. Acad. Věda. USA 99: 15142-15147.Crossref, Medline, CAS, Google Scholar
- 6. Remy, I.A S. W. Michnick. 2006. Vysoce citlivý test interakce protein-protein založený na Gaussia luciferase. Adresa. Metody 3: 977-979.Crossref, Medline, CAS, Google Scholar
- 7. Ghosh, I., A. D. Hamilton a L. Regan. 2000. Antiparalelní leucin zip-directed protein reassembly: aplikace na zelený fluorescenční protein. J.Am. Cheme. SOC. 122:5658–5659.Crossref, CAS, Google Scholar
- 8. Hu, C.D., Y. Chinenov a T. K. Kerppola. 2002. Vizualizace interakcí mezi proteiny rodiny bZIP a Rel v živých buňkách pomocí bimolekulární fluorescenční komplementace. Molo. Buňka 9: 789-798.Crossref, Medline, CAS, Google Scholar
- 9. Remy, I.A S. W. Michnick. 2004. Funkční screeningová strategie knihovny cDNA založená na testech doplňování fluorescenčních proteinů k identifikaci nových složek signálních drah. Metody 32: 381-388.Crossref, Medline, CAS, Google Scholar
- 10. Remy, I., F. X. Campbell-Valois, G. Ghaddar, S. Aquin, a W Michnick. 2005. Detekce proteinových interakcí a screening knihovny s komplementačními testy protein-fragment, s. 637-672. V interakcích Protein-Protein: příručka molekulárního klonování, 2.vydání. Csh Laboratory Press, Cold Spring Harbor, NY.Google Scholar
- 11. Paulmurugan, R. A S. S. Gambhir. 2003. Sledování protein-proteinových interakcí pomocí split syntetické renilla luciferase protein-fragment-asistované doplnění. Anální. Cheme. 75:1584–1589.Crossref, Medline, CAS, Google Scholar
- 12. Paulmurugan, R., Y. Umezawa A S. S. Gambhir. 2002. Neinvazivní zobrazování interakcí protein-protein u živých subjektů pomocí reporter proteinové komplementace a rekonstituční strategie. Proc. Natle. Acad. Věda. USA 99: 15608-15613.Crossref, Medline, CAS, Google Scholar
- 13. Luker, K.E., M. C. Smith, G. D. Luker, S. T. Gammon, h. Piwnica-Worms, a D. Piwnica-Worms. 2004. Kinetika regulovaných interakcí protein-protein odhalena zobrazením komplementace světlušky luciferázy v buňkách a živých zvířatech. Proc. Natle. Acad. Věda. USA 101: 12288-12293.Crossref, Medline, CAS, Google Scholar
- 14. Jach, G., M. Pesch, k. Richter, s. Frings a J. F. Uhrig. 2006. Vylepšený mRFP1 přidává červenou k bimolekulární fluorescenční komplementaci. Adresa. Metody 3: 597-600.Crossref, Medline, CAS, Google Scholar
- 15. Remy, I., a. Montmarquette A S. W. Michnick. 2004. PKB / Akt moduluje signalizaci TGF-beta přímou interakcí se Smad3. Adresa. Cell Biol. 6:358–365.Crossref, Medline, CAS, Google Scholar
- 16. Remy, I.A S. W. Michnick. 2001. Vizualizace biochemických sítí v živých buňkách. Proc. Natle. Acad. Věda. USA 98: 7678-7683.Crossref, Medline, CAS, Google Scholar
- 17. Macdonald, M. L., J. Lamerdin, S. Owens, B. Keon H., G. K. Bilter, Z. Shang, Z. Huang, H., Yu et al.. 2006. Identifikace off-cílových účinků a skrytých fenotypů léčiv v lidských buňkách. Adresa. Cheme. Biol. 2:329–337.Crossref, Medline, CAS, Google Scholar
- 18. Pelletier, J. N., K. M. Arndt, A. Pluckthun, a W Michnick. 1999. In vivo knihovna versus knihovna výběr optimalizovaných interakcí protein-protein. Adresa. Biotechnol. 17:683–690.Crossref, Medline, CAS, Google Scholar
- 19. Remy, I., I. a. Wilson a W Michnick. 1999. Aktivace receptoru erytropoetinu změnou konformace vyvolanou ligandem. Věda 283: 990-993.Crossref, Medline, CAS, Google Scholar
- 20. Gegg, C.V., K. E. Bowers a C. R. Matthews. 1997. Sondování minimálních nezávislých skládacích jednotek v dihydrofolátreduktáze molekulární disekcí. Protein Sci. 6:1885–1892.Crossref, Medline, CAS, Google Scholar
- 21. Rossi, F., C. a. Charlton a H. M. Blau. 1997. Sledování interakcí protein-protein v intaktních eukaryotických buňkách komplementací beta-galaktosidázy. Proc. Natle. Acad. Věda. USA 94: 8405-8410.Crossref, Medline, CAS, Google Scholar
- 22. Ozawa, T., S.Nogami, m. Sato, y. Ohya a Y. Umezawa. 2000. Fluorescenční indikátor pro detekci interakcí protein-protein in vivo na základě sestřihu proteinů. Anální. Cheme. 72:5151–5157.Crossref, Medline, CAS, Google Scholar
- 23. Magliery, T. J., C. G. Wilson, w. Pan, D. Mishler, i. Ghosh, A. D. Hamilton a L. Regan. 2005. Detekce interakcí protein-protein se zeleným fluorescenčním fragmentem proteinu: rozsah a mechanismus. J.Am. Cheme. SOC. 127:146–157.Crossref, Medline, CAS, Google Scholar
- 24. Nyfeler, B., s. W. Michnick, a H. P. Hauri. 2005. Zachycení proteinových interakcí v sekreční dráze živých buněk. Proc. Natle. Acad. Věda. USA 102: 6350-6355.Crossref, Medline, CAS, Google Scholar
- 25. Arndt, K.M., J. N. Pelletier, K. M. Muller, T. Alber, s. W. Michnick a a. Pluckthun. 2000. Heterodimerní stočený-coil peptid pár vybrán in vivo z navrženého knihovny versus knihovny souboru. J. Mol. Biol. 295:627–639.Crossref, Medline, CAS, Google Scholar
- 26. Remy, I.A S. W. Michnick. 2004. Regulace apoptózy proteinem Ft1, novým modulátorem proteinkinázy B / Akt. Molo. Buňka. Biol. 24:1493–1504.Crossref, Medline, CAS, Google Scholar
- 27. Ding, z., J. Liang, y. Lu, Q. Yu, z. Songyang, s. y. Lin a G. B. Mills. 2006. Retrovirová obrazovka pro komplementaci proteinů odhaluje funkční partnery vázající AKT1. Proc. Natle. Acad. Věda. USA 103:15014–15019.Crossref, Medline, CAS, Google Scholar
- 28. Cody, V., J.R. Luft, E. Ciszak, T.I. Kalman, and J.H. Freisheim. 1992. Crystal structure determination at 2.3 A of recombinant human dihydrofolate reductase ternary complex with NADPH and methotrexate-gamma-tetrazole. Anticancer Drug Des. 7:483–491.Medline, CAS, Google Scholar