Chloridových iontových kanálů a transportérů: od zajímavosti z přírody a zdrojem lidských onemocnění, drogové cíle
Publikováno: 20. srpna 2013 | |
Brzy v jejich pregraduální vzdělání, student se seznámí s různými typy integrální protein membrány: receptory, adhezivní proteiny, iontové kanály, iontové pumpy a iontové transportéry. Jak oni postupují přes jejich studií, zjistí, že diskrétní genových rodin a bílkovinné struktury jsou odpovědné za tyto různé proteinové třídy a nikdy není žádný důvod se domnívat, že tam by mohlo být nějaké nejasnosti v přidělování konkrétní protein, na jeho příslušné bílkoviny.třídy.
To splňuje prakticky každý případ z učebny do výzkumné laboratoře, dokud považujeme chloridových kanálů. Víme, že existují, jsou důležité, a možná udělat dobrý lék cíle v několika onemocnění oblastech, ale až do nedávné doby, že zůstal poněkud stigmatizovány a nemoderní ve světě therapeutics. Nedostatek selektivních ligandů vůbec nepomohl. Jedinou výjimkou z toho byl receptor GABA-a, který je spojen s vnitřním chloridovým kanálem, který se otevírá po vazbě inhibičního neurotransmiteru GABA. Benzodiazepiny byly potencuje tento receptor od té doby, co Valium stal k dispozici v roce 1960, poskytuje uklidňující a antikonvulzivní účinky. To představuje důležitý koncept: existuje několik genových rodin a různých typů proteinů, které lze popsat jako chloridové kanály.
To je na rozdíl od toho, co jsme pochopili z kation-selektivní iontové kanály tam, kde je malý prostor pro flexibilitu při proteinové struktury, které mohou tvořit pór, který je selektivní pro draslík, sodík nebo vápník; rozmanitost těchto iontových kanálů je přinesla změny v proteinových domén se liší od pórů, které mají vliv na otevírání-zavírání chování. Abychom byli spravedliví, tam se nezdá být mnoho fyziologických důvodů, proč anion channel by měl vykazovat sodný-selektivita, jak tam je málo fyziologickou roli v membráně transport ostatní halogenidy nebo malé anionty; žádné anion channel bude ve výchozím nastavení být chloridový kanál z fyziologického hlediska. Na druhou stranu, membránové proudy draslíku, sodíku a vápníku hrají různé základní role a selektivní propustnost membrány pro tyto kationty je zásadní pro buněčnou funkci a samotný život.
GABA-A receptory jsou členy cys-loop pentameric ligand-gated ion channel rodin, které zahrnují několik typů excitační a inhibiční neurotransmiter-gated kanály. Protein transmembránového regulátoru cystické fibrózy (CFTR) je nukleotidem regulovaný chloridový kanál. Je členem různých ATP-binding cassette (ABC) transportéry rodiny a je jediný, který se nezdá k transportu substrátu přes membránu, ale spíše funguje jako chloridový kanál. Rodina CLC napěťově řízených chloridových kanálů pochází z jiné odlišné rodiny genů a má obecnou strukturu jedinečnou mezi membránovými proteiny. Tato rodina proteinů přinesla za posledních 30 let mnoho překvapení a zde budou představeni členové této rodiny a také to, jak by mohli být považováni za drogové cíle.
Další vzrušující vývoj od chloridový kanál poli se objevily následující molekulární identifikace proteinů hlubších vápníkem aktivované draselný (ClCa) programy. Funkčně, víme o jejich fyziologické role pro nějaký čas, ale nedávné molekulární identifikace kanálu proteinů umožnila rozvoj molekulární a farmakologické nástroje, zkoumat a měnit jejich činnost. Tato recenze se zaměřuje na farmakologický potenciál cílení ClCa programy a CLC proteiny, jejich funkce a subcelulární lokalizace jsou shrnuty na Obrázku 1.
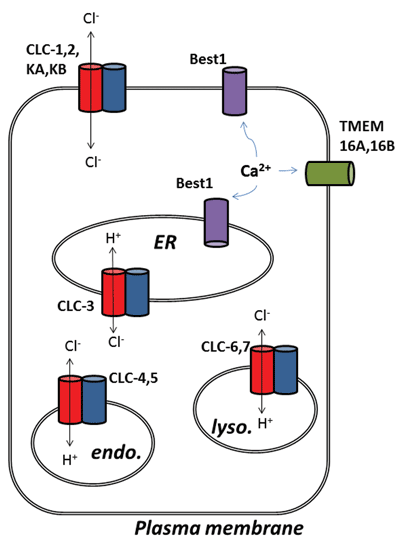
Obrázek 1
úvod do CIC, bílkoviny
devět členů této proteinové rodiny jsou CLC-1 až 7, CLC-KA a KB. Zakládající člen, CLC-1, je napěťově řízený chloridový kanál kosterního svalu a bude popsán níže. Mnoho funkční studie byly provedeny na homolog s čestný titul CLC-0, izolované od Electroplax elektrický orgán, který umožňuje ray omráčit své vodní obětí. Rekonstituce CLC-0 na lipidové dvojvrstvy a elektrofyziologický záznam proudů protékajících jednotlivými iontovými kanály odhalily zajímavou vlastnost. Obvykle, při nahrávání aktuální z malého kousku membrány obsahující jeden iontový kanál, pozoruje kolísání mezi dvěma aktuální amplitudy: jeden představuje uzavřený kanál a druhý představuje proud, který teče přes otevřený kanál. Fluktuace odrážejí přechody mezi otevřenými a uzavřenými kinetickými stavy. U CLC-0 však bylo zřejmé, že protein s jedním iontovým kanálem sestával ze dvou ekvivalentních pórů, které se mohly samostatně otevírat1. Tento kanál byl proto popsán jako dvouhlavňový (Obrázek 2). Nebylo tedy velkým překvapením, že krystalové struktury homologů z enterických bakterií odhalily, že proteinový komplex je dimer, přičemž každá podjednotka má iontově vodivou cestu2 (Obrázek 2).
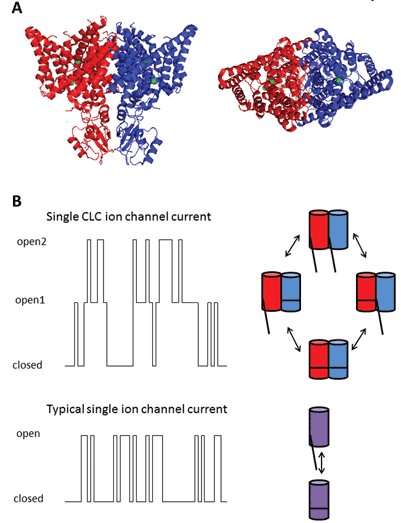
Obrázek 2
druhé překvapení vzniklo, když byly provedeny podrobné funkční experimenty na CLC-ec1 z E. coli. Spíše než funguje jako chloridový kanál, stejně jako jeho dávno ztraceného příbuzného v obratlovců kosterní sval, CLC-es1 je 2Cl–/H+ výměny transportní, nebo antiporter, s přísnou 2:1 směnný stoichiometry3. Tento protein je důležitý pro přežití střevních bakterií v nízké pH4 a je pravděpodobné, využívat chloridový gradient udržet buněčné pH na přijatelnou úroveň. Prokaryotické CLC by proto mohly být cílovými inhibitory pro léčbu patogenní infekce E. coli nebo Salmonely4. Objev iontové výměny chování přirozeně stimulovány další úsilí k určení, zda tento chloridu sodného-pro-proton exchange existovala v savčích CLCs, na předpokladu, že Cl–/H+ výměna je možná pravda, funkce archetypální CLCs a ty, které byly identifikovány jako chloridových kanálů může být jen výjimky z pravidla. To se zdá být případ, protože tam je silný důkaz, že CLC-3 přes CLC-7 funkce jako 2Cl–/H+ výměna, transportéry, zejména s bydlištěm v intracelulární organely, zatímco CLC-1, CLC-2, KA a KB jsou pravdivé plazmatické membrány sodný-vedení ion channels5-9. Protože archetypální CLC nemovitost je exchange transport, bylo nalezeno přes všechny formy buněčného života, druhý podtřídy bílkovin, bona fide chloridové kanály, proto může být považován za “rozbité” chlorid transportéry, které ztratily spojení chlorid dopravy na pohyb druhého substrátu ion.
CLC-1
Tento zakladatel CLC rodina je napětí-gated sodný kanálu kosterního svalstva a slouží k regulaci membránového potenciálu a repolarise membrány následující akčních potenciálů, k relaxaci svalů. Ve většině tkání bychom očekávali, že tuto roli budou hrát draslíkové kanály, což dělají v srdečním a hladkém svalstvu, stejně jako regulace excitability membrány v jiných typech buněk. Systém příčných tubulů je rozšířením plazmatické membrány (sarkolemma) a proniká do kontraktilní tkáně. Je rozhodující pro rychlé šíření elektrické aktivity v celém svalu a organizuje rychlou a kontrolovanou kontrakci. Eflux draslíku ze svalových buněk do uzavřených prostor t-tubulu by zvýšení extracelulární koncentrace draslíku a kolapsu tento iontový gradient, který by vedl k dlouhodobé depolarizaci membrány. S chloridovými kanály, které hrají převažující repolarizační roli, je tomu zabráněno. Ztráta funkce mutací v CLC-1 vést ke křeči v člověku, koz a myší (po nedávné recenzi see10) a je charakterizován poruchou svalové relaxace, v souladu s ztráta repolarizací membrány aktuální.
s expresí omezenou na kosterní sval může být CLC-1 atraktivním cílem pro léky, které kontrolují svalovou kontrakci zvýšením nebo snížením funkce CLC-1, a tím snižují nebo zvyšují excitabilitu svalů. Sloučeniny, které zvyšují funkci CLC-1, by mohly být schopny léčit myotonii, zejména v případech, kdy by mohly kompenzovat částečnou ztrátu aktivity chloridového kanálu. Inhibice CLC-1 by mohla snížit práh svalové kontrakce a může být užitečná v případech svalové slabosti nebo degenerativních onemocnění, jako je svalová dystrofie.
CLC-2
vnitřně usměrňující chloridový kanál, CLC-2, má poněkud rozšířenou tkáňovou distribuci. Nachází se v centrálních neuronech, kde reguluje neuronální aktivitu11-13. V astrocytech je jeho subcelulární cílení na buněčné křižovatky regulováno interakcí s Glialcamem (MLC1), mutacemi, které narušují toto cílení a způsobují megalencefalickou leukoencefalopatii14. Nedávné terapeutické zájmy zahrnují expresi CLC-2 ve střevní sliznici a plicních bronchiolech, kde hraje roli ve střevní a plicní sekreci, resp. Lubiproston, lék používaný klinicky k úlevě od zácpy, byl navržen tak, aby uplatňoval svůj účinek aktivací CLC-2, ale tento účinek je kontroverzní. Zatímco tato sloučenina aktivuje CLC-2 kanály v některých studiích, v jiných reguluje CLC-2 s drogami a zvyšuje CFTR funkce prostřednictvím receptoru prostaglandinu activation15,16. Existují však dostatečné důkazy, že zvýšení funkce CLC-2 dýchacích cest by mohlo poskytnout alternativní chloridovou dráhu v cystické fibrózě17.
CLC-KA/KB
Tyto chloridové kanály jsou zejména vyjádřeny v renální epitelu a přispívat k propustnosti buněčné membrány pasivní chlorid toku. Mají klíčovou roli ve vzestupných končetinách a distálních tubulech nefronu a poskytují bazolaterální cestu pro reabsorpci chloridů po transportu z primární moči přes apikální membránu. Gen CLCKB, který kóduje CLC-KB, je jedním z pěti genů, které jsou základem Bartterova syndromu. Ztráta funkčních mutací v CLC-KB vede k defektní reabsorpci chloridů, což vede k poruše plýtvání solí, která je spojena s polyurií. Jedním z hlavních rysů jedinců postižených mutacemi CLC-KB (Bartterův typ III) je nízký krevní tlak. Více těžkou formou onemocnění je způsobeno mutacemi v BSND gen (Bartterův typ IV), který kóduje Barttin, příslušenství, bílkoviny důležité pro obchodování se oba CLC-KA a KB plazmy membrane18. Tato forma poruchy také zahrnuje smyslovou hluchotu, o které se předpokládá, že je způsobena ztrátou přenosu CLC-KA i KB na epiteliální membrány ve vnitřním uchu. Lze předpokládat, že ztráta aktivity CLC-KA nebo KB, ale ne obojí, může být tolerována sluchovým systémem. To naznačuje, že inhibitory selektivní buď pro CLC-KA nebo CLC-KB, nebo částečná inhibice obou, mohou působit jako nové kličkové diuretikum s potenciálem snížit krevní tlak a s několika vedlejšími účinky. To vedlo ke studiu jejich farmakologie a vývoji nových derivátů inhibitorů s nízkou mikromolární afinitou19, které měly diuretické účinky při podávání krysám20. Na druhé straně léky, které aktivují kanály CLC-KB, mohou zvýšit zbytkovou aktivitu defektních kanálů u pacientů s Bartterem typu III.
CLC-7
podtřídy výměnného transportéru 2Cl- / H+ je CLC-7 slibným cílem účinku léku a jeho inhibice může být prospěšná při osteoporóze. Tato indikace opět vychází z pozorování lidského onemocnění způsobeného ztrátou funkčních mutací v CLC-7, které způsobují osteropetrosis21. U této poruchy je remodelace kostí osteoklasty nedostatečná, o čemž se předpokládá, že je způsobena defektní sekrecí kyseliny a enzymu. To vede k husté kosti, která, pokud je reprodukována inhibitorem CLC-7, by mohla snížit rozpouštění kosti, a proto posílit kostru pacientů s osteoporózou22, 23. Ve studiích proof-of-concept farmakologická inhibice okyselení24 nebo narušení funkce CLC-7 protilátkami25 snížila resorpci kostí. Nicméně, CLC-7 inhibice nemusí být bez komplikací, protože lidské a myší studie naznačují, že nedostatek CLC-7 funkce může být také spojena s neuronální skladování a degenerace poruchy z důvodu snížené lysosomální function26.
Ztráta-of-funkce lidské mutace – poučení z CFTR
stojí za krátké pauze se na tento bod, aby zvážila, že některé léčebné indikace pro román CLC-cílené léky mají za cíl léčit poruchy odlišné a na opačném konci spektra ty, které jsou způsobené vadným CLC funkci. Kromě výše popsaných onemocnění je Dent ‘ S I onemocnění ledvin spojené s X, které je způsobeno ztrátou funkce CLC-5 (viz27 pro nedávný přehled). Všechny jsou vzácné dědičné poruchy a hlavní defekt proteinu zahrnuje buď sníženou aktivitu bílkovin, nebo přenos na cílovou membránu. Ve skutečnosti mnoho jednotlivých mutací způsobuje retenci ER a nedostatek zrání bílkovin. Paralela by mohla být provedena s cystickou fibrózou, přičemž většina postižených jedinců má mutaci ΔF508 zadrženou ER. Nedávné a rozvrstvené přístupy k léčbě cystické fibrózy byly výsledkem dual-pronged útok opravit mutovaný protein skládací (CF korektory) a/nebo zvýšit aktivitu plazmatické membrány chloridových kanálů CFTR (CF potenciátory). Úspěch je rozvíjející se potenciátor class28, které jsou účinné u pacientů s mutacemi, které snižují CFTR činnost bez ztráty biosyntézu bílkovin nebo obchodování s lidmi (např. G551D), nicméně účinnost skládací korektor (který je vyžadován ve většině případů) zůstává established29. I když onemocnění spojených se ztrátou CLC funkce jsou vzácné genetické poruchy, možná jednoho dne budou moci léčbě jedinců s myotonií, Bartterův syndrom, Dent je nemoc a osteopetrosis, stejně jako je cystická fibróza s léky, které, jaká je skutečná příčina jejich onemocnění.
Vápníkem aktivované draselný kanálů
Konečně, zmíněny budou vápník-aktivuje sodný (ClCa) programy, které mají jasně definované fyziologické role v řadě buněčných typů, ale jejich molekulární identifikace utrpěl několik falešných a koktal začíná. Příběh zahrnuje čtyři typy bílkovin: členy genových rodin CLCA, Bestrophin, Tweety a TMEM16. Ve všech případech, jejich rekombinantní expresí za následek generace membrány chlorid proudy, které jsou stimulovány zvýšením intracelulární koncentrace vápníku, a v různém rozsahu, membránové depolarizaci. Cesta pro CLCA přišel do konce, když bylo zjištěno, že tento byl protein, který je vylučován, ale také pravděpodobné, že upregulated membrány výraz ClCa programy endogenního vyjádření system30. Tweety a Bestrophin proteiny nevykazují všechny vlastnosti ClCa programy studoval v hlavních tkáních, i když Best1 objeví zodpovědný za součást ClCa v senzorické neurons31 a může být také důležitým regulátorem uvolňování vápníku z endoplazmatického reticulum32,33. Tři nezávislé studie navrhované TMEM16A (také volal Ano1) jako kandidáta pro hlavní složku, pokud ne v plném rozsahu, vápník-aktivuje chlorid channel34-36. Mnoho následných studií, usnadněných generací molekulárních nástrojů, to podpořilo. TMEM16A je důležitý pro regulaci excitability membrány ve vaskulárním hladkém svalu, je upregulován ve zvířecím modelu plicní hypertenze a tón může být snížen inhibicí kanálu37,38. V senzorických neuronech TMEM16A spojuje přítomnost zánětlivých mediátorů s hyperexcitabilitou membrány a inhibice TMEM16A má antinociceptivní účinky39. U zvířecích modelů astmatu se exprese tohoto konkrétního chloridového kanálu zvyšuje a jeho inhibice může mít příznivé účinky40. To je také nalezené v intersticiálních buňkách Cajal střeva a funkce kanálu je nutná pro rytmickou kontrakci hladkého svalstva ve střevní stěně41. Kromě toho může aktivace TMEM16A poskytnout alternativní cestu pro sekreci epiteliálního chloridu v cystické fibrózě42. Zatímco tam je ještě nějaká debata kolem přesnou funkci zbytek TMEM16 rodiny, ClCa funkce byla také připsal TMEM16B (Ano2), která je základem ClCa kanál v čichové vlasy cells43,44. Mohou také existovat role pro tuto třídu iontového kanálu v biologii rakovinných buněk a jeho inhibice může zabránit buněčné proliferaci45-48.
Závěrečné poznámky
Tento přezkum má upozornila na rozdílné role chloridu vedení nebo transportu proteinů a jak se jejich dysfunkce vázané na lidské porucha nebo nemoc-jako symptomy na zvířecích modelech. Existuje závažný nedostatek farmakologických činidel, která inhibují, aktivují nebo zlepšují membránový obchod s chloridovými kanály a transportéry. Pokroku je dosahováno s léky, které reverzní vadné funkce CFTR u cystické fibrózy, který bude, doufejme, v důsledku léků, které jsou specifické pro různé typy zděděné mutace. Inhibitory a aktivátory TMEM16A vápníkem aktivované draselný channels42,49 se ukazuje jako užitečné laboratorní nástroje a nové sloučeniny by se účinné léky, zejména, pokud mohou přinést tkáňově specifické účinky. Molekuly specifické pro konkrétní CLC jsou pravděpodobně nejvíce nepolapitelné. Pochopení strukturálního základu napěťově řízené aktivace CLC50 může identifikovat proteinové domény, které jsou cílené racionálním strukturou založeným na návrhu léčiv. Takové nástroje nám umožní dát některé z nových terapeutických myšlenek, které zde byly přezkoumány a prezentovány k testu.
životopis autora

Dr. Jon Lippiat dokončil doktorát o struktuře, funkci a farmakologii draslíkových kanálů na univerzitě v Leicesteru. Studoval funkci beta-buněk pankreatu a diabetes na Oxfordské univerzitě před svým jmenováním jako lektor farmakologie na univerzitě v Leedsu. Jeho výzkum zahrnuje objasnění strukturálních a fyziologických vlastností několika různých typů iontových kanálů a Transportérů a jejich potenciální cílení novými farmakologickými činidly.
Problém
Problém 4 2013
Související témata
Chloridové kanály, lékových Cílů, Iontové Kanály,