Citrátové antikoagulace během CRRT pro akutní poškození ledvin
- Akutní poškození ledvin
- léčba Aki-renální substituční terapie pro AKI
- Hemodialýzy, hemofiltrace a hemodiafiltrace
- zahájení a načasování RRT pro AKI – intermitentní versus kontinuální RRT
- Antikoagulace během kontinuální náhrady funkce ledvin (CRRT)
- Citrát – mechanismus jeho antikoagulační a jeho aplikace v CRRT
- Potenciální metabolické poruchy v citrát-antikoagulancia, CRRT
- Biochemické monitorování pacientů léčených citrátem-antikoagulancia, CRRT
Akutní poškození ledvin
Akutní poškození ledvin (AKI), klinický syndrom s mnoha možných příčin, je jednoduše definován jako náhlé snížení funkce ledvin po dobu několika hodin nebo dnů, o čemž svědčí nedávné zvýšení koncentrace kreatininu v séru a/nebo snížení produkce moči .
je odlišný od chronického onemocnění ledvin (CKD), u kterého je pokles funkce ledvin pomalu, ale nevratně progresivní a vyskytuje se v období měsíců a let. AKI se samozřejmě může vyskytnout u pacientů se základním CKD a diagnóza AKI je spojena s větším než normálním rizikem případné diagnózy CKD .
Mezinárodně dohodnutými pokyny uvádějí, že diagnózu AKI mohou být provedeny, pokud:
• sérový kreatinin se zvyšuje o ≥ 0,3 mg/dL (26.5 µmol/L) během 48 hodin; nebo
• došlo k 50 % nebo větší zvýšení kreatininu v séru během posledních 7 dnů; nebo
• objem moči
AKI zahrnuje celé spektrum závažnosti, od mírné snížení funkce ledvin (stupeň 1 AKI) k selhání ledvin (stádium 3 AKI). Inscenace závisí na sérového kreatininu měření, s nebo bez moči výstup dat (Tabulka I)
|
Fáze |
Kreatininu v Séru |
Moči |
|
1 |
1.5-1.9 násobek výchozí hodnoty |
za 6-12 hodin |
|
2 |
2.0-2.9 násobek výchozí hodnoty |
⩾ 12 hodin |
|
3 |
3.0 násobek výchozí hodnoty |
pro ⩾ 24 hodin |
TABULKA I: tři stupně závažnosti AKI (z ref 1)
příčiny AKI jsou obvykle klasifikovány do tří kategorií: prerenální; ledvin (vnitřní); a postrenální, zdůrazňující skutečnost, že AKI může mít specifickou renální etiologii, ale může také vyplynout z primárního problému mimo ledviny.
podmínku, která má za následek snížení průtoku krve do ledvin (renální perfuze) je potenciální příčinou AKI prerenální; mezi tyto podmínky patří: hypovolémie v důsledku zvracení, průjmu, krvácení, popáleniny nebo septického šoku; a snížení srdečního výdeje v důsledku, například, srdeční selhání a selhání jater (cirhóza). Hlavní příčinou vnitřní AKI je renální tubulární nekróza, která je důsledkem renální ischémie nebo požití nefrotoxických léků / toxinů.
Sepse, nejčastější příčinu AKI u kriticky nemocných, je částečně kvůli špatně definované vnitřní poškození ledvin podobný renální tubulární nekróza . Konečně, postrenální AKI výsledky z jakéhokoliv stavu, který brání průtoku moči distální ledvin; tyto zahrnují: ledvinové kameny (konkrementy); onemocnění prostaty (nádor/hypertrofie); dysfunkce močového měchýře; a striktura uretry.
léčba Aki-renální substituční terapie pro AKI
neexistuje žádná specifická léčba AKI a léčba je do značné míry podpůrná s léčbou zaměřenou na základní příčinu. Stažení nefrotoxických léků, resuscitace tekutin a korekce elektrolytů a acidobazických poruch jsou součástí této obecné podpůrné léčby . Může být nezbytné podávání vazopresorových nebo inotropních léků k obnovení normálního krevního tlaku a srdečního výdeje.
náhrady funkce Ledvin (RRT), zaměření tohoto článku, představuje poslední možnost léčby pro pacienty s těžkou AKI, která nereaguje na konzervativní podpůrná léčba. Přibližně 23 % pacientů na JIP s AKI (tj.
renální substituční terapie (RRT) je obecný termín pro všechny léčby, které se snaží nahradit funkci ledvin. Transplantace od dárce ledvinu pacientů s konečným stádiem onemocnění ledvin může být považován za konečný RRT , ale termín je více často vyhrazena pro ty terapie, které nahradit filtrování krve a homeostatické funkce ledvin dialýzou, proces, který využívá polopropustné membrány jako krevní filtr. Pro léčbu AKI (a v konečném stádiu CKD) jsou k dispozici dva široké typy dialýzy RRT: peritoneální dialýza a hemodialýza.
naproti tomu hemodialýza zahrnuje filtrování krve ve stroji mimo tělo (mimotělní). Krev je čerpána do filtru / dialyzátoru, kde jsou odstraněny odpadní produkty a přebytečná tekutina a poté vrácena do těla. Tento mimotělní obvod (dialyzační přístroj a jeho spojovací trubice od a zpět k pacientovi) je prokoagulační prostředí.
Hemodialýzy, hemofiltrace a hemodiafiltrace
Moderní dialyzační přístroje mají možnost pro hemofiltraci (HF), stejně jako hemodialýza (HD), což umožňuje možnost tří různých dialytic postupy pro léčbu AKI: hemodialýza (HD); hemofiltrace (HF) a hemodiafiltrace (HDF).
jádrem všech tří modalit je polopropustná membrána, která tvoří krevní filtr. Jak krev čerpaná z pacienta proudí na jedné straně této membrány, přebytečná voda a odpadní rozpuštěné látky procházejí přes membránu. Filtrát nebo odpadní voda je čerpána do odpadu, jakmile je filtrovaná krev vrácena pacientovi.
proces hemodialýzy (HD) zahrnuje použití dialyzační tekutiny, která proudí nepřetržitě a countercurrently krve na druhé straně membrány. Složení a průtok dialyzační tekutiny zajišťuje konstantní koncentračního gradientu přes polopropustnou membránu s ohledem na krevní rozpuštěných látek. Tyto koncentrační gradienty zase usnadňují řízenou difúzi molekul rozpuštěné látky přes membránu.
Pro rozpuštěných látek jako močoviny a kreatininu, které musí být odstraněny z krve, koncentrační gradient je taková, že směr difuze z krve do dialyzační tekutiny, vzhledem k tomu, že pro rozpuštěných látek, jako je sodný, který musí být často přidány do krve opravit acidózy spojené s těžkou AKI, dialyzační tekutiny s vysokou koncentrací hydrogenuhličitanu relativní krve zajišťuje, že difúze je v opačném směru, z dialyzační tekutiny do krve. Úprava složení dialyzační tekutiny a průtoku umožňuje pacientovi specifickou metabolickou korekci.
nadbytek tekutiny je často znakem AKI, který je korigován během hemodialýzy. Toho je dosaženo ultrafiltrací, která závisí na gradientu hydrostatického tlaku, který existuje přes polopropustnou membránu. Relativní pozitivní hydrostatický tlak na krevní straně membrány účinně “tlačí” vodu z krve do dialyzační tekutiny.
ultrafiltrace také usnadňuje průchod molekuly rozpuštěné látky, které jsou taženy spolu s vodou během ultrafiltrace mechanismem s názvem rozpuštěné látky konvekcí (nebo solvent drag). Kombinovaný účinek difúze rozpuštěné látky, rozpuštěné látky konvekcí a ultrafiltrace během hemodialýzy cílem je zajistit, aby objem kapaliny a složení v extracelulární a intracelulární prostor je obnoven, tak blízko, jak je možné, že, která patří mezi ty s normálně fungující ledviny.
Hemodiafiltrace (HDF) je kombinací HF a HD. To umožňuje optimální clearance nízké molekulové hmotnosti rozpuštěných látek difúzí do dialyzační tekutiny, v kombinaci s optimální clearance o vysoké molekulové hmotnosti rozpuštěných látek konvekcí a ultrafiltrace. Stejně jako u HF vyžaduje HDF kontinuální náhradní tekutinu; a stejně jako u HD vyžaduje HDF dialyzační tekutinu.
zahájení a načasování RRT pro AKI – intermitentní versus kontinuální RRT
všechny renální substituční terapie (PD, HD, HF a HDF) mohou být podávány přerušovaně (tj. U pacientů s konečnou fázi selhání ledvin, kteří vyžadují celoživotní (chronická) RRT, léčba je výhradně intermitentní hemodialýza (IHD), téměř vždy dodávány ve čtyřech hodinových sezení, třikrát týdně .
pacienti s AKI mají pouze dočasný požadavek, aby RRT podporovala funkci ledvin během vymizení kritického / akutního onemocnění, které urychlilo AKI. Průměrná doba trvání RRT u pacientů s AKI je přibližně 13 dní, i když ve zvláštních případech může být nutná pouze několik dní nebo může trvat mnoho týdnů.
Tradiční (absolutní) ukazatele pro zahájení RRT u AKI patří:
• hyperkalémie (draslíku v plazmě > 6.0-6.5 mmol/L)
• těžké urémie (plazmatické močoviny > 30 mmol/L)
• známky uremické encefalopatie
• acidóza (pH • akutní plicní edém
To může být výhodné začít léčbu dříve, než tyto extrémní důsledky AKI jsou zřejmé, ale optimální načasování zahájení (a zastavení) RRT je v současné době nejasný a je předmětem probíhajícího výzkumu . V současné době neexistují spolehlivé údaje na podporu určitého typu RRT pro AKI, a proto byly použity všechny typy RRT.
současné pokyny však odrážejí konsensus, že bez ohledu na modalitu by měla být RRT dodávána nepřetržitě spíše než přerušovaně nejvíce kriticky nemocným (hemodynamicky nestabilním) pacientům. Nedávné průzkumy ukazují, že v současné době kontinuální renální substituční terapie (CRRTs) se používají mnohem častěji než intermitentní terapie pro AKI, a to nejčastěji používané CRRT je kontinuální venózní venózní hemofiltrace (CVVHF), následuje kontinuální venózní venózní hemodiafiltrace (CVVHDF).
Antikoagulace během kontinuální náhrady funkce ledvin (CRRT)
CRRT, v obyčejný s jinými renální substituční terapie kromě peritoneální dialýza, spočívá v čerpání krve prostřednictvím nonphysiological, mimotělní okruh. Inherentní vlastnost krve koagulovat (sraženina) při kontaktu s nefyziologickými povrchy určuje, že pro udržení mimotělního okruhu pacienta bez sraženiny musí být krev antikoagulována.
CRRT má zvláštní potřebu antikoagulace ve srovnání s přerušovaným způsoby, protože dlouhodobé sezení, a relativně pomalá rychlost, při které je krev čerpána přes obvod . Krev pacientů, kteří vyžadují CRRT, je navíc často již v relativním prokoagulačním stavu v důsledku základního kritického onemocnění (např.
Pro mnoho let heparin, buď nefrakcionovaný heparin (UF), nebo low-molecular-weight heparin (LMWH), byl pouze antikoagulační používá v dialytic postupy, včetně CRRT. Heparin se nadále používá; je to levný a obecně bezpečný prostředek antikoagulace pro většinu pacientů vyžadujících RRT.
Nicméně, systémové heparin antikoagulační, které se nelze vyhnout, nevyhnutelně s sebou nese zvýšené riziko krvácení, tak, že heparin, antikoagulace během dialytic postupů je absolutně kontraindikován pro ty, kteří jsou v současné době krvácení nebo na vyšší než normální riziko krvácení.
Navíc, heparinu, v malé menšině (
potenciální krvácení a HIT-II rizika spojená s heparinem použít zdůraznila potřebu alternativního antikoagulancia u některých pacientů vyžadujících RRT. Citrát poskytl takovou alternativu. Regionální citrátové antikoagulace dialyzačního okruhu, poprvé úspěšně použita v brzy 1980 , byl původně vyhrazen pro to, že malá menšina pacientů, u nichž heparinu je kontraindikováno. To se změnilo s výsledky z randomizované kontrolované studie porovnávající podávání heparinu-antikoagulační léčbu CRRT s citrát-antikoagulancia, CRRT; tyto prokázáno, že citrát je účinnější a bezpečnější antikoagulační než heparin .
citrát se v posledních letech objevil jako antikoagulant volby pro všechny pacienty s AKI vyžadující CRRT . Jednotky intenzivní péče po celém světě nyní hlásí přechod z heparinu na regionální citrátovou antikoagulaci pro CRRT . Některé úřady dokonce doporučují použití citrátu spíše než heparinové antikoagulace pro intermitentní (chronickou) hemodialýzu (IHD).
Citrát – mechanismus jeho antikoagulační a jeho aplikace v CRRT
Citrát, který se používá k anticoagulate/zachovat darovali krev pro transfuzi pro studnu přes století , brání srážení krve díky své schopnosti vázat (chelát) ionizovaného vápníku (iCa), která cirkuluje v krevní plazmě. Tento iCa je nezbytným kofaktorem pro obě agregace destiček a několik klíčových kroků ve vnitřní a vnější koagulační cesty, které jsou zodpovědné za fibrin výroby, a tím, fibrinové sraženiny.
srážení Krve brání snížení plazmatické koncentrace iCa kolem 0.35 mmol/L (normální ref rozmezí 1.15-1.30 mmol/L). Tento non-fyziologické, těžce hypocalcemic stavu je dosaženo zvýšením plazmatické koncentrace citrátu okolo 3 mmol/L (normální plazmatické koncentrace citrátu ~0.1 mmol/L ).
Ačkoli tam jsou rozdíly v detailu uvedené Morabito et al , všechny protokoly pro citrátové antikoagulace během CRRT zahrnovat kontinuální infuze citrátu-obsahující roztok (obvykle buď trinatrium-citrát nebo acid-citrát-dextróza (ACD) řešení) předfiltr/dialyzační linky, blízko místa, kde opustí pacienta, a to buď jako samostatné řešení nebo v kombinaci s predilution náhradní tekutiny. Průtok tohoto infuze je upravena tak, aby se dosáhlo krev citrát koncentrace ~3 mmol/L, a tím plazma iCa kolem 0.35 mmol/L.
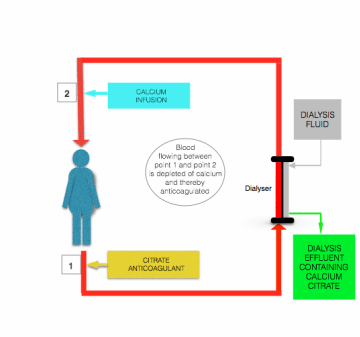
Na hypokalcémie vyvolané citrát infuze je opraven, než se krev vrátí pacientovi, tím, že infuze obsahující vápník roztoku (chlorid vápenatý nebo glukonát vápenatý) postfilter line blízko místa, kde vstupuje do pacienta (viz obrázek výše).
hlavní bezpečnostní výhodou citrátové antikoagulace oproti heparinové antikoagulaci je to, že antikoagulace je omezena na mimotělní okruh. Tento takzvaný “regionální antikoagulace” je dosaženo, protože většina infundovaného citrátu je odstraněn (jako citrát anionty nebo vápník-citrát, chelát) z krve při průchodu přes filtr/dialyzátoru .
všechny zbývající citrát v postfilter krev se ředí v systémové cirkulaci a je rychle metabolizován na oxid uhličitý a vodu o kyslík, je-li Krebsově cyklu do mitochondrií buněk tkáně (převážně jaterní buňky ).
metabolismus citrátu je spojen s produkcí hydrogenuhličitanu: pro každý metabolizovaný 1 mmol citrát se vytvoří 3 mmol bikarbonát. Rychlé odbavení citrát (poločas citrátu v krvi je obvykle kolem 5 minut ) pomocí této převážně jaterní trasy obvykle zajišťuje absenci systémové antikoagulace během CRRT, a tudíž žádné další riziko krvácení.
Potenciální metabolické poruchy v citrát-antikoagulancia, CRRT
zdánlivá neochota plně přijmout citrát-antikoagulancia, CRRT pro všechny AKI u pacientů až v poslední době byl připisován obavám, pokud jde o acidobazické a elektrolytové poruchy, které se mohou vyskytnout u pacientů, kteří dostávali léčbu .
následující elektrolytové a acidobazické poruchy byly hlášeny u pacientů léčených citrátem-antikoagulancia, CRRT :
• hypokalcémie/hyperkalcémie
• hypomagnesia/hypermagnesia
• hyponatrémie/hypernatrémie
• metabolická alkalóza
• metabolická acidóza
Tyto poruchy mohou nastat z mnoha důvodů, ale hromadění citrátu v periferní cirkulaci (citrát toxicita) může být centrální pro většinu z těchto poruch. Důvodů, proč citrát může hromadit v průběhu CRRT patří:
• Poruchou metabolismu citrátu v důsledku onemocnění jater a/nebo snížené dodávky kyslíku kvůli nedostatečné perfuze (např. v septik/kardiogenní šok)
• Progresivní snížení průchodnosti membrány během dialýzy s následnou sníženou filtraci citrát a současně zvýšení citrát dodání do systémového oběhu
• v případě Provozní chyby – náhodné zvýšení rychlosti infuze citrátu do mimotělního obvodu a současné zvýšené dodávce citrátu do systémového oběhu
• Krev produktu transfuzí citrátovým konzervačním prostředkem přítomen v krvi, výrobky dodává do citrátu zatížení v systémovém oběhu vyplývající z CRRT
bez Ohledu na příčinu, akumulace citrátu v periferní cirkulaci může vést k citrátové chelaci cirkulujícího ionizovaného vápníku s následnou sníženou koncentrací ionizovaného vápníku v plazmě (hypokalcémie). Pokud dostatečně závažná hypokalcémie může způsobit srdeční arytmii a nakonec srdeční zástavu .
i když je plazmatický ionizovaný vápník během akumulace citrátu snížen (toxicita), celkový vápník je zvýšen (indikující hyperkalcémii), protože vápník vázaný na citrát je zahrnut do měřeného celkového vápníku. Zvýšení poměru celkového k ionizovanému vápníku (obvykle 2,0) na > 2.Bylo zjištěno, že 1 je nejspolehlivějším signálem toxicity citrátu při absenci rutinně dostupného odhadu citrátu v plazmě .
riziko zvýšených plazmatických sodíku (hypernatrémie) spojené s citrátové antikoagulace je vzhledem k vysokému obsahu sodíku (hypertonicita) některé citrát řešení používaných v CRRT. Například, 4 % roztok trinatrium-citrát, který se používá v některých protokolů obsahuje sodík v koncentraci 420 mmol/L. V praxi, použití hypotonická dialýzu/náhrada tekutin může zmírnění tohoto rizika a hypernatrémie je podle všeho vzácná komplikace citrátové antikoagulace .
riziko hypomagnesia (snížená hladina sérového hořčíku), během citrátové antikoagulace odráží skutečnost, že v obyčejný s vápník, hořčík je dvojmocný iont, který může také vázat (chelátové) formě citrátu. Pokud hořčík ztráty v důsledku chelatační působení citrátu nejsou plně kompenzovány hořčíku v dialyzačních/výměna tekutin, hypomagnesia může dojít .
Biochemické monitorování pacientů léčených citrátem-antikoagulancia, CRRT
Point-of-care testování pomocí krevních plynů analyzátor umístěna v jednotce intenzivní péče umožňuje rychlé a pohodlné měření většiny parametrů (ionizovaný vápník, pH, bikarbonáty, base excess, chlorid a laktát), ale celkového sérového vápníku a hořčíku odhadu nejsou obvykle k dispozici na těchto platformách a vzorky musí být odeslány do laboratoře pro tato měření.
Dvě nedávné studie poskytují důkazy, že některé krevních plynů analyzátory nemusí být spolehlivé při měření ionizovaného vápníku v extrémně nízké, non-fyziologických koncentracích (~0.3 mmol/L), přítomných v postfilter krev, i když jejich schopnost přesně změřit plazmatu ionizovaného vápníku v systémové cirkulaci (kde je koncentrace mnohem vyšší) není pochyb.
|
měřený parametr |
interval sledování |
cílové hodnoty nebo cca. referenční rozsahy |
Účelem měření |
Nápravná opatření, pokud mimo cíl |
|
Postfilter ionizovaného vápníku (iCa) koncentraci, tj. krevního vzorku z postfilter přístavu. |
do 1 hodiny od zahájení a po jakékoli změně dávky citrátu, pak každých 4-6 hodin |
0.25-0.35 mmol/L |
|
Úprava citrát dávkování: zvýšit, pokud iCa > 0.35, snížit, pokud iCa |
|
Systémového ionizovaného kalcia (iCa), tj. vzorku krve od pacienta |
Základní (před zahájením), pak 1 hodinu po spuštění, pak alespoň každých 4-6 hodin |
1.15-1.30 mmol/L |
|
Úprava vápníku rychlost infuze; zvýšit, pokud iCa 1.30 |
|
Systémové celkového vápníku (TotCa), tj. krevní vzorky od pacienta (TotCa = iCa + vápník vázán na albumin + vápník vázán na citrát) |
alespoň každých 12 až 24 hodin (musí být současné systémové ionizovaný vápník odhad) |
nutné Pouze pro stanovení totCa:iCa poměr (viz níže) |
||
|
Poměr celkové ionizovaný vápník (TotCa:iCa) |
nejméně každých 12-24 hodin |
Pro detekci hromadění citrátu/toxicita někdy nazývá “citrát zámek” |
Možnosti zahrnují:
|
|
|
Arteriální analýzu krevních plynů
|
Základní (před zahájením) . do 1 hodiny od zahájení, poté nejméně každých 4-6 hodin. |
pH 7.35-7.45 bicarb 23-28 mmol/L –2-+3 mmol/L |
K detekci poruch acidobazické rovnováhy: metabolická alkalóza metabolická acidóza |
Možnosti v případě metabolické alkalózy patří:
|
|
hladina sodíku v Séru |
Jednou denně |
135-145 mmol/L |
K detekci hypernatrémie/hyponatrémie |
Vzácný výskyt – ověření správné dialýzu/výměna kapaliny |
|
laktátu v Séru |
Základní (před zahájením), pak podle klinických potřeb |
pomoci identifikovat ty, kteří jsou na riziko toxicity citrátu |
Zvažte, spolu s TotCa:iCa poměr, riziko toxicity citrátu |
|
|
Sérum hořčíku |
alespoň jednou denně |
K detekci hypomagnesia |
Korekce infuze s hořčíkem |
TABULKA II: Biochemické monitorování v průběhu citrát-antikoagulancia, CRRT (Ref 24)