Hranic, v Medicíně
- Úvod
- Pacienti a Metody
- Výběr Pacientů v Surveillance, Epidemiology, and End Results Databáze
- Statistické Analýzy
- Výsledky
- Pacient Vlastnosti
- Lepší Riziko T1 Fázi ve Srovnání S Jinými T Fázích v Rámci Séru CEA Elevace
- Efekt Předoperační Sérový CEA Elevace v T Fázi
- diskuse
- Prohlášení o dostupnosti dat
- Etika Prohlášení
- Autor Příspěvků
- střet zájmů
- poděkování
Úvod
rakovina Konečníku je jednou z nejčastějších malignit po celém světě (1). Podle amerického společného výboru pro rakovinu (AJCC) staging system je anatomický rozsah primárního nádoru (t fáze) jedním z nejdůležitějších prognostických prediktorů. Pacienti se stejným stádiem T rakoviny konečníku však mohou vykazovat výrazně odlišné klinické výsledky.
Poprvé zaznamenána v roce 1965, karcinoembryonální antigen (CEA) je 180-200 kDa glykoprotein a člen imunoglobulin nadčeleď (2). CEA je vylučována řadou solidních nádorů, včetně 90% kolorektálních karcinomů (3). Jako jediný nejdůležitější a nejspolehlivější sérový prognostický biomarker u kolorektálního karcinomu se zjistilo, že zvýšené předoperační hladiny CEA jsou spojeny s horší prognózou kolorektálního karcinomu (4-9).
předchozí studie prokázaly, že CEA byla spojena s adhezí rakovinných buněk a vrozenou imunitou u kolorektálního karcinomu. Kromě toho, CEA byla také hlášena k usnadnění připevnění kolorektálního karcinomu buněk do míst metastáz a podporovat progresi nádoru (10-12).
Tradičně, vzdálené šíření nádorových buněk byla považována za pozdní události, ale výsledky několika předchozích studií vyplynulo, že získání metastatického potenciálu by mohlo dojít ve velmi rané fázi progrese nádoru (13-16). Wo et al. (17) uvádí, že velmi malá velikost nádoru zapojená do pozitivity lymfatických uzlin může být náhradou za agresivní biologii. Pak máme podezření, že rakovina konečníku ve velmi raném stádiu s elevací CEA v séru by mohla naznačovat včasné získání metastatického potenciálu a předpovědět Velmi špatné přežití rakoviny konečníku.
Nicméně, pokud je nám známo, několik studií byly hlášeny vyšetřovat asociace T fázi a sérové hladiny CEA (C0 a C1) ve stanovení prognózy rakoviny konečníku. Proto jsme jednání této velké populační studie, která zkoumala, zda velmi brzy, T fázi v rámci séru CEA elevace může být náhradní matkou pro biologicky agresivní onemocnění a předpovědět pro chudé, protože-specific survival (CSS) rakoviny konečníku. Abychom odstranili účinek pozitivity lymfatických uzlin na náš výzkum, vyloučili jsme pacienty pozitivní na uzliny a zaměřili analýzu na pacienty ve stadiu I–II.
Pacienti a Metody
Výběr Pacientů v Surveillance, Epidemiology, and End Results Databáze
Jako autoritativní zdroj informací o incidenci a přežití v USA a komplexní zdroj obyvatelstva-na základě informací, včetně všech nově diagnostikovaných případů rakoviny vyskytující se v Surveillance, Epidemiology, and End Results (SEER)-účast oblastech, SEER databáze zahrnuje ~28% Americké populace. Databáze SEER neobsahovala žádné identifikátory a byla veřejně dostupná pro výzkumné pracovníky. SEER * Stat je software poskytovaný programem SEER k získání informací o pacientech pomocí online přístupu. Na první případ-výpis zasedání SEER*Stat software (SEER*Stat 8.3.5) byl použit na seznam všechny trpěliví-související informace, a pacienti diagnostikován s etapa I–II (node-negativní) rektální rakoviny mezi 1. lednem 2004 a 31. prosince 2015 byly zjištěny z databáze SEER (Obrázek 1). Pacienti s karcinomem konečníku byli identifikováni podle kódů místa ICD-O-3 c199 a C209 a kódu chování 3 (položky naaccr 522 a 523) (9). Rozhodli jsme se zahrnout tyto roky, protože informace o předoperačním séru CEA byly zaznamenány od roku 2004 a sledování SEER skončilo v roce 2015.

Obrázek 1. Vývojový diagram definic kohorty pacientů.
poté byli z naší studie vyloučeni ti, kteří dostávali neoadjuvantní radioterapii, nedostatek pozitivního histologického potvrzení, s neznámou rasou, histologií bez adenokarcinomu nebo neaktivní sledování. Pacienti s dostupnou předoperační hladinou CEA v séru byli zahrnuti do naší studie a seskupili jsme “pozitivní / zvýšené” a ” negativní / normální; v normálních mezích ” jako C1 a C0 (informace o stupni C). Mezní hodnoty CEA byly 2, 5 ng / ml pro nekuřáky a 5 ng/ml pro kuřáky. Kromě toho, tyto pacienta clinicopathological proměnných byla také načtena z databáze SEER: T stadium, rasy, pohlaví, umístění nádoru, věk, diagnózu, rok diagnózu, stupeň a histologie.
Statistické Analýzy
V této studii, Pearsonův chi-kvadrát test byl použit k porovnání všech pacientů clinicopathological proměnné načtena z databáze SEER mezi normální a zvýšené předoperační sérové hladiny CEA. Některé multivariabilní modely proporcionálního rizika Cox byly vytvořeny k identifikaci nezávislých prognostických proměnných rakoviny konečníku v našich analýzách. Křivky přežití byly generovány pomocí Kaplan-Meierovy metody a rozdíly mezi křivkami byly analyzovány log-rank testem. Primární výsledky zájmu v této studii byly CSS a celkové přežití (OS). CSS byl vypočítán od data diagnózy do data úmrtí specifického pro rakovinu. Úmrtí připisovaná rakovině konečníku byla považována za události a úmrtí z jiných příčin byla považována za cenzurovaná pozorování k datu úmrtí. Určit, zda existuje významná interakce mezi předoperační sérový CEA úroveň a T fázi v predikci CSS, také jsme definovali, interakce proměnných (T fázi a sérového CEA úrovni). Oboustranný P < 0,05 byl považován za statisticky významný. Statistické analýzy byly prováděny hlavně pomocí SPSS verze 22 (IBM Corporation, Armonk, NY, USA).
Výsledky
Pacient Vlastnosti
Celkově 19,184 pacientů diagnostikován s etapa I–II rektální rakoviny u pacientů byly zjištěny z databáze SEER mezi 1. lednem 2004 a 31. prosince 2015 (Obrázek 1). Z těchto pacientů, 13,007 (67.8%) pacientů byly přiřazeny k C0 fázi, a 6,177 (32.2%) pacientů bylo přiděleno do C1 fázi. AJCC staging systém navrhl, že 6,077 pacienti byli v T1 fázi, 4,783 pacientů v T2 fázi, 7,021 v T3 fázi, a 1,303 byly v T4 fázi. Celkem 2 560 (13,3%) pacientů zemřelo na rakovinu konečníku na konci doby sledování. Medián doby sledování celé kohorty byl 44 měsíců (0-143 měsíců). Výchozí charakteristiky pacientů jsou shrnuty v tabulce 1.
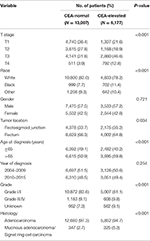
Tabulka 1. Srovnání výchozích charakteristik karcinomu konečníku ve stadiu I-II podle hladiny sérového karcinoembryonálního antigenu (CEA).
Lepší Riziko T1 Fázi ve Srovnání S Jinými T Fázích v Rámci Séru CEA Elevace
bylo zjištěno, že C1 fázi bylo více pravděpodobné, že korelují s vyšší T fázi, černá, rectosigmoid junction, vyšší věk, vyšší stupeň, a mucinózní adenokarcinom/Pečetní prsten karcinomu (Tabulka 1, P < 0.05). Jak je uvedeno v tabulce 2, rasa, pohlaví, umístění nádoru, věk při diagnóze, rok diagnózy, stupeň, histologie, stupeň T a hladina CEA v séru byly zahrnuty do multivariační analýzy Cox. Při multivariační Coxova analýza byla provedena, přesvědčili jsme následující clinicopathological vlastnosti jako nezávislé prognostické faktory ve fázi I–II karcinomu konečníku; jednalo se rasy, pohlaví, umístění nádoru, věku v době stanovení diagnózy, grade nádoru, T fázi, a séru CEA úrovni, zatímco rizika mezi T2,C0 a C1,C0 nebyl statistický rozdíl (P = 0.925). Bylo prokázáno, že v souvislosti séru CEA elevace, T1 fázi prezentovány nečekané vyšší riziko rektální rakoviny specifická úmrtnost ve srovnání s fází T2 a T3. Ve stadiu T1 onemocnění byla zvýšená hladina CEA v séru spojena s 227,6% zvýšeným rizikem mortality ve srovnání s normální hladinou CEA v séru.

Tabulka 2. Vícerozměrné coxovy regresní analýzy přežití specifického pro příčinu (CSS) ve stadiu I–II rektální rakovina.
Kaplan-Meierovy křivky přežití jsou vyneseny na obrázcích 2, 3. 5-leté CSS sazba byla 92.2% v T1C0, 75.2% v T1C1, 93.1% v T2C0, 86.7% v T2C1, 84.6% v T3C0, 76.3% v T3C1, na 62,9% v T4C0, a 43,6% v T4C1 (Obrázek 2, P < 0.001). Proto, T1C1 představil podobné 5-rok CSS rychlost ve srovnání s T3C1 (75.2 vs. 76.3%, P = 0.238). Kromě toho byl nález ještě výraznější v OS. 5-leté OS sazba byla 78,6% v T1C0, 48,3% v T1C1, 77.1% v T2C0, 62,3% v T2C1, 68,5% v T3C0, 54,5% v T3C1, 45.3% v T4C0, a 30.0% v T4C1 (Obrázek 3, P < 0.001). T1C1 prezentovány výrazně nižší 5-rok CSS rychlost ve srovnání s T3C1 (48.3 vs. 54.5%, P < 0.001).
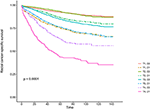
Obrázek 2. Kaplan-Meierovy křivky přežití specifické pro příčinu (CSS) ve stadiu T v kombinaci s hladinou sérového karcinoembryonálního antigenu (cea).
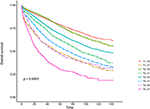
obrázek 3. Kaplan-Meierovy křivky celkového přežití (OS) ve stadiu T v kombinaci s hladinou sérového karcinoembryonálního antigenu (cea).
Efekt Předoperační Sérový CEA Elevace v T Fázi
lesní pozemek byl vypracován ukázat poměry rizik (Hod) porovnat CSS mezi normální a zvýšené-CEA skupiny v příslušných T fázích (Obrázek 4). Ve srovnání s normální hladina sérového CEA, ve fázi T2, zvýšené hladiny sérového CEA byla spojena s 69.0% zvýšené riziko rektální-rakovina-specifické úmrtnosti ; ve fázi T3, zvýšené hladiny sérového CEA byla spojena s 67.2% zvýšené riziko rektální-rakovina-specifické mortality (HR = 1.672, 95% CI = 1.486–VÝŠI 1,882, P < 0.001); ve stadiu T4, zvýšená hladina sérového CEA byla spojena s 81.3% zvýšené riziko rektální-rakovina-specifické mortality (HR = 1.813, 95% CI = 1.485–2.213, P < 0.001); naproti tomu však v etapě T1, zvýšené hladiny sérového CEA představila dokonce až 211.6% zvýšené riziko mortality specifické pro rektální karcinom (HR = 3,116, 95% CI = 2,639-3,679, P < 0,001).
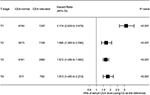
obrázek 4. Poměr rizik (HRs) přežití specifického pro příčinu (CSS) mezi normální a zvýšenou hladinou sérového karcinoembryonálního antigenu (CEA) podle stupně T.
diskuse
zaměřili jsme se na zkoumání asociace hladin t a CEA v séru při určování CSS rakoviny konečníku. Domnívali jsme se, že rakovina konečníku se velmi brzy, T stádium (stadium T1) a sérového CEA elevace může být biologický náhradní pro agresivní onemocnění, a tak předpovídat špatné onkologické výsledky. Do naší studie bylo zahrnuto ~20 000 pacientů s diagnózou rakoviny konečníku ve stadiu I–II.
V této studii, bylo zjištěno, že hladiny sérového CEA elevace bylo více pravděpodobné, že korelují s vyšší T fázi, černá, rectosigmoid junction, vyšší věk a vyšší platové třídě a mucinózní adenokarcinom/Pečetní prsten karcinomu. Kaplan–Meier survival analýzy ukázaly, že v souvislosti séru CEA elevace, 5-leté CSS rychlost fázi T1 75,2%, což nedosáhlo statistické rozdíl od fáze T3 (76.3%). Pokud jde o celkové přežití, 5-leté OS míra fázi T1 s předoperační sérový CEA elevace (48.3%) byla dokonce nižší než fáze T3 podílí CEA elevace (54.5%) a nedosáhl statistické rozdíl od fáze T4 (45.3%), což znamená zvýšené předoperační sérové hladiny CEA by mohla identifikovat podskupinu fázi T1 rektální rakoviny s podobnými CSS ve srovnání s některými fázi T3 onemocnění a s podobnými OS ve srovnání s některými fázi T4 onemocnění.
Po úpravě pro známo, rakovina konečníku prognostické faktory (rasa, pohlaví, umístění nádoru, věk, diagnózu, rok diagnózu, stupeň a histologie), interakce proměnných (T fázi a sérového CEA úrovni) jsme definovali bylo prokázáno, že být nezávislý prognostický faktor rakoviny konečníku. Multivariační Coxova analýza ukázala, že v souvislosti séru CEA elevace, T1 fázi prezentovány nečekané vyšší riziko rektální rakoviny specifická úmrtnost ve srovnání s fází T2 a T3. Ve stadiu T1 onemocnění byla zvýšená hladina CEA v séru spojena s 227,6% zvýšeným rizikem mortality ve srovnání s normální hladinou CEA v séru. Kromě toho byla rasa, pohlaví, umístění nádoru, věk při diagnóze a stupeň nádoru také identifikovány jako nezávislé prognostické faktory rakoviny konečníku I.–II. Na rozdíl od T1, bylo zjištěno, že předoperační sérový CEA elevace prezentovány ~75% vyšší riziko rektální-rakovina-specifické úmrtnosti v jednotlivých T fázi, přesto počet výrazně zvýšil na 211.6% v T1 fázi.
V roce 2000, Kolorektální Pracovní Skupina AJCC navrhované zařazení hladina CEA (C fáze) do konvenční AJCC TNM staging systém kolorektálního karcinomu (18). Americká společnost klinické onkologie a Evropská skupina pro nádorové markery navíc podpořily zahrnutí předoperační hladiny CEA v séru jako prognostického nástroje u kolorektálního karcinomu (19-21).
několik předchozích výzkumů uvádělo hladinu CEA v séru jako silnou prognostickou roli u rakoviny tlustého střeva (4-7, 22-26). V roce 2011 Thirunavukarasu et al. (25) uvádí, že předoperační sérový CEA úrovni byl nezávislý prognostický biomarker rakoviny tlustého střeva a prognóza byla horší ve vysoké CEA u pacientů s nižší úrovni ve srovnání s nízkými CEA u pacientů s vyšším stupni. V této studii, vysoká CEA byla dokonce považována za stejně silnou jako pozitivita uzlin pro předpovídání špatných onkologických výsledků rakoviny tlustého střeva.
přesto se několik studií zaměřuje na objasnění prognostické úlohy hladiny CEA v séru u rakoviny konečníku. V roce 2016 také pomocí databáze SEER, Tarantino et al. (9, 27) provedli dva velké populační šetření, které poskytly přesvědčivé důkazy, že zvýšená úroveň předoperační sérový CEA byla silným prediktorem horší celkové a karcinom-specifické přežití u karcinomu konečníku. V roce 2018 Liu et al. (8) prokázala, že předoperační sérový CEA byl nezávislý prognostický faktor rakoviny konečníku, a zvýšené sérové koncentrace CEA úrovni prezentovány evidentně chudší přežití ve srovnání s normálním séru CEA úrovni ve fázích I–IV. Nicméně, pouze dvě předchozí studie zaměřené na zkoumání prognostických roli předoperační sérový CEA úrovni nezkoumal asociace CEA úroveň a T fázi v predikci nádorové výsledky rakoviny konečníku.
i když konvenční ukazuje, že rakovina získává metastatický potenciál krok za krokem, jak rostou do velké velikosti (28), nicméně, některé předchozí studie naznačily, že získání metastatického potenciálu by mohlo dojít velmi brzy v progresi nádoru. Předchozí výzkum prokázal extrémně špatné přežití velmi malé velikosti nádoru, pokud se podílí na pozitivitě lymfatických uzlin (17). Kromě toho, že výsledky našeho výzkumu ukazují, že nadmořská výška předoperační sérový CEA úrovni ve velmi raném stadiu (stadium T1) rakovina konečníku je spojena s velmi špatnou OS a CSS a může být náhradní agresivní biologie. Věříme, že jak postižení lymfatických uzlin, tak zvýšení CEA v séru jsou považovány za získání metastatické schopnosti. Naše studie, v kombinaci s tím Wo et al. důsledně podporovat výše zmíněnou myšlenku, že získání metastatického potenciálu by mohlo dojít velmi brzy v progresi nádoru, a tím spojena se špatnou onkologické výsledky, a původní biologické funkce jsou více pravděpodobné, že k určení potenciálu vzdálené metastázy při progresi rakoviny, spíše než nahromaděné metastatické schopnosti (29).
navíc nálezy naší studie mají klinický význam. V současné době je rakovina konečníku i. stupně léčena samotnou radikální chirurgickou resekcí kvůli relativně příznivým onkologickým výsledkům. Přibližně u 10-15% pacientů se však po radikální resekci vyvine recidiva nádoru (30, 31). V této studii, jsme se identifikovat podskupinu fázi T1 rakovinu konečníku s velmi špatnou prognózu ve srovnání s ostatními fázi I, rektální rakoviny, což znamená, že tyto fáze T1 rakovina konečníku se zapojením předoperační sérový CEA elevace by měla zachytit více pozornosti onkologů.
v naší studii však existují dvě omezení. Na jedné straně, tato studie nezahrnovala některé známé prognostické faktory rakoviny konečníku v našich analýz, včetně nestability mikrosatelitů stav a pooperační komplikace, které byly k dispozici ze SEER databáze a může zavést předsudky do určité míry. Nemůžeme poskytnout rozsahy a střední hodnoty CEA v obou skupinách. Na druhé straně byla tato studie spíše retrospektivní než založená na prospektivních údajích. Proto musí být naše nálezy stále validovány v jiných kohortách, zejména ve velkých prospektivních klinických studiích.
Na závěr naše studie ukazuje, že fáze T1 rektální rakoviny, když se podílí na předoperační sérový CEA elevace, může být náhradní biologicky agresivní nemoci a koreluje s nepříznivou OS a CSS. Navíc tato podskupina rakoviny konečníku si zaslouží větší klinickou pozornost onkologů. Naše zjištění, pokud by byla validována v budoucích databázových studiích, by poskytla nový nápad na terapii rakoviny konečníku v rané fázi.
Prohlášení o dostupnosti dat
datové sady vytvořené pro tuto studii jsou k dispozici na vyžádání příslušnému autorovi.
Etika Prohlášení
Pacienti v této studii byly zjištěny z databáze SEER, a schválení pro použití data byla získána prostřednictvím žádosti podané VĚŠTEC program. Schválení institucionální revizní komisí nebylo nutné, protože databáze SEER je veřejně dostupná.
Autor Příspěvků
SW a WG udělali podstatný a přímý příspěvek k této studii, a to schválil k předložení.
střet zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být vykládány jako potenciální střet zájmů.
poděkování
tato práce byla částečně podpořena projektem plánu rozvoje lékařské vědy a techniky Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal a. globální statistika rakoviny 2018: GLOBOCAN odhady výskytu a úmrtnosti na celém světě u 36 rakovin ve 185 zemích. CA rakovina J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
2. Gold P, Freedman SO. Demonstrace nádorově specifických antigenů v lidských karcinomech tlustého střeva imunologickou tolerancí a absorpčními technikami. J Exp Med. (1965) 121:439–62. doi: 10.1084/jem.121.3.439
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
3. Goldstein MJ, Mitchell EP. Karcinoembryonální antigen při stagingu a sledování pacientů s kolorektálním karcinomem. Rakovina Invest. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, González MG, Hensley BJ, et al. Hodnocení prognostické úlohy zvýšených hladin předoperačního karcinoembryonálního antigenu u pacientů s rakovinou tlustého střeva: výsledky z národní databáze rakoviny. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245/s10434-015-5014-1
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, et al. Zvýšená předoperační hladina karcinoembrionického antigenu v séru může být účinným indikátorem pro potřebu adjuvantní chemoterapie po potenciálně léčebné resekci karcinomu tlustého střeva ve stadiu II. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Identifikace pacientů s vysoce rizikovým karcinomem tlustého střeva ve stadiu II pro adjuvantní terapii. Dis Tlustého Střeva Konečníku. (2008) 51:503–7. doi: 10.1007/s10350-008-9246-z
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. Začlenění CEA zlepšuje stratifikaci rizika u karcinomu tlustého střeva ve stadiu II. Jaromír Jágr (2017) 21: 770-7. doi: 10.1007/s11605-017-3391-4
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
8. Liou Q, Lian P, Luo D, Cai S, Li Q, Li X. Kombinace karcinoembryonálního antigenu s americkým smíšeným výborem pro rakovinu TNM staging system u rakoviny konečníku: studie založená na reálném světě a velké populaci. Onco Se Zaměřuje Na Ther. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, Güller U, Mieth M, Cerny T, et al. Prediktivní hodnota CEA pro přežití ve stadiu I rakoviny konečníku: populační analýza skensity score. J Gastrointest Surg. (2016) 20: 1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Onkogen. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
12. Cai Z, Xiao J, He X, Ke J, Zou Y, Chen Y, et al. Přístup k novým prognostický význam předoperační karcinoembryonální antigen v kolorektálním karcinomem léčených resekce nádoru: více než pozitivní a negativní. Biomark Rakoviny. (2017) 19:161–8. doi: 10.3233/CBM-160287
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, Fürstenberger G, Richter R, et al. Proces metastázování rakoviny prsu. Eur J Rakovina. (2003) 39:1794–806. doi: 10.1016/S0959-8049(03)00422-2
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. Systémové šíření je časným krokem u rakoviny prsu. Rakovinová Buňka. (2008) 13:58–68. doi: 10.1016 / j. ccr.2007.12.003
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus h. Očkování a šíření netransformovaných myších mléčných buněk v plicích. Věda. (2008) 321:1841–4. doi: 10.1126 / věda.1161621
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. Od latentních diseminovaných buněk po zjevné metastázy: genetická analýza systémové progrese rakoviny prsu. Proc Natl Acad Sci USA. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Vliv velmi malé velikosti nádoru na úmrtnost specifickou pro rakovinu u karcinomu prsu pozitivního na uzliny. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j. breastdis.2012.01.026
CrossRef Plný Text | Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. Konsensuální konference amerického smíšeného výboru pro prognostické faktory rakoviny: kolorektální pracovní skupina. Rakovina. (2015) 88:1739–57. doi: 10.1002/(SICI)1097-0142(20000401)88:7<1739::PODPORA-CNCR30>3.0.CO;2-T
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Markery nádorů u kolorektálního karcinomu: pokyny Evropské skupiny pro nádorové markery (EGTM) pro klinické použití. Eur J Rakovina. (2007) 43:1348–60. doi: 10.1016 / j. ejca.2007.03.021
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 aktualizace doporučení pro použití nádorových markerů v gastrointestinálním karcinomu. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, et al. Nádorové markery u kolorektálního karcinomu, rakoviny žaludku a gastrointestinálních stromálních karcinomů: Evropská skupina pro nádorové markery 2014 aktualizace pokynů. Int J Rakovina. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. Předoperační karcinoembryonální antigen předpovídá výsledky u pacientů s rakovinou tlustého střeva s negativními uzlinami: multivariační analýza 572 pacientů. J Am Sb. (1997) 185: 55-9. doi: 10.1016/S1072-7515(97)00012-4
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Předoperační hladina karcinoembryonálního antigenu jako nezávislý prognostický faktor u potenciálně léčebného karcinomu tlustého střeva. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata A, Nakagawa Y, Fujita S, et al. Začlenění hladin karcinoembryonálního antigenu v séru do prognostického seskupovacího systému rakoviny tlustého střeva. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007/s00384-017-2772-1
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. C-fáze rakoviny tlustého střeva: důsledky biomarkerů karcinoembryonálního antigenu při stagingu, prognóze a řízení. J Natl Cancer Inst. (2011) 103:689–97. doi: 10.1093/jnci/djr078
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. Posouzení prognostické hodnoty hladin karcinoembryonálního antigenu ve stadiu I a II rakoviny tlustého střeva. Eur J Rakovina. (2018) 94:1–5. doi: 10.1016 / j. ejca.2018.01.112
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, Köberle D, Schmied BM, et al. Zvýšená předoperační CEA je spojena s horším přežitím u pacientů s karcinomem konečníku ve stadiu I-III. Br J Rakovina. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
28. Norton L, Massague J. je rakovina onemocnění samočinného setí? Nat Med. (2006) 12:875–8. doi: 10.1038 / nm0806-875
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
29. Yu KD, Jiang YZ, Chen S, Cao ZG, Wu J, Shen ZZ, et al. Vliv velké velikosti nádoru na úmrtnost specifickou pro rakovinu u karcinomu prsu negativního uzlu. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j. mayocp.2012.07.023
PubMed Abstrakt / CrossRef Plný Text / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Fáze i rakovina konečníku: identifikace vysoce rizikových pacientů. J Am Sb. (1998) 186: 574-9; diváci: 579-80. doi: 10.1016/S1072-7515(98)00018-0
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O ‘ Connell MJ, Begovic M, et al. Dopad fáze T A N A léčby na přežití a relaps u adjuvantního karcinomu konečníku: souhrnná analýza. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Abstrakt / CrossRef Plný Text / Google Scholar