Kyseliny, zásady, pH
|
|||||||||
KYSELIN A JEJICH KONJUGOVANÝCH BÁZÍ,
Bronsted–Lowryho definice kyseliny: kyselina dárce protonu. Je zřejmé, že v našem předchozím příkladu kyselina octová daruje svůj proton na H2O v dopředné reakci, což vede k tvorbě acetátového iontu. Při reverzní reakci však acetátový ion přijímá proton z H3O+, aby se vrátil na CH3COOH. Z definice Bronsted–Lowry je báze akceptorem protonů.
|
to Znamená, že acetát ion chová jako báze v reverzní reakce, a je nazývá se konjugovaná báze kyseliny octové. Kyselina octová a acetátový iont jsou známé jako pár acidobazických konjugátů. Zajímavé je, že ve výše uvedené reakci existuje druhý pár acidobazických konjugátů. Všimněte si, jak v reverzní reakci H3O + daruje proton (což z něj činí kyselinu), zatímco v dopředné reakci H2O přijímá proton (což z něj činí základnu). H2O a H3O+ jsou pár konjugovaných kyselin a bází, přičemž H3O+ je konjugovaná kyselina a H2O je konjugovaná báze.
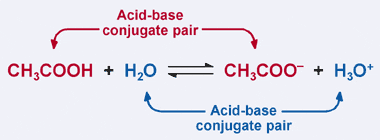
v páru konjugované kyseliny a báze má konjugovaná kyselina ještě jeden proton než její odpovídající konjugovaná báze.