Příbuzný antigenu zapojení na parenchymálních buňkách stimuluje CD8+ T buněčné proliferace in situ
- Příbuzný CD8+ T buňky se nacházejí v LN a zanícené tkáně
- CD8+ T buňky expandovat v místě zánětu
- Příbuzný interakce s ostrůvky podporuje rozšíření
- Příbuzný interakce s bydlištěm leukocytů není nutné
- příbuzná interakce s parenchymálními buňkami je důležitá
- T buňky proliferují v místě zánětu
- Příbuzný interakce s parenchymálních buněk disky šíření
- IL-2 je více důležité v místě zánětu
Příbuzný CD8+ T buňky se nacházejí v LN a zanícené tkáně
V počáteční experimenty (Obr. 1) vytvořili jsme model, ve kterém by bylo možné analyzovat odpovědi CD8 T-buněk na parenchymální antigen, ovalbumin (OVA). Myši OT-I exprimují transgenní TCR, který zprostředkovává rozpoznávání CD8+ T-buněk peptidu OVA257-264 prezentovaného na molekule MHC třídy I h-2Kb. CD8 T buňky byly obohaceny z myší OT-I / CD45. 1, barvivem značených CFSE a adoptivně přeneseny i. v.do hostitelských myší B6 (CD45.2+). Adoptively převedeny T-buňky by mohly být odlišeny od hostitelských buněk průkazu cd45.1 barvení (stejně jako CD8 a Va2 řetězce OT-jsem TCR), zatímco CFSE-barvivo ředění byl použit k identifikaci buňky, které se množily (například Obr. 1a, Doplňkový obr. 1). Parenchymální antigen byl zaveden roubováním B6.ßOVA ostrůvků (jako ostrůvky express VAJÍČEK v parenchymu β buněk pod rat insulin promoter, Doplňující Tabulka 1) pod renální kapsle host myší, které již obdržela OT-I/průkazu cd45.1 T buněk. Všechny tři zdroje (hostitel, dárce T-buněk a dárce ostrůvků) mají pozadí B6, a proto vyjadřují H-2Kb. Proto, i když VAJÍČKA expresi antigenu byla omezena na roubované β buněk, předpokládali jsme, že prezentace β-buňky-VAJÍČKA získaná pomocí non-parenchymu APC, jako jsou DC přes cross-prezentace by být požadovány pro LN připravovat a možná místní T-buněk responses17,18.

Rozdělena OT-I buněk (životaschopné průkazu cd45.1+CD8+Va2+ brány) ve vypouštění ledvin VE štěpu a 3 nebo 6 dní po obdržení jednoho štěpu 400 B6.ostrůvky. (a) reprezentativní flow cytometrie grafy. Poloha nerozděleného vrcholu OT-I byla stanovena pomocí kontroly “bez antigenu” štěpu ostrůvků B6. b) celkový počet dělených OT-I v renálním LN a štěpu, kde každý bod představuje samostatnou myš. Sdružená data ze sedmi nezávislých experimentů: n=8 příjemců štěpu v den 3 A n=14 příjemců štěpu v den 6. Jednoho dne 6 štěp byl ztracen kvůli poruše průtokového cytometru. Vodorovné pruhy jsou prostředky, hodnoty P byly vypočteny nepárovým dvouocasým t-testem s Welchovou korekcí.
CD8+ T buňky expandovat v místě zánětu
Jak se očekávalo, silný OT-jsem reakce byla zjištěna poprvé v renálních V tom kanalizace štěpu stránky a tohle byla závislá na přítomnosti VAJÍČEK antigen (Obr. 1a,b). Po 3 dnech po štěpu bylo možné detekovat dělené OT-I v LNs vypouštění B6.štěpy ostrůvků (obr. 1a) a byly hojné (obr. 1B, průměr=9,2 × 104). Naproti tomu v B6 bylo možné detekovat 100krát méně dělených ot-i buněk.štěpy (obr. 1a, b, průměr=6,6 × 102). Počet rozdělených ot-i buněk se v místě štěpu zvýšil 300krát od 3. dne do 6. dne (obr. 1b, průměr=6,6 × 102 v den 3 až 2,1 × 105 v den 6, P<0,0001, nepárový dvouocasý t-test s Welchovou korekcí), zatímco nedošlo ke zvýšení LN (obr. 1b). Odpověď OT-I v B6.štěpy by se daly vysvětlit infiltrací ot-I buněk, které se v LN proliferovaly. Profily CFSE se však mezi místy štěpu a LN lišily, protože buňky OT-I v štěpech byly více rozděleny než buňky v LN v den 6 (obr. 1a). Existují alespoň dvě možná vysvětlení tohoto rozdílu. Pouze buňky, které se mnohokrát rozdělily, infiltrovaly štěp. Alternativně se buňky dosahující štěpu rychleji dělí, možná kvůli množství dostupného antigenu. Zvýšení absolutního počtu buněk v štěpu ve srovnání s LN v den 6 nás vedlo k prozkoumání tohoto druhého vysvětlení.
Příbuzný interakce s ostrůvky podporuje rozšíření
určit možné příspěvek příbuzný MHC v naroubovat na místní rozšíření použili jsme ostrůvky odvozen od bm1.ßOVA myši (doplňková Tabulka 1). V bm1.ßOVA myši, molekula H-2Kbm1 není schopna prezentovat peptid OVA257-264 kvůli třem mutacím na H-2Kb (ref. 19). Srovnání odpovědí na B6.a bm1.štěpy ostrůvků ukázaly, že navzdory podobným reakcím OT-I v drenážním renálním LN byla expanze OT-I v bm1 snížena šestinásobně.ve srovnání s B6.ßOVA štěpy (průměr=4.7 × 104 ve srovnání s 2,6 × 105 děleným OT-I; P=0,0153 nepárový dvouocasý t-test s Welchovou korekcí; obr. 2a). Tato méně účinná expanze ot-i buněk infiltrujících bm1.ßOVA štěpy naznačovaly, že příbuzné interakce s roubovanými ostrůvkovými buňkami přispěly k lokální expanzi T-buněk.

průtoková cytometrická analýza ot-i buněk (životaschopné CD45.1+CD8+Va2+ gate) 6 dní po štěpu. a) celkové rozdělení OT-I v drenážním renálním LN a štěpu po obdržení jediného štěpu 400 B6.nebo bm1.ostrůvky. Údaje pro B6.ßOVA štěpené myši jsou podmnožinou těch, které jsou znázorněny na obr. 1b. každý bod představuje individuální myš. V každém panelu jsou zobrazena souhrnná data ze dvou nezávislých experimentů: n=5 příjemců B6.ßOVA štěpy a n=6 příjemců bm1.štěpy. Vodorovné pruhy jsou prostředky, hodnoty P byly vypočteny nepárovým dvouocasým t-testem s Welchovou korekcí. (b) Schéma bipolární štěpu model, ve kterém štěpy 200 ostrůvků jsou umístěny na opačných pólech téhož ledvin a sdílet společné vypouštění ledvin LN. Celkem děleno OT-I v písmenu c) B6.a KbKO.ßOVA bipolární štěpy a (d) B6.ßOVA a B6 bipolární štěpy (n=5 příjemce myši sloučené ze dvou nezávislých pokusů, v každém z c a d) Data pro stejné myši jsou spojeny přerušované čáry: P hodnoty byly vypočteny podle poměru párový t-test.
abychom eliminovali jakýkoli příspěvek h-2Kbm1 alloantigen, vygenerovali jsme KbKO.ßOVA myši, které exprimují vajíčkový antigen v ostrůvkových beta buňkách, ale postrádají alloantigen nebo H-2Kb (doplňková Tabulka 1). Poté jsme použili “bipolární štěpový model” k porovnání odpovědí na B6.a KbKO.ßOVA ostrůvek štěpy umístěny na opačných pólech téhož ledvin v B6 hostitele myši tak, že štěp-infiltrující T buňky byly odvozeny z T buněk nátěrem ve stejném LN (Obr. 2b). V B6 bylo přítomno 10-100krát více T buněk.více než KbKO.štěpy (obr. 2c). Pomocí poměru rozděleného OT-I na protilehlých pólech ledvin vypočtených pro jednotlivé myši jsme odvodili relativní poměr odezvy (RRR). RRR je uvedeno, že místní T-buněčné expanze byla 26-krát větší, když příbuzný zapojení s štěp buněk došlo (RRR=26.4±14.1 v B6.KbKO.ßOVA štěpy, P=0,0025, poměr spárovaný t-test, obr. 2c).
porovnali jsme také odpovědi na bipolární B6.ßOVA a B6 (bez antigenu) štěpy (obr. 2d). Velmi málo OT-I bylo možné detekovat v štěpech B6 (obr. 2d) a považujeme za pravděpodobné, že mnoho z nich cirkulovalo OT-I odvozené od kontaminace krve. Nespecifický zánět spojený s transplantací štěpů, které postrádají antigen, tedy nevede k účinné expanzi T-buněk v zanícené tkáni. Naproti tomu reakce na B6.ßOVA štěpy byly opět velmi silné a více než 900krát větší než štěpy B6 (RRR=950±252 pro B6.ßOVA: štěpy B6, P<0,0001, poměr spárovaný t-test, obr. 2d).
společně tyto experimenty ukázaly, že expanze CD8 T-buněk v zanícené cílové tkáni byla významně podporována lokální prezentací antigenu. To nutně nevylučuje další příspěvky k expanzi T-buněk, například křížovou prezentací hostitelského DC V štěpu. Jsme pouze tvrdí, že příbuzný interakce mezi T buňkami a buňky ostrůvků následek značné T-expanzi buněk.
Příbuzný interakce s bydlištěm leukocytů není nutné
Ostrůvky jsou složité shluky buněk, které obsahují β buňky, endoteliální buňky a ostrůvků bydliště leukocytů (IRL). Proto jsme se dále snažili objasnit, které ostrůvkové buňky prezentovaly antigen k infiltraci T buněk, aby poháněly expanzi T-buněk. Nejviditelnějším kandidátem by byla IRL. Tyto průkazu cd45+ buňky mají různě definovány jako DC nebo makrofágy, co-express CD11c a F4/80, a bylo prokázáno, že proces a prezentovat antigens20,21,22,23. Proto jsme zkoumali roli dárcovské IRL při řízení lokální expanze CD8 T-buněk. B6.myši byly zkříženy na CD11c. DTR.GFP myši za účelem získání CD11c. DTR.GFP.ßOVA myší, jejichž β buněk express VAJÍČEK a jejichž CD11c+ buňky mohou být zničeny tím, záškrtu toxin (DT) injection8. Nejprve jsme testovali na Faks, že ostrůvky izolované z CD11c. DTR.GFP myši léčené DT byly ochuzeny o buňky CD11c+ (obr. 3a,b). CD11c+ IRL u neléčených kontrolních myší byly identifikovány barvení k průkazu cd45 a CD11c, stejně jako jejich exprese GFP reportér a byly evidentně vyčerpány DT léčby (Obr. 3a, b, P=0,0002, nepárový dvouocasý t-test s Welchovou korekcí). Také jsme potvrdili, že CD11c + IRL koexprimoval F4 / 80 A H-2 Kb MHC třídy I (doplňkový obr. 2a) a následně buňky F4/80+ byly také vyčerpány z ostrůvků myší ošetřených DT (Doplňkový obr. 2b). CD11c. DTR.GFP.ßOVA ostrůvky izolované z neošetřených a DT ošetřených myší byly roubovány na opačných pólech stejné ledviny. Rozdělené číslo OT-I bylo mezi štěpy podobné, což naznačuje, že deplece IRL neměla žádný vliv na expanzi CD8+ T-buněk v místě štěpu (obr. 3c). Abychom potvrdili, že IRL nejsou důležité pro lokální expanzi CD8 T-buněk, provedli jsme druhou sadu experimentů. KbKO.ßOVA myší ozářených a rekonstituuje buď KbKO nebo B6 kostní dřeně (BM) generovat zdroj ßOVA ostrůvky, v nichž H-2Kb výraz byl nepřítomný ze všech buněk nebo selektivně obnovit do IRL (Obr. 3d). Srovnání takových ostrůvků v bipolárním štěpovém modelu ukázalo podobné úrovně expanze ot-I buněk v obou štěpech (obr. 3e). Proto IRL nejsou hlavními hnacími silami lokální expanze CD8 T-buněk.

analýza průtokové cytometrie ukazující depleci CD11c+ IRL v CD11c. DTR.GFP myši ošetřené DT: (a) Reprezentativní grafy ukazující vtokové z CD11c+IRL v ostrůvky z neléčených kontrolních myší a jejich vyčerpání na den po jednom DT léčbu, a (b) výčet CD11c+IRL v neošetřené a DT léčených myší. Každý bod představuje jednotlivé ostrůvek přípravek obsahující směsné ostrůvků od 1 do 8 myší, n=5 neošetřené ostrůvek přípravky a 6 DT léčených ostrůvek přípravy směsných ze čtyř nezávislých pokusů. Hodnota P vypočtená nepárovým dvouocasým t-testem s Welchovou korekcí. c) celkový podíl OT-I 6 dní po bipolárním štěpu ostrůvků získaných z CD11c. DTR.GFP.ßOVA myši, které nebyly léčeny nebo léčeny DT (n=6 přijímajících myší sdružených ze dvou nezávislých experimentů). Data pro stejnou myš jsou spojena přerušovanými čarami; hodnoty P vypočtené poměrem spárované t-test. (d) reprezentativní grafy ukazující nepřítomnost nebo přítomnost exprese H-2Kb na CD11c+IRL myší kbko rekonstituovaných s KbKO nebo B6 BM. Předem na životaschopných buňkách. (e) celkem rozdělené OT-I po 6 dnech po bipolárním štěpu ostrůvků získaných z chimaerických myší (n=3 přijímající myši z jednoho experimentu). Data pro stejnou myš jsou spojena přerušovanými čarami; Hodnoty P vypočtené poměrem spárované t-test.
příbuzná interakce s parenchymálními buňkami je důležitá
B6.Myši RIP-Kb transgenně exprimují H-2Kb v β buňkách pod kontrolou promotoru inzulinu potkanů24. Křížením těchto myší do KbKO.my jsme vytvořili KbKO.b.ßKb myši, u kterých byla exprese H-2Kb omezena na β buňky (doplňková Tabulka 1). Exprese H-2Kb na β buňkách byla potvrzena FACS analýzou ostrůvků (obr. 4a). Bránili jsme na ostrůvkových hematopoetických buňkách (CD45+) a endoteliálních buňkách (CD31+) a ukázali jsme, že H-2Kb nebyl exprimován na těchto buňkách ani v KbKO.nebo KbKO.b.ßKb myši ve srovnání se silnou expresí u myší B6 (obr. 4a). Zbývající CD45-CD31-buňky jsou autofluorescentní pozitivní a obohacené endokrinními buňkami. FACS analýza ostrůvků z KbKO.b.ßKb myši vykazovaly expresi H-2Kb v autofluorescenční populaci obohacené β-buňkami na úrovních podobných hladinám pozorovaným u ostrůvků B6 (obr. 4a). Srovnání v bipolární štěpu modelu je uvedeno, že expanze OT-byl jsem 14-krát větší, když příbuzný antigenu byl vyjádřen na β buňky (RRR=14.0±4.1 pro KbKO.b.kbko.ßOVA štěpy, P=0,0008, poměr spárovaný t-test, obr. 4b).

(a) Flow cytometrie grafy (gated na životaschopných buňkách) ukazující selektivní obnovení exprese H-2Kb na parenchymálních buňkách. Histogramy představují ostrůvky z KbKO (stínované), B6 (přerušované) nebo KbKO.(tučné) myši. (b) celkem rozdělený OT-I po 6 dnech po bipolárním štěpu KbKO.a KbKO. b.KB. ostrůvky (n=6 přijímajících myší sdružených ze tří nezávislých experimentů). Data pro stejnou myš jsou spojena přerušovanými čarami; hodnoty P vypočtené poměrem spárované t-test.
T buňky proliferují v místě zánětu
Naše výše uvedená zjištění naznačují, že tam byl místní šíření v cílovém místě. Aby bylo možné detekovat aktivně proliferující buňky, přešli jsme myši OT-I / CD45. 1 na myši FucciRG, abychom vytvořili FucciRG / OT-I / CD45.1 myši (zkráceně FucciOT-I). U takových myší buňky fluoreskují červeně (FucciR) během G0 / G1 a zeleně (FucciG) během fází buněčného cyklu s / G2 / M25, 26. Postupné degradace a akumulace FucciR a FucciG novinářům během přechodu mezi fází cyklu umožňuje dále rozlišovat: intenzivnější FucciR výraz v klidovém G0 versus jízda na kole G1 buněk, dvakrát negativní FucciR−G− buňky ve velmi raném G1, a slabě dvojí pozitivní FucciR+G+ buněk v G1/S (refs 26, 27). Klidové buňky FucciOT-I z negrafovaných myší byly FucciG- (obr. 5a, horní panel, negrafovaný). Abychom se vyhnuli interferenci s barvivy Fucci, nahradili jsme CFSE CTV. U myší, které dostaly B6.ßOVA štěpy, analýza CTV ředění je uvedeno, že rozdělit FucciOT-já jsem byl přítomen v odvodnění ledvin LN a některé z nich byly FucciG+ sugestivní aktivního buněčného dělení (Obr. 5a, horní panel, vypouštění LN). V místě štěpu jsme detekovali FucciOT-I, který prošel mnoha divizemi (CTV již není detekovatelná)a mnoho z nich bylo FucciG + podporující pokračující proliferaci (obr. 5a, horní panel, čerstvý štěp). Srovnání podílu FucciG + buněk v rozdělené populaci OT-I (obr. 5c) je uvedeno, že pokračující šíření v čerstvé štěpy (26.8±8.8% FucciG+) překročení, které v každém vypouštění ledvin LN (7.3±1.6%, P=0.008, je nepárový two-tailed t-test s Welch je korekce), nebo non-vyčerpávající ledvin LN (2.1±2.1%, P=0.003, je nepárový two-tailed t-test s Welch je korekce). Skutečně, zkoumání obou FucciG a FucciR projevu uvedl, že většina štěpu-infiltrující OT-jsem se aktivně dělení, to znamená, že jen velmi málo buněk vykazoval vysokou expresi FucciR, které bylo charakteristické pro klidový buněk v LN z ungrafted myší (Obr. 5a, spodní panely). I když jsme se domníval, že tato proliferace v místě zánětu byl generován in situ, nemůžeme zcela vyloučit možnost, že to prostě odráží nedávný příchod proliferujících buněk. Abychom to objasnili, shromáždili jsme bipolární štěpy B6.ßOVA ostrůvky pro analýzu jednoho štěpu bezprostředně po vyříznutí a kultivaci druhého štěpu po dobu 1 dne (obr. 5a). Zatímco počet OT – i se v období kultury nezvýšil (obr. 5b), pravděpodobně odrážející buněčnou smrt za suboptimálních podmínek ex-vivo, bylo nadále detekováno mnoho buněk FucciG+ OT-I (14,2±4,2% FucciG+, obr. 5c). Profil kultivovaného štěpu bez možného náboru na jeden den by naznačoval, že v štěpu došlo k vysoké de novo proliferaci.

(a) schematické a reprezentativní grafy průtokové cytometrie (uzavřené na životaschopných CD45.1+CD8+Va2+ lymfocytech) ukazující odpověď buňkami FucciOT-I v renální LNs nebo bipolární B6.štěpy. LNs a štěpu z jednoho pólu byly zkoumány okamžitě (čerstvé na 6 dní po štěpu), zatímco graft z opačného pólu byl kultivovaný pro 1 den před analýzou. LN z ungrafted myš byl součástí show, absence dělení a FucciG výraz (horní panel) a převaha FucciR vysoké buněk (dolní panel) v klidovém FucciOT-I. (b) Celkem rozděleno FucciOT-jsem v čerstvých a kultivované štěpy. Střední hodnota + s. d., n=5, hodnoty P vypočtené dvojím poměrem spárovaným t-testem. c) % FucciG + dělené OT-I v čerstvých neodvodňovacích a odvodňovacích renálních LN, jakož i čerstvých a kultivovaných štěpech. Průměr+s.d., n=5, s výjimkou non-vyčerpávající LN, pro které n=4 v důsledku ztráty jedné V průběhu zpracování. Hodnoty P byly vypočteny dvouocasým nepárovým t-testem s Welchovou korekcí. Data jsou sdružena ze dvou nezávislých experimentů.
Příbuzný interakce s parenchymálních buněk disky šíření
dále Jsme využili FucciOT-já modelu s cílem posoudit roli další potenciální místní řidič T-buněčné proliferace ve štěpu, moderátor-získané APC, jako jsou zánětlivé DC. Abychom eliminovali jakýkoli příspěvek hostitelského APC, nejprve jsme odvodili pozadí KbKO. Vzhledem k tomu, že myši kbko odmítly ot-I buňky, vytvořili jsme KbKO BM do B6 chimér pro použití jako hostitelé; hematopoetické buňky tedy postrádaly H-2Kb, ale byly tolerantní k ot-i buňkám. Tyto chiméry dostaly FucciOT-I T buňky a bipolární štěpy KbKO.ßOVA ostrůvky (postrádající expresi H-2Kb a tím i schopnost prezentovat OVA antigen) a KbKO.b.ßKb ostrůvky (h-2Kb i OVA antigen byly omezeny na β buňky). Protože Chimaera postrádala h-2kb pozitivní APC, bylo nutné podat buňky sleziny potažené OVA257-264 peptidem, aby se zahájila odpověď OT-I. Úspěch této nátěr byl uveden do CTV-ředění v FucciOT-já buněk v renálních LN, i když v době sklizně byly tyto FucciG− a neprokázalo, že by se aktivně dělení (0.1±0.0% FucciG+, Obr. 6a,d). Velmi málo OT-i infiltroval KbKO.v rámci KbKO byly ale štěpy jasně rozšířeny.b.ßKb štěpy (RRR 61,4±26,6 pro KbKO.b.kbko.na obr. 6b, P=0,0008, dvouocasý poměr spárovaný t-test). Takže i v nepřítomnosti příbuzného antigenu na hostitelském APC stačil příbuzný antigen na parenchymálních β buňkách k pohonu expanze CD8 T-buněk v místě štěpu. Několik FucciOT-I T buněk přítomných v KbKO.štěpy se podobaly těm v LN, a to jak z hlediska jejich neefektivního postupu k vysoce rozdělené frakci (obr. 6a, c, 7,5±0,9% vysoce rozděleno v LN a 19,3±3,3% vysoce rozděleno v KbKO.ßOVA štěpy) a nedostatek FucciG exprese (obr. 6a, d, 0,1±0,0% v LN a 0,1±0,1% V KbKO.ßOVA štěpy), což naznačuje, že v místě štěpu došlo k malé proliferaci OT-I v nepřítomnosti příbuzného antigenu. Naproti tomu OT-I v rámci KbKO.b.ßKb štěpy byly převážně vysoce rozděleny (92,3±1,0%, obr. 6a, c)a některé z nich byly FucciG+ a tak se aktivně množily (obr. 6a, d, 5,0±1,2% FucciG+). Proto, příbuzný antigenu prezentace ostrůvek parenchymu β buněk byl schopen řídit de novo šíření FucciOT-jsem in situ.

FucciOT-I odpověď na štěpy v KbKO BM do hostitelských myší B6, ve kterých hostitelské hematopoetické buňky postrádají expresi H-2Kb. Roubované myši obdržely v den roubování buňky sleziny potažené peptidem, aby zahájily ot-I priming. (a) reprezentativní grafy průtokové cytometrie (uzavřené na životaschopných CD45. 1+CD8+Va2 + lymfocytech). Horní panel ukazuje nedostatek dělení a FucciG výrazu v klidovém OT-I v LN myši, která nebyla naroubována ani natřena. Dolní tři panely ukazují reponse u bipolární roubované a primované myši: vypouštění ledvin LN, KbKO.a KbKO.b.štěpy. Rozdělené buňky u roubovaných myší byly rozděleny do dvou sektorů, přičemž vysoce rozdělené buňky spadaly do sektoru, ve kterém byla CTV zředěna za hranici detekce. b) celkem rozdělený FucciOT-I v KbKO.a KbKO.b.ßKb bipolární štěpy, hodnoty P vypočtené dvojím poměrem spárovaným t-testem. c) % vysoce rozdělených A D) % FucciG+ OT-I v drenážních renálních LN a štěpech bipolárních roubovaných myší. Hodnoty P byly vypočteny dvojím párovým t-testem. Výsledky pro jednotlivé myši jsou spojeny přerušovanými čarami, n=6 přijímajících myší sdružených ze dvou nezávislých experimentů.
IL-2 je více důležité v místě zánětu
ukázali Jsme, že IL-2Ra výraz byl více důležitý pro CD8+ T-buněčné proliferace a akumulace v periferní parenchymu (ostrůvek štěpy) ve srovnání se v místě penetrace v odvodnění LN (Obr. 7a). Kromě toho jsme analyzovali reakci na druhém místě vzdáleném od místa primingu, tedy bez odvodnění LN. CTV značené CD8+ T buňky z myší OT-i. IL-2RaKO (IL-2Ra−CD45.2+) A OT-I/Ly5.1 (IL-2Ra+, CD45.1+CD45.2+) byly společně přeneseny do hostitelských myší B6.CD45.1 (CD45.1+) před přijetím jediného štěpu B6.ostrůvky. Zřetelný průkazu cd45 allelickou podpisy každého převáděného T-buněčné populace (v kombinaci s barvením pro CD8 a Va2) nám umožnilo kvantifikovat a porovnat poměr rozdělen WT:IL-2RaKO OT-I (Obr. 7a, Doplňkový obr. 3). IL-2Ra WT jasně vytlačuje konkurence z trhu IL-2Ra KO OT-jsem na štěpu stránky ve srovnání s buď vypouštění (P=0.025, dvoustranný párový t-test) nebo non-vyčerpávající (P=0.044, dvoustranný párový t-test) LN. To je v souladu se zvýšenou závislost CD8+ T buněk IL-2 v době sekundární setkání s antigenem v místě zánětu ve srovnání s během počáteční připravovat na vypuštění LN.
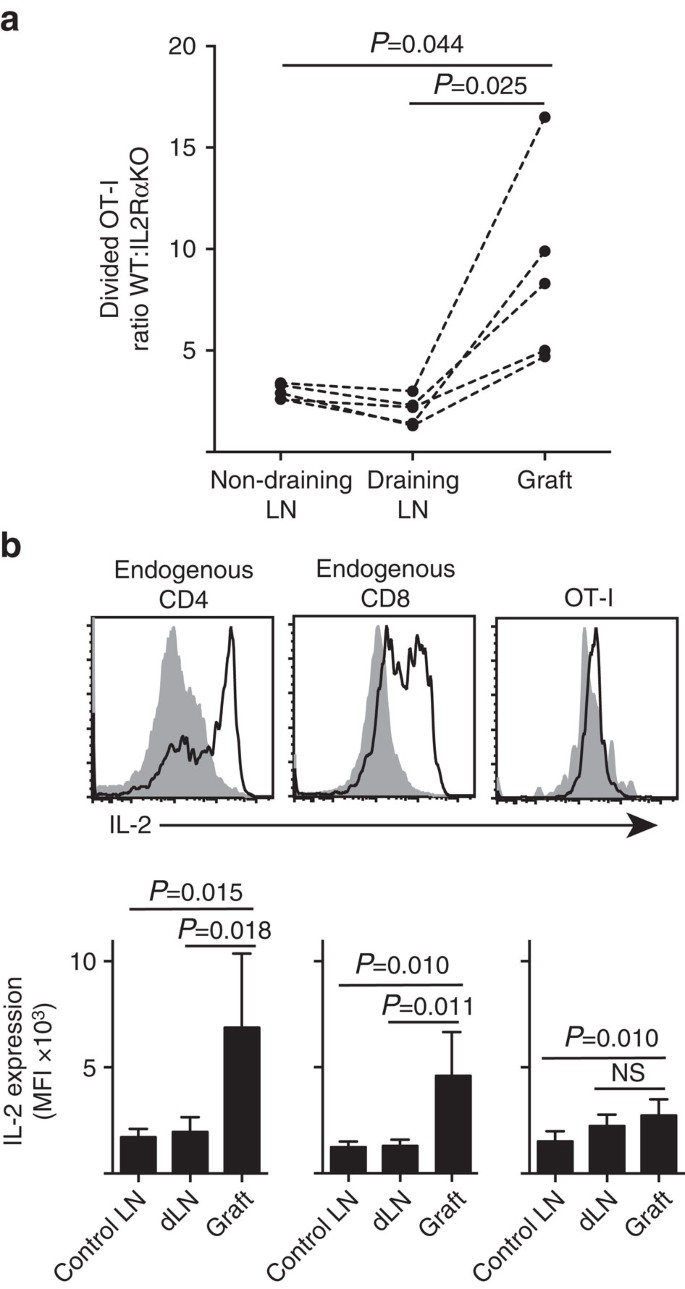
(a) Poměr rozdělen IL-2Ra WT:IL-2Ra KO OT-I buněk získaných z B6.ßOVA ostrůvkový štěp, drenážní renální LN a neodvodňující inguinální LN po společném přenosu (106 z každého) do hostitelských myší B6.CD45.1. Poměry byly vypočteny pro jednotlivé orgány s výsledky pro jednotlivé myši Spojené přerušovanými čarami a porovnány dvouocasým párovým t-testem. Výsledky pro N=5 přijímajících myší a zástupce tří nezávislých experimentů. b) exprese IL-2 v endogenních buňkách CD4+ a CD8+ a přenesených ot-i buňkách u B6 příjemců B6.štěpy ostrůvků. Horní panely zobrazují reprezentativní průtokové cytometrické grafy pro odvodnění štěpu renální LN (pevná šedá) a štěp (černá čára). Dolní panely shrnují střední fluorescenční intenzitu (MFI) exprese IL-2 pro renální Ln odebrané z negrafovaných (kontrolní LN), stejně jako štěp a drenážní renální LN (dLN) roubovaných myší. Výsledky jsou uvedeny jako průměr+s.d., n=6 sloučeny ze dvou nezávislých experimentů a porovnání oboustranný nepárový t-test s Welch je korekce.
zvýšená závislost na IL-2 pro CD8+ T-buněčné proliferace v místě zánětu dovodit požadavek pro místní IL-2 produkce. Proto jsme zkoumali potenciál různých T buněk (endogenní host-odvozené CD4+ a CD8+, stejně jako převedeny OT-I CD8+ T-buňky) pro schopnost produkovat IL-2 (Obr. 7b). Buněčné suspenze připravené z štěpů nebo LN byly krátce (4 h) restimulovány PMA a ionomycinem před barvením pro expresi intracelulárního IL-2. Vyšetření endogenní hostitele odvozen CD4+ a CD8+ T buněk dispozici přesvědčivé důkazy o IL-2 produkce v místě štěpu zánět s jasným nárůst MFI IL-2 barvení ve srovnání se buď vyčerpávající nebo non-vyčerpávající LN. IL-2 úrovně v OT-I CD8+ T buněk v místě zánětu byly mírně zvýšené nad těmi, v non-vyčerpávající LN, ale ani se výrazně liší od těch, které v odvodnění LN. Výklad těchto dat je, že příbuzný interakce OT-jsem s parenchymálních buněk vyvolává rychlé šíření, ale chudák IL-2 produkce, jako že OT-I jsou závislé na parakrinní IL-2 odvozené z endogenních CD4+ a CD8+ T buněk v místní štěpu prostředí. Další experiment však ukázal, že exogenní IL-2 v nepřítomnosti parenchymálního antigenu nemůže řídit expanzi ot-I CD8+ buněk. IL-2 (rekombinantní hIL-2, 25 000 IU) byl podáván intraperitoneálně myším B6, které dostávaly bipolární štěpy B6.B6 a B6 ostrůvky. Srovnání OT-já oživení orgánů zpět z IL-2 nebo vozidla léčených myší na 6. den po roubování neprokázaly žádné významné zvýšení akumulace rozdělit OT-I buněk ve dvou místech, že nedostatek parenchymu antigen konkrétně B6 ostrůvek štěpů (3±3 ve vozidle léčených ve srovnání s 49±64 v IL-2 ošetřených myší, P=0.342) a non-vyčerpávající tříselné LN (1,648+633 vozidel léčených ve srovnání s 1,660+1,023 v IL-2 ošetřených myší, P=0.987, průměr±s.d., n=3, oboustranný nepárový t-test s Welch je korekce).