Prognostická hodnota velikosti nádoru ve fázi II a III kolorektálního karcinomu v Tuniské populace
-
velikost Nádoru (TuS) byl ohlásen být prognostický u kolorektálního karcinomu.
-
v naší studii jsme studovali prognostickou roli TuS a identifikovali mezní hodnotu s nejvyšším predikčním výkonem.
-
Velikost 4 cm měla prognostický dopad a zasahovala do dalších prognostických faktorů.
-
pozorovali Jsme, že věk ≥65 let, III. etapa, žilní invaze a pN+ větší než 3 byly významné špatné prognostické faktory u pacientů s TuS ≥4, ale pouze fáze III byl nezávislý prognostický faktor v multivariační analýzy.
-
podávání chemoterapie bylo jediným faktorem s významným dopadem na přežití v jednorozměrných a vícerozměrných analýzách u pacientů s TuS menším než 4 cm.
Kolorektální karcinom (CRC) je třetí nejčastější rakovinou na světě a druhou nejčastější příčinou nádorových úmrtí v Západních zemích . V Tunisku představuje problém veřejného zdraví. Jeho výskyt se zvýšil za posledních 15 let . A to navzdory zlepšení diagnostiky a vyšetření postupy a také vzhledem k nedostatku screeningové programy, většina CRC případů v Tunisku zůstávají zjištěna u lokálně pokročilých (pT3–T4, node-pozitivní) nebo metastazujícím stadiu . Prognóza se v posledních letech zlepšila, s multidisciplinárním řízením; Odhaduje se, že 5leté celkové přežití (OS) je přibližně 70% ve stadiu II a 50% ve stadiu III . Bylo vyvinuto mnoho úsilí k upřesnění faktorů hodnocení rizik v CRC za účelem identifikace pacientů s největší pravděpodobností budou mít prospěch z adjuvantní terapie. Tyto faktory jsou hlavně klinické, patologické a nedávno molekulární (nestabilita mikrosatelitů / stabilita mikrosatelitů, cDNA), některé z nich jsou v mnoha zemích stále mimo dosah. Velikost nádoru (TuS) je náhradním markerem přežití u mnoha gastrointestinálních rakovin: rakovina žaludku, gastrointestinální stromální nádor, karcinoidní nádory . Jeho význam v CRC je nejasný, s protichůdnými výsledky v několika hlášených sériích . TuS neintegroval mezinárodní pokyny jako jeden z markerů, které je třeba vzít v úvahu při hodnocení rizika a indikaci adjuvantní chemoterapie . V nedávné studii s patologickými posouzení 1443 nových případů CRC v centrální oblasti Tuniska, 67,5% pacientů mělo TuS větší než 5 cm, toto zjištění je zcela odlišný od případů v Západních zemích . V naší současné studii jsme se zaměřili na studium výkonu TuS při předpovídání přežití ve stadiích II a III CRC a zkoumat vztah mezi TuS a známými prognostickými faktory.
Pacienti & metody
Jsme retrospektivně zhodnotili kohorty 257 pacientů s diagnózou tlustého střeva a/nebo adenokarcinom rekta, léčených ve dvou onkologických centrech: Abderrahmen Mami Nemocnice a Clinique Taoufik Nemocnice mezi roky 2003 a 2014. Podle amerického Smíšeného výboru pro rakovinu (AJCC)/Union Internationale Contre le Cancer (UICC) 7. vydání jsme zahrnuli případy fáze II–III, léčené s léčebným záměrem. Zvažovali jsme pouze pacienty s úplným zpracováním a dostupnými údaji o patologii včetně TuS a následných údajů. V období studie bylo sledování naprogramováno po dokončení léčebné terapie, každé 3-4 měsíce v prvních 2 letech, každých 6 měsíců od 3 do 5 let a poté každý rok. Při každé návštěvě byli pacienti podrobeni fyzickému vyšetření a byli zkontrolováni na příznaky a toxicitu léčby. Břišní ultrazvuk a rentgen hrudníku byly prováděny každých 6 měsíců, počínaje 2012 torakoabdominální CT vyšetření a nádorové markery (karcinoembryonální antigen, CA19–9) každých 6 měsíců byly provedeny.
TuS byl definován jako horizontální rozšíření nádoru měřené maximálním průměrem nádoru. Použili jsme receiver-operating characteristic (ROC) k určení výkonu TuS při předpovídání přežití a k identifikaci mezní hodnoty korelované s přežitím. Také jsme porovnali charakteristiky obou skupin podle mezní hodnoty, a zkoumali prognostické faktory v jednorozměrných a vícerozměrných analýzách v každé skupině.
Statistická analýza
všechny analýzy byly provedeny pomocí softwaru SPSS 20. Analyzovali jsme Roc křivky a analyzovali oblast pod křivkou (AUC) k určení přesnosti TuS při předpovídání přežití. AUC 1,0 byla bezchybná predikce rakoviny u pacientů, zatímco AUC 0,50 představuje poloviční pravděpodobnost přesné predikce stavu rakoviny. Čím vyšší je AUC-ROC, tím větší je diskriminační síla TuS pro výsledek. OS byl definován jako čas od data diagnózy do smrti z jakékoli příčiny nebo ztráty do sledování nebo nejnovějších zpráv. OS byl hodnocen podle Kaplan-Meierovy metody. Prognostické faktory byly hodnoceny pomocí jednorozměrné analýzy pomocí log-rank testu a multivariační analýzy pomocí Cox proporcionálních rizik modelu. Hodnota p menší než 0,05 byla považována za statisticky významnou.
výsledky
pro celkovou populaci byl průměrný věk 59 let (rozmezí 25-85 let), 57.2% byli muži. Pozorovali jsme onemocnění ve stadiu III u 53% pacientů, z nichž 37,5% bylo pN2. Adjuvantní chemoterapie byla podána všem pacientům s onemocněním stadia III (97,7% obsahujících oxaliplatinu). Ve stadiu II onemocnění 53% případů léčeni chemoterapií, byli pT4 fázi 22.5%, méně než 12 odstraněny lymfatické uzliny v 28% a měl nouzové operaci v 15% případů. Střední TuS byl 7 cm .
v roc analýze byla AUC TuS v predikci přežití ukázána na obrázku 1. Výkon TuS v predikci přežití byl porovnán s výkonem k počtu zapojených lymfatických uzlin. AUC byla 0.62 ± 0,048 pro TuS a 0,60 ± 0,56 pro pozitivní lymfatické uzliny.

Velikost 4 cm byla identifikována jako prediktor přežití s citlivostí 88,2% a specificitou 59,2%. Pozorovali jsme 98 pacientů s TuS ≤4 cm a 159 pacientů s TuS větším než 4 cm. Pacienti s TuS větší než 4 cm, byly více pravděpodobné, že mají rakovinu nachází v tlustém střevě (81.1 vs 70.4%, p = 0,002) a běžně pT4 (44 vs 22.4%, p = 0,0001). Jsme nepozorovali významný rozdíl podle pohlaví, nouzové operaci, méně než 12 odstraněny mízní uzliny, rychlost, počet pozitivních lymfatických uzlin, stádiu a podávání oxaliplatiny mezi pacienty TuS ≤4 cm a u pacientů s TuS větší než 4 cm (Tabulka 1).
| Proměnné | velikost Nádoru ≤4 cm % (n = 89) | velikost Nádoru > 4 cm, % (n = 159) | p-hodnota |
|---|---|---|---|
| Věk: | |||
| – Střední (průměrný) věk – <65 let – ≥65 let |
56 73.4 (72) 22.6 (26) |
62.8 (100) 38.2 (59) |
0.32 0.07 |
| Pohlaví: | |||
| – Male – Žena |
50 (49) 50 (49) |
57.2 (91) 43.8 (68) |
0.25 |
| BMI†: | |||
| – <30 – ≥30 |
91.3 (63) 8.7 (6) |
85.8 (85) 14.2 (14) |
0.28 |
| Umístění: | |||
| – Tlustého Střeva – Konečníku |
70.4 (69) 29.6 (29) |
81.1 (129) 8.9 (30) |
0.002* |
| Chirurgická pohotovost: | |||
| – Ano – Ne |
(14) (84) |
11.3 (18) 88.7 (141) |
0.52 |
| <12 lymfatické uzliny zkoumal§: | |||
| – Ano – Ne |
34.6 (34) 65.4 (64) |
44.6 (71) 55.3 (88) |
0.11 |
| pN+: | |||
| – 1–3 – >3 |
83.6 (82) 16.4 (16) |
77.9 (124) 22.1 (35) |
0.26 |
| pT: | |||
| pT1–pT3 pT4 |
77.6 (76) 22.4 (22) |
55.9 (89) 44.1 (70) |
<0.01* |
| Stage: | |||
| – Stage II – Stage III |
47.9 (47) 52.1 (51) |
47.1 (75) 42.9 (84) |
0.9 |
| Adjuvant therapy: | |||
| – Yes – No |
76.6 (75) 23.4 (23) |
79.2 (126) 20.8 (33) |
0.6 |
| Oxaliplatine: | 0.48 | ||
| – Yes – No |
48.9 (48) 51.1 (50) |
53.4 (85) 46.6 (74) |
|
| Relapse rate (%) | 35.2 | 37.1 | 0.75 |
| TTR‡ (měsíce) | 26 | 34 | 0.13 |
†k Dispozici pouze u 168 pacientů.
‡čas na relaps.
§V obou fázích II a III.
*Významné p-hodnoty.
reprodukováno se svolením © Oxford University Press (2017).
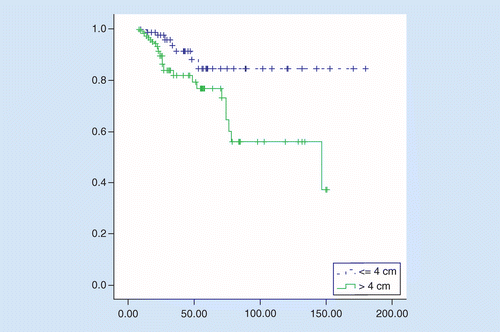
OS byl výrazně lepší v TuS ≤4 cm ve srovnání s TuS větší než 4 cm, průměrná doba přežití byla 158 versus 106 měsíců, poměr rizik = 2.92 (95% CI: 1,27-6,75, p = 0,01). 5-leté přežití pacientů, byla 84% u pacientů s TuS ≤4 cm a 76% u pacientů s TuS větší než 4 cm (p = 0.008; viz Obrázek 2).
prognostické faktory byly zkoumány v obou skupinách. V univariátní analýze jsme pozorovali významný špatný dopad věku ≥65 let, stadia III, žilní invaze a pN+ větší než 3 na přežití u pacientů s TuS větším než 4 cm. Pouze v multivariační analýze byla fáze III nezávislým prognostickým faktorem. U pacientů s TuS ≤4 cm, chemoterapie v adjuvantní léčbě byl hlavní faktory s významným dopadem na přežití v jednorozměrných a vícerozměrných analýz, tam byl žádný prognostický dopad ostatní testované faktory (Tabulka 2).
| Proměnné | velikost Nádoru < 4 cm (n = 159) | velikost Nádoru ≥4 cm (n = 89) | ||
|---|---|---|---|---|
| 5-rok OS (%) | HR (95% CI) | 5-leté OS (%) | HR (95% CI) | |
| Věk: | ||||
| – <65 let – ≥65 let |
87 78 |
1.07 (0.208−5.531) | 82 60 |
2.47 (1.35–5.88)* |
| pN+: | ||||
| – 1-3 – >3 |
78 82 |
2.14 (0.41–11.08) | 79 65 |
2.838 (1.25–6.41)* |
| pT: | ||||
| – pT1–pT3 – pT4 |
84 82 |
1.51 (0.29–7.79) | 84 74 |
1.44 (0.67–3.09) |
| Venous invasion: | ||||
| – Yes – No |
80 81 |
0.97 (0.189–5.08) | 63 84 |
2.94 (1.14–7.78)* |
| Stage: | ||||
| – Stage II – Stage III |
77 86 |
0.651 (0.148–2.955) | 85 58 |
0.285 (0.123–0.66)* |
| Adjuvant therapy: | ||||
| – Yes – No |
94 58 |
0.135 (0.025–0.696)* | 78 67 |
0.641 (0.257–1.6) |
| Oxaliplatine: | ||||
| – Yes – No |
92 83 |
0.28 (0.034–2.39) | 78 70 |
0.441 (0.19–1.02) |
| Tumor location: | ||||
| – Colon – Rectum |
90 75 |
0.428 (0.095-1.931) | 75 80 |
2.699 (0.806–9.03) |
*Významné hodnoty HR.
HR: poměr rizik; OS: celkové přežití.
diskuse
v současné době v západních zemích vedla integrace okultních screeningových programů k diagnostice CRC v dřívějších fázích . V nedávné studii SEER založené na datech v letech 2006 až 2012 bylo v rané fázi diagnostikováno 38% případů rakoviny tlustého střeva a 43% případů rakoviny konečníku . V zemích s nízkými středními příjmy, takový screeningový program není k dispozici; a většina případů je diagnostikována v regionálním nebo pokročilém stádiu s vysokým TuS . Identifikace prognostických faktorů je důležitým nástrojem ke zlepšení výsledků v těchto zemích. Naše studie zkoumala prognostickou roli TS ve stadiu II a III CRC v tuniské populaci. Zjistili jsme, že TuS měl nejen vliv na přežití, ale také zasahoval do dalších prognostických faktorů. Fáze III byla nezávislým prognostickým faktorem u nádorů s velkým objemem, zatímco mnoho “klasických” prognostických faktorů nemělo žádný vliv na menší nádory. Několik studií uvádělo prognostickou hodnotu TuS se sníženým zvýšením TuS spojeným s přežitím . Ve studii Kornprat et al., TuS byl významně spojen s přežitím bez progrese a specifickým pro rakovinu v jednorozměrných a vícerozměrných analýzách v tlustém střevě, ale ne u karcinomů konečníku . V naší sérii byl vyšší TuS častější v umístění rakoviny tlustého střeva. Ve skutečnosti může rakovina tlustého střeva zůstat asymptomatická po delší dobu, což vysvětluje vyšší tus při diagnóze ve srovnání s rakovinou konečníku. Nebyl však žádný rozdíl v přežití mezi nádory ≥4 cm umístěnými v tlustém střevě a nádory ≥4 cm umístěnými v konečníku. U menšího nádoru (<4 cm) také nedošlo k žádnému vlivu umístění nádoru. Na základě této analýzy tedy TuS neměl roli při předpovídání prognózy založené na umístění nádoru (tlusté střevo vs konečník). Saha a kol. hlášeno ve své velké řadě pacientů, že TuS je pozitivně korelován s důležitými prognostickými faktory a negativně ovlivnil přežití u rakoviny tlustého střeva . Jeho role v rakovině konečníku stále není jasná.
Vyšší TuS byla také spojena s pT4 fázi, uvádí, že mají nejhorší prognózu než T1–2N1 fázi (Intergroup trial INT-0089) . Nádorové zatížení může odrážet schopnost nádoru šířit se střevní stěnou, uzly a dalšími orgány. Ve skutečnosti, v naší studii, TuS měl prediktivní hodnotu analýzy ROC blízkou prediktivní hodnotě počtu pozitivních lymfy. U nádorů menších než 4 cm jsme nepozorovali rozdíl v přežití mezi pacienty ve stadiu II a III. Toto zjištění může být vysvětleno skutečností, že naše etapa II populace byla vysoce rizikové populace s horší prognózou (blízko k fázi III prognóza): mnoho stadiu pT4, v mnoha případech s méně než 12 odstraněny lymfatické uzliny, se v mnoha případech provozovány v nouzové (pro perforace a obstrukce). Ve dvou studiích založených na datech SEER měly menší nádory horší prognózu, což je onemocnění ve stadiu II. Autoři předpokládali, že malý TuS může být náhradním markerem biologické agresivity, což má za následek nižší výsledek ve srovnání s relativně větším TuS mezi stadiem II . Stejná pozorování byla pozorována v italské studii . Zkoumali jsme také roli několika prognostických faktorů podle TuS. Pozorovali jsme, že několik prognostických faktorů, jako je věk, fáze, počet zapojených lymfatických uzlin, umístění nádoru neměl mít významný dopad ve skupině pacientů s nízkou TuS. V naší studii měla adjuvantní chemoterapie pozitivní dopad na malé nádory, měl by být TuS považován za “vysoce rizikový” faktor ve fázi II? Jsou zapotřebí další studie zaměřené na tuto konkrétní otázku.
v naší sérii lze zaznamenat několik úskalí: malá velikost vzorku, retrospektivní sběr dat a absence centrální revize patologické zprávy pro přesné vyhodnocení TS. Neměli jsme dostatek dostupných údajů o přesném umístění nádoru, takže jsme nemohli provést takovou analýzu. Molekulární testování bylo zavedeno v Tunisku v roce 2015, v našem studijním období nebylo k dispozici. Hodnocení TuS podle stádia a podávání oxaliplatiny nebylo provedeno, protože příliš malý počet pacientů vyvozoval závěry.
Závěr
TuS je objektivní parametr, který lze snadno měřit během patologie vyšetření. Může představovat další prognostický faktor v populaci s vysokou mírou lokálně pokročilého stadia.
do Budoucnosti
Několik a komplexní genetické aletraions a/nebo cesty, může být za TuS v kolorektální rakoviny, molekulární analýze, která bere v úvahu velikost nádoru by mohla vést k přesnější explantations do jeho prognostické roli.
Finanční & konkurenční zájmy zveřejnění
autoři nemají žádné relevantní příslušnost nebo finanční zapojení s jakoukoli organizaci nebo subjekt s finanční zájem nebo finanční rozporu s předmětem či materiály projednány v rukopisu. To zahrnuje zaměstnání, poradenství, honoráře, vlastnictví akcií nebo opcí, svědectví, granty nebo obdržel patenty nebo nevyřízené, nebo licenční poplatky.
při výrobě tohoto rukopisu nebyla použita žádná pomoc při psaní.
Etického chování výzkumných
autoři uvádějí, že získaly vhodné institucionální review board schválení nebo dodržovat zásady uvedené v Helsinské Deklaraci pro všechny lidské nebo zvířecí experimentální vyšetřování. Kromě toho byl pro vyšetřování zahrnující lidské subjekty získán informovaný souhlas od zúčastněných účastníků.
- 1 Torre LA, Bray F, Siegel RL et al. Globální statistika rakoviny, 2012. CA. Rakovina J. Clin. 65(2), 87–108 (2015).Crossref, Medline, Google Scholar
- 2 Missaoui N, Jaidaine L, Abdelkader AB et al. Kolorektální karcinom ve středním Tunisku: rostoucí incidenční trendy za 15leté období. Asijské Pac. J. Rakovina Předchozí. 12(4), 1073–1076 (2011).Medline, Google Scholar
- 3 Missaoui N, Trabelsi A, Parkin DM et al. Trendy ve výskytu rakoviny v regionu Sousse, Tunisko, 1993-2006. Int. J. Rak 127(11), 2669-2677 (2010).Crossref, Medline, CAS, Google Scholar
- 4 Yang J, Du XL, Li ST et al. Charakteristiky různě umístěných kolorektálních karcinomů podporují proximální a distální klasifikaci: populační studie s 57 847 pacienty. PLoS ONE 11 (12), e0167540 (2016).Crossref, Medline, Google Scholar
- 5 Quan J, Zhang R, Liang H et al. Dopad velikosti nádoru na přežití pacientů s karcinomem žaludku pT4aN0M0. Rána. Surg. 79(3), 328-331 (2013).Medline, Google Scholar
- 6 Zhai ZW, Gu J. vliv velikosti nádoru na prognózu u pacientů s rakovinou tlustého střeva. Zhonghua Wei Chang Wai Ke Za Zhi. 15(5), 495–498 (2012).Medline, Google Scholar
- 7 Huang B, Feng Y, Zhu L et al. Menší velikost nádoru je spojena se špatným přežitím u rakoviny tlustého střeva ve stadiu II: analýza 7719 pacientů v databázi SEER. Int. J. Surg. Lond. Angl. 33 (Pt A), 157-163 (2016).Crossref, Medline, Google Scholar
- 8 Crozier JE, McMillan DC, McArdle CS et al. Velikost nádoru je spojena se systémovou zánětlivou odpovědí, ale ne přežitím u pacientů s primárním operabilním kolorektálním karcinomem. J. Gastroenterol. Hepatol. 22(12), 2288–2291 (2007).Crossref, Medline, Google Scholar
- 9 Labianca R, Nordlinger B, Beretta GD et al. Časná rakovina tlustého střeva: pokyny pro klinickou praxi ESMO pro diagnostiku, léčbu a sledování. Anna. Oncol. 24(Suppl. 6), VI64-VI72 (2013).Crossref, Medline, Google Scholar
- 10 Mandel JS, Church TR, Bond JH et al. Účinek screeningu fekální okultní krve na výskyt kolorektálního karcinomu. N.Engl. J.Med. 343(22), 1603–1607 (2000).Crossref, Medline, CAS, Google Scholar
- 11 Siegel RL, Miller KD, Fedewa SA et al. Statistika kolorektálního karcinomu, 2017. CA rakovina J. Clin. 67(3), 177–193 (2017).Crossref, Medline, Google Scholar
- 12 Kornprat P, Pollheimer MJ, Lindtner RA, Schlemmer, Řehák P., Langner C. Hodnota velikost nádoru jako prognostický proměnné v kolorektální rakoviny: kritické přehodnocení. Rána. J. Clin. Oncol. 34(1), 43–49 (2011).Crossref, Medline, Google Scholar
- 13 Saha S, Shaik M, Johnston G et al. Velikost nádoru předpovídá dlouhodobé přežití u rakoviny tlustého střeva: analýza národní databáze rakoviny. Rána. J. Surg. 209(3), 570-574 (2015).Crossref, Medline, Google Scholar
- 14 Le Voyer TE, Sigurdson ER, Hanlon AL et al. Přežití rakoviny tlustého střeva je spojeno se zvyšujícím se počtem analyzovaných lymfatických uzlin: sekundární průzkum meziskupinové studie INT-0089. J. Clin. Oncol. 21(15), 2912–2919 (2003).Crossref, Medline, CAS, Google Scholar
- 15 Wang Y, Zhuo C, Shi D et al. Nepříznivý účinek malé velikosti nádoru na přežití specifické pro příčinu ve stadiu rakoviny tlustého střeva IIA, studie založená na věštci. Int. J. Kolorektální DiS. 30(1), 131–137 (2015).Crossref, Medline, Google Scholar
- 16 Santullo F, Biondi A, Cananzi FCM et al. Velikost nádoru jako prognostický faktor u pacientů s rakovinou tlustého střeva ve stadiu IIa. Rána. J. Surg. doi:10.1016/j.amjsurg.2017.03.038 (2017) (Epub ahead of print).Medline, Google Scholar
- 17 Mejri N, Dridi M, Labidi S et al. P-299 prognostic value of tumor size in stage II and III colorectal cancer in Tunisian population. Ann. Oncol. 28(Suppl. 3), mdx261.296 (2017).Google Scholar