12.4: fordampning og kondensation
fordampning
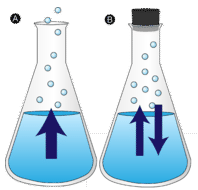
en vandpyt, der ikke er forstyrret, forsvinder til sidst. De flydende molekyler slipper ud i gasfasen og bliver vanddamp. Fordampning er den proces, hvor en væske omdannes til en gas. Fordampning er omdannelsen af en væske til dens damp under væskens kogetemperatur. Hvis vandet i stedet holdes i en lukket beholder, har vanddampmolekylerne ikke en chance for at flygte ud i omgivelserne, og vandstanden ændres derfor ikke. Da nogle vandmolekyler bliver damp, kondenserer et lige antal vanddampmolekyler tilbage i flydende tilstand. Kondensation er tilstandsændringen fra en gas til en væske.
for at et flydende molekyle kan undslippe i gastilstanden, skal molekylet have tilstrækkelig kinetisk energi til at overvinde de intermolekylære attraktive kræfter i væsken. Husk, at en given væskeprøve vil have molekyler med en bred vifte af kinetiske energier. Flydende molekyler, der har denne bestemte tærskel kinetiske energi undslippe overfladen og bliver damp. Som et resultat har de flydende molekyler, der forbliver nu, lavere kinetisk energi. Når fordampning sker, falder temperaturen af den resterende væske. Du har observeret virkningerne af fordampningskøling. På en varm dag absorberer vandmolekylerne i dit sved kropsvarme og fordamper fra overfladen af din hud. Fordampningsprocessen efterlader den resterende svedkøler, som igen absorberer mere varme fra din krop.
en given væske vil fordampe hurtigere, når den opvarmes. Dette skyldes, at opvarmningsprocessen resulterer i, at en større brøkdel af væskens molekyler har den nødvendige kinetiske energi til at undslippe væskens overflade. Figuren nedenfor viser den kinetiske energifordeling af flydende molekyler ved to temperaturer. Antallet af molekyler, der har den krævede kinetiske energi til at fordampe, vises i det skraverede område under kurven til højre. Væsken med højere temperatur \(\left (T_2 \ right)\) har flere molekyler, der er i stand til at slippe ud i dampfasen end væsken med lavere temperatur \(\left( T_1 \right)\).
ved 29.029 fod \(\venstre( 8848 \: \tekst{m} \højre)\) er Mount Everest i Himalaya-området på grænsen mellem Kina og Nepal det højeste punkt på jorden. Dens højde giver mange praktiske problemer for klatrere. Luftens iltindhold er meget lavere end ved havets overflade, hvilket gør det nødvendigt at bringe ilttanke sammen (selvom nogle få klatrere har nået toppen uden ilt). Et andet problem er kogende vand til madlavning. Selvom vand koger ved \(100^\tekst{o} \Tekst{C}\) ved havoverfladen, er kogepunktet oven på Mount Everest kun omkring \(70^\tekst{o} \Tekst{C}\). Denne forskel gør det meget vanskeligt at få en anstændig kop te (som bestemt frustrerede nogle af de britiske klatrere).