17.3: dannelsen af komplekse ioner
virkningen af dannelsen af komplekse ioner på opløselighed
Hvad sker der med opløseligheden af et sparsomt opløseligt salt, hvis en ligand, der danner en stabil kompleks ion, tilsættes til opløsningen? Et sådant eksempel forekommer i konventionel sort-hvid fotografering. Husk at sort-hvid fotografisk film indeholder lysfølsomme mikrokrystaller af AgBr eller blandinger af AgBr og andre sølvhalogenider. AgBr er et sparsomt opløseligt salt med en Ksp på 5,35 liter 10-13 ved 25 liter C. Når kameraets lukker åbnes, rammer lyset fra objektet, der fotograferes, nogle af krystallerne på filmen og indleder en fotokemisk reaktion, der omdanner AgBr til sort Ag-metal. Velformede, stabile negative billeder vises i gråtoner svarende til antallet af konverterede korn af AgBr, hvor de områder, der udsættes for det mest lys, er mørkeste. For at fikse billedet og forhindre, at flere AgBr-krystaller omdannes til Ag-metal under behandling af filmen, fjernes den uomsatte AgBr på filmen ved hjælp af en kompleksationsreaktion for at opløse det sparsomt opløselige salt.
reaktionen til opløsning af sølvbromid er som følger:
\
med
\
ligevægten ligger langt til venstre, og ligevægtskoncentrationerne af Ag+ og Br− ioner er meget lave (7,31 liter 10-7 M). Som et resultat ville fjernelse af uomsat AgBr fra endda en enkelt filmrulle ved hjælp af rent vand kræve titusinder af liter vand og meget tid. Le Chateliers princip fortæller os imidlertid, at vi kan drive reaktionen til højre ved at fjerne et af produkterne, hvilket vil medføre, at mere AgBr opløses. Bromidion er vanskeligt at fjerne kemisk, men sølvion danner en række stabile to-koordinatkomplekser med neutrale ligander, såsom ammoniak, eller med anioniske ligander, såsom cyanid eller thiosulfat (S2O32−). Ved fotografisk behandling opløses overskydende AgBr under anvendelse af en koncentreret opløsning af natriumthiosulfat.
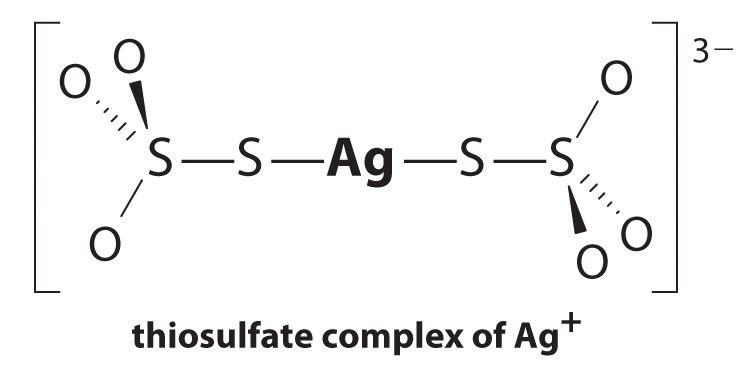
reaktionen af Ag+ med thiosulfat er som følger:
\^{3−}_{({17.3.5a}\]
med
\
størrelsen af ligevægtskonstanten indikerer, at næsten alle Ag+−ioner i opløsning straks komplekseres af thiosulfat til dannelse af 3 -. Vi kan se effekten af thiosulfat på opløseligheden af AgBr ved at skrive de relevante reaktioner og tilføje dem sammen:
\\ \mathrm{Ag^+(AK)} + \mathrm{2s_2o_3^{2 -} (Ak)}\rightleftharpoons\mathrm{^{3 -} (Ak)}\hspace{3mm}K_\tekstrm f&=2.9 \ tider10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\tekstrm F}=15 \ end{align} \ label{17.3.6}\)
sammenligning af K med Ksp viser, at dannelsen af den komplekse ion øger opløseligheden af AgBr med ca.3 liter 1013. Den dramatiske stigning i opløselighed kombineret med de lave omkostninger og den lave toksicitet forklarer, hvorfor natriumthiosulfat næsten universelt bruges til at udvikle sort-hvid film. Om ønsket kan Sølvet udvindes fra thiosulfatopløsningen ved hjælp af en hvilken som helst af flere metoder og genanvendes.
hvis en kompleks ion har en stor Kf, kan dannelsen af en kompleks ion dramatisk øge opløseligheden af sparsomt opløselige salte.
eksempel \(\Sideindeks{2}\)
på grund af den almindelige ioneffekt kan vi forvente, at et salt som AgCl er meget mindre opløseligt i en koncentreret opløsning af KCl end i vand. En sådan antagelse ville imidlertid være forkert, fordi den ignorerer det faktum, at sølvion har tendens til at danne et to-koordinatkompleks med chloridioner (AgCl2−). Beregn opløseligheden af AgCl i hver situation:
- i rent vand
- i 1,0 M KCL-opløsning, idet man ignorerer dannelsen af eventuelle komplekse ioner
- den samme opløsning som i del (b) undtagen under hensyntagen til dannelsen af komplekse ioner, forudsat at AgCl2− er det eneste Ag+ – kompleks, der dannes i signifikante koncentrationer
ved 25.1,105 til AgCl2 -.
givet: KSP af AgCl, KF af AgCl2− og KCl-koncentration
bedt om: opløselighed af AgCl i vand og i KCl-opløsning med og uden dannelse af komplekse ioner
strategi:
- skriv opløselighed produktudtryk for AgCl og beregne koncentrationen af Ag+ og Cl− i vand.
- Beregn koncentrationen af Ag+ i KCL-opløsningen.
- skriv afbalancerede kemiske ligninger til opløsning af AgCl og til dannelse af AgCl2− komplekset. Tilføj de to ligninger og beregne ligevægtskonstanten for den samlede ligevægt.
- skriv ligevægtskonstantekspression for den samlede reaktion. Løs for koncentrationen af den komplekse ion.
opløsning
- A hvis vi lader lig med opløseligheden af AgCl, så ved ligevægt = = M. udskiftning af denne værdi i opløselighedsproduktekspression,
således er opløseligheden af AgCl i rent vand ved 25 liter C 1,33 liter 10-5 M.
- B hvis lig med opløseligheden af AgCl i KCL-opløsningen, derefter ved ligevægt = H og = (1,0 + H) M. udskiftning af disse værdier i opløselighedsproduktekspression og under forudsætning af, at << 1.0,
hvis den fælles ioneffekt var den eneste vigtige faktor, ville vi forudsige, at AgCl er ca.fem størrelsesordener mindre opløselige i en 1,0 M KCL-opløsning end i vand.
- C for at redegøre for virkningerne af dannelsen af komplekse ioner, skal vi først skrive ligevægtsligningerne for både opløsningen og dannelsen af komplekse ioner. Tilføjelse af ligningerne svarende til Ksp og Kf giver os en ligning, der beskriver opløsningen af AgCl i en KCl-opløsning. Ligevægtskonstanten for reaktionen er derfor produktet af Ksp og Kf:
\\ \mathrm{Ag^+(AK)} + \mathrm{2CL^{ – }}\rightleftharpoons\mathrm {^{ – }}\hspace{3mm}K_ \ tekstrm f& =1.1 \ times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\tekstrm f}=1,9 \ times10^{-5} \ end{align}\)
D hvis vi lader lig med opløseligheden af AgCl i KCl-opløsningen, derefter ved ligevægt = h og = 1,0 − h. udskiftning af disse mængder i ligevægtskonstantekspression for nettoreaktionen og forudsat at << 1.0,
det vil sige, at AgCl opløses i 1,0 M KCl for at producere en 1,9 liter 10-5 m opløsning af AgCl2− kompleksionen. Således forudsiger vi, at AgCl har omtrent samme opløselighed i en 1,0 M KCl-opløsning som den gør i rent vand, hvilket er 105 gange større end det forudsagte baseret på den fælles ioneffekt. (Faktisk er den målte opløselighed af AgCl i 1,0 M KCl næsten en faktor på 10 større end den i rent vand, hovedsageligt på grund af dannelsen af andre chloridholdige komplekser.)
øvelse \(\Sideindeks{2}\)
Beregn opløseligheden af kviksølv (II) iodid (HgI2) i hver situation:
- rent vand
- en 3,0 m opløsning af NaI, forudsat at 2− er den eneste HG-holdige art, der er til stede i betydelige mængder
Ksp = 2,9 liter 10-29 for HgI2 og Kf = 6,8 liter 1029 for 2−.
Svar
- 1.9 × 10-10 M
- 1.4 M
kompleksdannende midler, molekyler eller ioner, der øger opløseligheden af metalsalte ved dannelse af opløselige metalkomplekser, er almindelige komponenter i vaskemidler. Langkædede carboksyl syrer, de vigtigste komponenter i sæber, danner uopløselige salte med Ca2+ og Mg2+, som er til stede i høje koncentrationer i “hårdt” vand. Udfældningen af disse salte producerer en badekarring og giver en grå tinge til tøj. Tilsætning af et kompleksdannende middel såsom pyrophosphat (o3popo34-eller P2O74 -) eller triphosphat (P3O105−) til vaskemidler forhindrer magnesium-og calciumsalte i at udfældes, fordi ligevægtskonstanten for dannelse af kompleks-ion er stor:
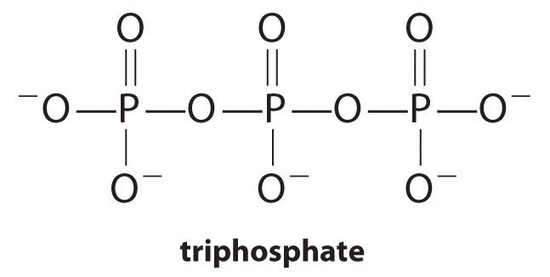
med
fosfater kan dog forårsage miljøskader ved at fremme eutrofiering, væksten af for store mængder alger i en vandmasse, hvilket i sidste ende kan føre til store fald i niveauer af opløst ilt, der dræber fisk og andre vandorganismer. Derfor har mange stater i USA forbudt brugen af fosfatholdige vaskemidler, og Frankrig har forbudt deres anvendelse begyndende i 2007. “Fosfatfrie” vaskemidler indeholder forskellige former for kompleksdannende midler, såsom derivater af eddikesyre eller andre carboksyl syrer. Udviklingen af fosfatsubstitutter er et område med intens forskning.
Kommercielle vandblødgøringsmidler bruger også et kompleksdannende middel til at behandle hårdt vand ved at føre vandet over ionbytterharpikser, som er komplekse natriumsalte. Når vand strømmer over harpiksen, opløses natriumion, og uopløselige salte udfældes på harpiksoverfladen. Vand behandlet på denne måde har en saltere smag på grund af tilstedeværelsen af Na+, men det indeholder færre opløste mineraler.
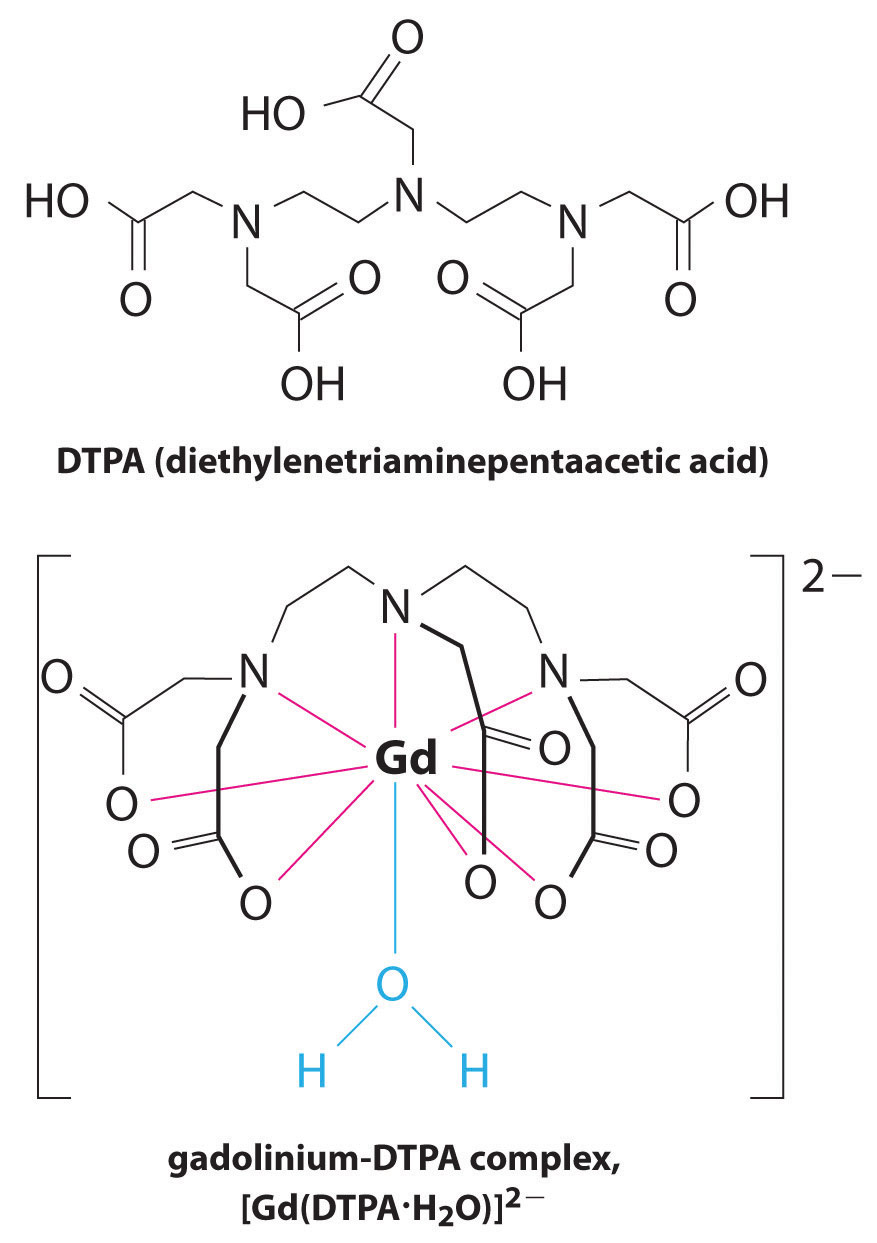
en anden anvendelse af kompleksdannende midler findes i medicin. I modsætning til røntgenstråler kan magnetisk resonansbilleddannelse (MRI) give relativt gode billeder af blødt væv, såsom indre organer. MR er baseret på de magnetiske egenskaber af 1h-kernen af hydrogenatomer i vand, som er en vigtig bestanddel af blødt væv. Fordi vandets egenskaber ikke afhænger meget af, om det er inde i en celle eller i blodet, er det svært at få detaljerede billeder af disse væv, der har god kontrast. For at løse dette problem har forskere udviklet en klasse af metalkomplekser kendt som “MR-kontrastmidler.”Injektion af et MR-kontrastmiddel i en patient påvirker selektivt vandets magnetiske egenskaber i celler i normalt væv, i tumorer eller i blodkar og giver lægerne mulighed for at “se” hver af disse separat (figur \(\Sideindeks{2}\)). En af de vigtigste metalioner til denne applikation er Gd3+, som med syv uparrede elektroner er meget paramagnetisk. Fordi Gd3+(ak) er ret giftigt, skal det administreres som et meget stabilt kompleks, der ikke adskiller sig i kroppen og kan udskilles intakt af nyrerne. De kompleksdannende midler, der anvendes til gadolinium, er ligander, såsom DTPA5− (diethylentriaminpentaeddikesyre), hvis fuldt protonerede form er vist her.
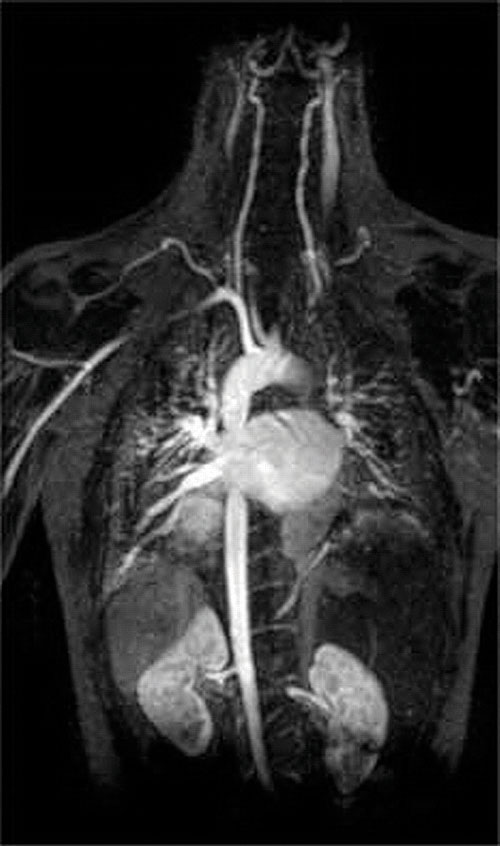
figur \(\Sideindeks{2}\): et MR-billede af hjertet, arterierne og venerne. Når en patient injiceres med en paramagnetisk metalkation i form af et stabilt kompleks kendt som et MR-kontrastmiddel, ændres de magnetiske egenskaber af vand i celler. Fordi de forskellige miljøer i forskellige typer celler reagerer forskelligt, kan en læge få detaljerede billeder af blødt væv.