2.3: kulilte og backbonding
generelle egenskaber
CO er en dativ, L-type ligand, der ikke påvirker metalcentrets iltningstilstand ved binding, men øger det samlede elektronantal med to enheder. Vi har for nylig set, at der virkelig er to bindingsinteraktioner i spil i carbonyl-liganden: en ligand-til-metal-n-larp d-LARP-interaktion og en metal-til-ligand-DN-larp* – interaktion. Sidstnævnte interaktion kaldes backbonding, fordi metallet donerer elektrondensitet tilbage til liganden. For at minde mig selv om eksistensen af backbonding kan jeg godt lide at bruge den højre resonansstruktur, når det er muligt; det er dog vigtigt at huske at behandle CO som en L-type ligand, uanset hvilken resonansform der tegnes.

Orbitalinteraktioner I M=C=O.
CO er en stærk Kurt-donor (eller Kurt-base) og en god Kurt-acceptor (eller Kurt-syre). Egenskaberne af ligeret CO afhænger dybt af metalcentrets identitet. Mere specifikt dikterer metalcentrets elektroniske egenskaber vigtigheden af backbonding i metalcarbonylkomplekser. Mest stumt, mere elektronrige metalcentre er bedre til backbonding til CO. Hvorfor er det vigtigt at fastslå styrken af backbonding?
infrarød spektroskopi er berømt blevet brugt til empirisk at understøtte ideen om backbonding. Tabellen nedenfor arrangerer nogle metalcarbonylkomplekser i” periodisk ” rækkefølge og tilvejebringer frekvensen svarende til C=O-strækningstilstanden. Bemærk, at hver kompleks CO uden undtagelse har en strækfrekvens, der er lavere end den for fri CO. Backbonding er skylden! C – O-bindingsordren i kompleks kulilte er (næsten altid) lavere end for fri CO.

c=o strækfrekvenser i metal-carbonylkomplekser. Ser der noget ud her?
figuren ovenfor viser en klar stigning i frekvens (en stigning i C–O-bindingsrækkefølge), når vi bevæger os fra venstre mod højre over det periodiske system. Dette fund kan virke underligt, hvis vi overvejer, at antallet af d-elektroner i det neutrale metal stiger, når vi bevæger os fra venstre mod højre. Bør ikke metalcentre med flere d-elektroner være bedre til backbonding (og mere “elektronrig”)? Hvad foregår der her? Husk den periodiske tendens i orbitalenergi. Når vi bevæger os fra venstre mod højre, falder d-orbitalenergierne, og energierne fra DN og Kurt* orbitalerne adskilles. Som et resultat bliver den backbonding orbital interaktion værre (husk, at stærke orbital interaktioner kræver godt matchede orbital energier), når vi bevæger os mod de mere elektronegative sene overgangsmetaller! Vi kan tegne en analogi til enaminer og enolethere fra organisk kemi. Det mere elektronegative iltatom i enolethere er en værre elektrondonor end enamins nitrogenatom.

betydningen af backbonding afhænger af metalets elektronegativitet og dets elektrondensitet.
selvfølgelig kan bidraget fra andre ligander på metalcentret til backbonding heller ikke glemmes. Logisk set vil elektrondonerende ligander have tendens til at gøre backbond stærkere (de gør metallet til en bedre elektrondonor), mens elektronudtagende ligander vil forværre backbonding. Tilføjelse af elektronrige phosphinligander til et metalcenter reducerer for eksempel CO-strækningsfrekvensen på grund af forbedret backbonding.
Carbonyl ligander er berømt i stand til at bygge bro over flere metalcentre. Binding i broede carbonylkomplekser kan enten være” traditionel ” eller delokaliseret, afhængigt af kompleksets struktur og bromodus. Mangfoldigheden af brodannelsestilstande stammer fra de forskellige elektrondonorer og acceptorer, der findes på CO-liganden (og muligheden for delokaliseret binding). Kendte brodannelsestilstande er vist i nedenstående figur.
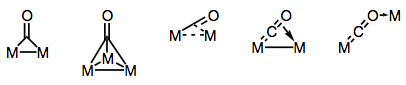
bygge broer med carbonyl ligander!