3.3 konformation af Cycloheksan
konformationer af Cycloheksan
en plan struktur for cycloheksan er klart usandsynlig. Bindingsvinklerne ville nødvendigvis være 120 liter, 10,5 liter større end den ideelle tetraedriske vinkel. Også hver kulstof-carbonbinding i en sådan struktur ville blive formørket. Den resulterende vinkel og formørkelsesstammer ville alvorligt destabilisere denne struktur. Hvis to carbonatomer på modsatte sider af den seksledede ring løftes ud af ringens plan, kan meget af vinkelstammen elimineres.
denne bådstruktur har stadig to formørkede bindinger og svær sterisk trængsel af to hydrogenatomer på bådens “bue” og “agterstavn”. Denne steriske trængsel kaldes ofte sterisk hindring. Ved at dreje bådkonformationen kan den steriske hindring delvist lettes, men vridbådskonformeren bevarer stadig nogle af de stammer, der kendetegner bådkonformeren. Endelig dannes en relativt belastningsfri ‘stol’ konforme ved at løfte det ene kulstof over ringplanet og det andet under planet. Dette er den dominerende struktur vedtaget af molekyler af cycloheksan.
undersøgelser vedrørende konformationerne af cycloheksan blev indledt af H. Sachse (1890) og E. Mohr (1918), men det var først i 1950, at en fuldstændig behandling af de mangfoldige konsekvenser af interkonverterende stolekonformere og de forskellige retninger af hængende obligationer blev belyst af D. H. R. Barton (Nobelprisen 1969 sammen med O. Hassel). Den følgende diskussion præsenterer nogle af de væsentlige træk ved denne konformationsanalyse.
ved omhyggelig undersøgelse af en stolkonformation af cycloheksan finder vi, at de tolv hydrogener ikke er strukturelt ækvivalente. Seks af dem er placeret omkring periferien af carbonringen og kaldes Ækvatorial. De andre seks er orienteret over og under ringens omtrentlige plan (tre på hvert sted) og betegnes aksiale, fordi de er justeret parallelt med ringens symmetriakse.
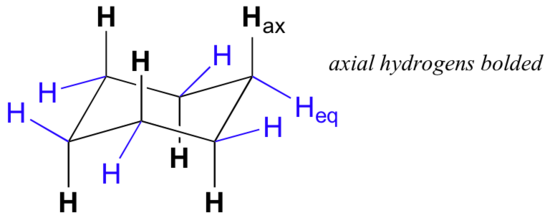
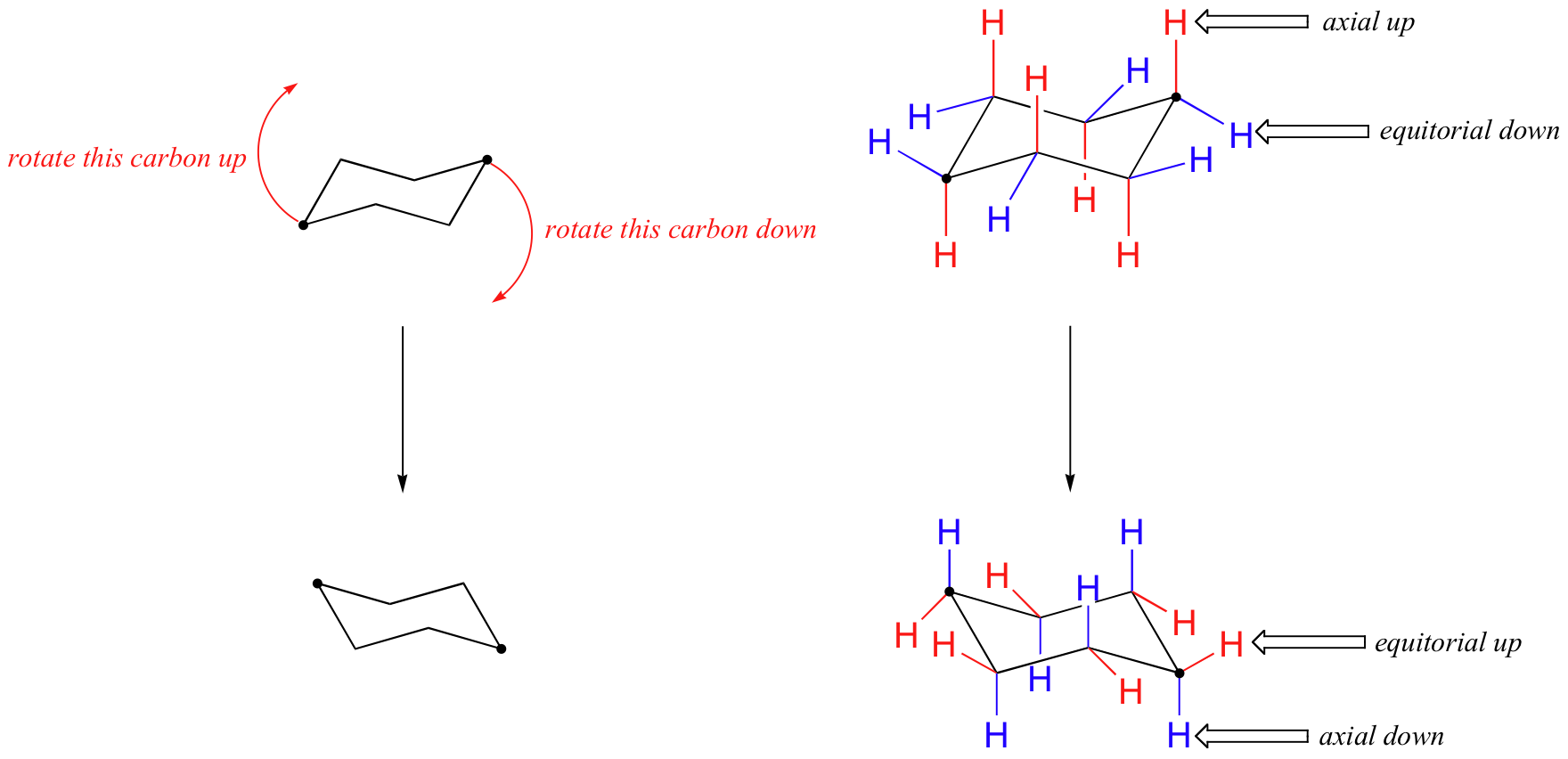
i figuren ovenfor er de ækvatoriale hydrogener farvet blå, og de aksiale hydrogener er med fed skrift. Da der er to ækvivalente stolkonformationer af cycloheksan i hurtig ligevægt, har alle tolv hydrogener 50% ækvatorial og 50% aksial karakter. Figuren nedenfor illustrerer, hvordan man konverterer en molekylær model af cycloheksan mellem to forskellige stolkonformationer – det er noget, du bør øve med modeller. Bemærk, at en’ ringflip ‘ får ækvatoriale hydrogener til at blive aksiale og omvendt.
fordi aksiale bindinger er parallelle med hinanden, lider substituenter, der er større end brint, generelt større sterisk trængsel, når de er orienteret aksial snarere end Ækvatorial. Derfor vil substituerede cykloheksaner fortrinsvis vedtage konformationer, hvor de større substituenter antager Ækvatorial orientering.
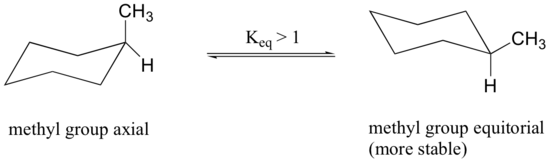
når methylgruppen i strukturen ovenfor indtager en aksial position, lider den sterisk trængsel af de to aksiale hydrogener placeret på samme side af ringen.

konformationen, hvor methylgruppen er ækvatorial, er mere stabil, og dermed ligger ligevægten i denne retning.
den relative steriske hindring, der opleves af forskellige substituentgrupper orienteret i en aksial versus Ækvatorial placering på cycloheksan, kan bestemmes af forbindelsens konformationsligevægt. Den tilsvarende ligevægtskonstant er relateret til energiforskellen mellem konformerne, og indsamling af sådanne data giver os mulighed for at evaluere den relative tendens af substituenter til at eksistere i en ækvatorial eller aksial placering.En tabel over disse gratis energiværdier (undertiden benævnt a-værdier) kan undersøges ved at klikke her.
når man ser på energiværdierne i denne tabel, er det klart, at den tilsyneladende “størrelse” af en substituent (med hensyn til dens præference for ækvatorial frem for aksial orientering) påvirkes af dens bredde og bindingslængde til cycloheksan, hvilket fremgår af det faktum, at en aksial vinylgruppe er mindre hindret end ethyl, og jod lidt mindre end chlor.
vi bemærkede tidligere, at cycloalkaner med to eller flere substituenter på forskellige ringkulstofatomer eksisterer som et par (nogle gange mere) af konfigurationsstereoisomerer. Nu skal vi undersøge den måde, hvorpå gunstige ringkonformationer påvirker egenskaberne af konfigurationsisomerer. Husk, at konfigurationsstereoisomerer er stabile og ikke let interkonverterer, hvorimod konformationelle isomerer normalt interkonverterer hurtigt. Ved undersøgelse af mulige strukturer for substituerede cycloheksaner er det nyttigt at følge to principper:
(i) Stolkonformationer er generelt mere stabile end andre muligheder.
(ii) substituenter på stolekonformere foretrækker at besætte ækvatoriale positioner på grund af den øgede steriske hindring af aksiale placeringer.
følgende ligninger og formler illustrerer, hvordan tilstedeværelsen af to eller flere substituenter på en cykloheksanring forstyrrer interkonverteringen af de to stolkonformatorer på måder, der kan forudsiges.
i tilfælde af 1,1-disubstituerede cycloheksaner skal en af substituenterne nødvendigvis være aksiale og den anden ækvatoriale, uanset hvilken stolkonformator der overvejes. Da substituenterne er de samme i 1,1-dimethylcycloheksan, er de to konformere identiske og til stede i samme koncentration. I 1-t-butyl-1-methylcycloheksan er t-butylgruppen meget større end methylen, og den stolkonformator, hvor den større gruppe er ækvatorial, vil blive begunstiget i ligevægten( > 99%). Følgelig er methylgruppen i denne forbindelse næsten udelukkende aksial i sin orientering.
i tilfælde af 1,2-, 1,3 – og 1,4-disubstituerede forbindelser er analysen lidt mere kompleks. Det er altid muligt at have begge grupper ækvatoriale, men om dette kræver et cis-forhold eller et trans-forhold afhænger af den relative placering af substituenterne. Når vi tæller rundt om ringen fra kulstof #1 til #6, ændrer den øverste binding på hvert kulstof sin orientering fra Ækvatorial (eller aksial) til aksial (eller ækvatorial) og tilbage. Det er vigtigt at huske, at bindingerne på en given side af en stolringkonformation altid skifter på denne måde. Derfor bør det være klart, at for cis-1,2-disubstitution skal en af substituenterne være ækvatoriale og den anden aksiale; i trans-isomeren kan begge være ækvatoriale. På grund af den vekslende karakter af ækvatoriale og aksiale bindinger er det modsatte forhold sandt for 1,3-disubstitution (cis er alle ækvatoriale, trans er ækvatoriale/aksiale).
endelig vender 1,4-disubstitution tilbage til 1,2-mønsteret:
ovenstående analyse er ikke noget, du skal prøve at huske: bliv snarere fortrolig med at tegne cycloheksan i stolens konformation, med bindinger, der peger i de rigtige retninger for aksiale og ækvatoriale substituenter. Hvis du kan tegne en struktur korrekt i stolens konformation, skal du altid være i stand til at bestemme, hvilke positioner der er aksiale, og hvilke der er ækvatoriale.