7.4: kompleks III
kompleks III accepterer elektroner fra både kompleks i og kompleks II. elektronerne ankommer i form af allestedsnærværende, UKH2, som leverer to elektroner og to protoner og omdannes tilbage til allestedsnærværende, UK. Allestedsnærværende kører derefter tilbage til kompleks i eller kompleks II for at samle flere elektroner.
- kompleks III er destinationen for elektroner, der ankommer fra både kompleks i og kompleks II.
- kompleks III bruger energi frigivet i nedadgående elektronoverførsler til at pumpe flere protoner over den indre mitokondriemembran.
- protongradienten over membranen bruges til at drive ATP-dannelse ved kompleks V.
- kompleks III sender derefter sine elektroner videre til kompleks IV.
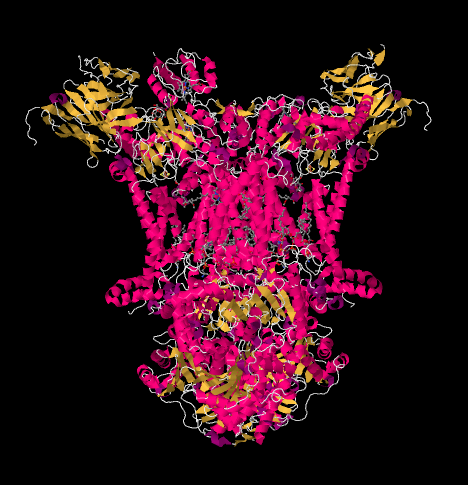
elektronernes vej gennem kompleks III er vist nedenfor. Bemærk, at komplekset er en dimerisk struktur med to ækvivalente stier: den ene vist til venstre og den anden til højre. Elektroner leveres fra UKH2, allestedsnærværende, midt på billedet, der rejser opad til det mobile cytokrom c øverst. En anden elektronvej tillader rejse nedad i billedet mod et andet molekyle af allestedsnærværende, som genbruger elektronerne i en løkke.
- kompleks III har en usædvanlig, divergerende elektronvej.
- en elektron bevæger sig videre mod cytochrom c.
- den anden elektron genanvendes til sidst til en anden allestedsnærværende.
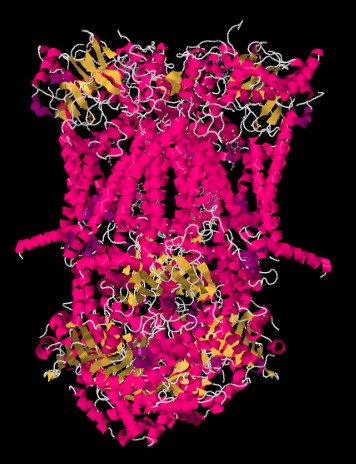
Røntgenstrukturen af kompleks III er vist i tegneserieform nedenfor. Den indre mitokondriemembran skærer den øverste midterste del af komplekset. Størstedelen af de komplekse projekter nedenfor, ind i matricen (bunden af billedet i denne retning), Selvom en betydelig mængde også stikker ud i intermembranrummet.
kompleks III fortsætter elektrontransportkæden og sender elektroner til højere reduktionspotentiale (og lavere fri energi) og mod et møde med molekylært ilt i kompleks IV. Protoner pumpes også fra mitokondriematricen, over den indre mitokondriemembran og ind i intermembranrummet. Samtidig resulterer en anden elektronrute i en effektiv genanvendelse af halvdelen af elektronerne, der kommer ind i komplekset, hvilket øger antallet af protoner, der pumpes pr. elektron, der ankommer til kompleks III.
- det er blevet foreslået, at elektrongenvindingssløjfen giver en mekanisme til at trække flere protoner op fra matricen.
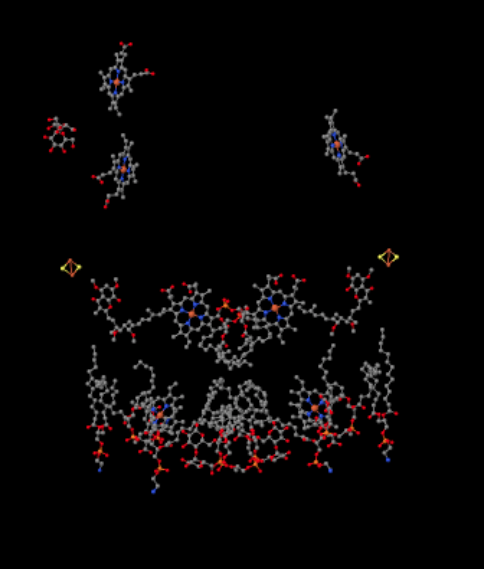
vi kan se dette usædvanlige arrangement, hvis vi ignorerer proteinerne for at afsløre liganderne nedenfor. Komplekset kan tydeligere ses som en dimer; den venstre halvdel af billedet er nøjagtigt det samme som højre, skønt det afspejles på den modsatte måde. Elektroner kommer ind i komplekset via mobilbæreren, allestedsnærværende, synlig på højre og venstre side af billedet omkring halvvejs ned; Du kan se ringen og en kæde hængende fra den.
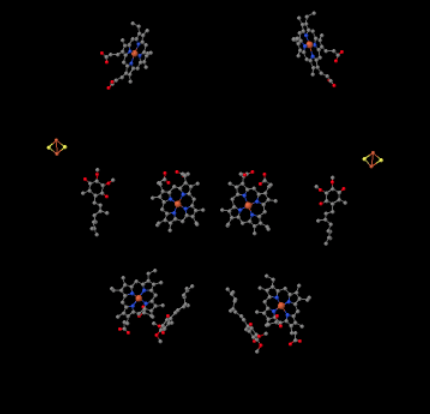
når UKH2 binder til kompleks III, sendes en elektron videre til en Fes-klynge, mens den anden sendes til et jernhæmecenter, kaldet heme BL. Fes-klyngen er synlig lige over allestedsnærværende og til kanten af billedet. Heme BL er mod midten af billedet.
selvom det ikke er tydeligt i det viste røntgenbillede, er denne Fes-klynge anderledes end dem, du så tidligere. Denne holdes på plads med forskellige aminosyresidekæder. Du kan ikke se det på billedet, fordi hele proteinet er udeladt sammen med de aminosyrer, der binder til klyngen. Mens de fleste FeS-klynger udelukkende holdes på plads af cysteiner, holdes denne klynge på plads af to cysteiens på den ene side, men af to histidiner på den anden. Denne ejendommelige Fes-klynge kaldes en Rieske-klynge.
Rieske-klynger er vigtige, fordi de er “høje potentielle FeS-klynger”. Det betyder, at de har usædvanligt positive reduktionspotentialer sammenlignet med andre FeS-klynger. Reduktionspotentialet for enhver ligand i et protein er meget afhængig af dets miljø, og der er derfor en bred vifte af værdier i de fleste tilfælde. Det gælder for jernsvovlklynger; normale har reduktionspotentialer, der spænder fra -1,0 V til omkring +0,05 V. Rieske-klynger har potentialer, der spænder fra omkring 0V til omkring 0,4 V.
fra Fes-klyngen sendes elektronen videre til et andet jernhæmecenter i en membranbundet enhed kaldet cytochrom c1. Cytochrom c1 kan ses øverst på billedet. Fordi dette billede er orienteret på samme måde som de andre Røntgenstrukturer i åndedrætskomplekset, kan vi se, at denne elektron bliver transporteret op mod intermembranrummet. Endelig overføres denne elektron til en anden hæm, men denne hæm er bundet i et lille mobilt protein, kaldet cytochrom c. cytochrom c er en anden mobil elektronbærer. Det fører elektronen videre til kompleks IV. VI kommer tilbage til cytokrom c lidt senere.
før vi kommer til det, hvor går den anden elektron hen? Fra heme BL overføres den anden elektron til et andet jernporfyrinkompleks, heme BH. Det er mod bunden af billedet, så denne elektron bliver faktisk sendt tilbage mod matricen. Venter ved heme BL, imidlertid, der er en anden allestedsnærværende, UK. Det venter på elektronen. Det vil faktisk vente på to, så forlade sin dock og gå tilbage til allestedsnærværende (UKH2) bindingssted for at levere elektronerne igen.
hvorfor gider? Hvorfor ikke bare sende elektronerne på vej ordentligt første gang? Det ser ud til, at de bliver genbrugt af en eller anden grund. Det antages, at denne omdirigering gør det muligt at pumpe yderligere protoner over mitokondriemembranen. Når den anden allestedsnærværende bliver reduceret til allestedsnærværende via accept af to elektroner, henter den også yderligere to protoner fra matricen nedenfor. Disse protoner vil til sidst blive passeret mod intermembranrummet, når allestedsnærværende bliver iltet igen. Denne genanvendelse, og klemme ud et par ekstra protoner for at øge protongradienten, kaldes K-sløjfen.
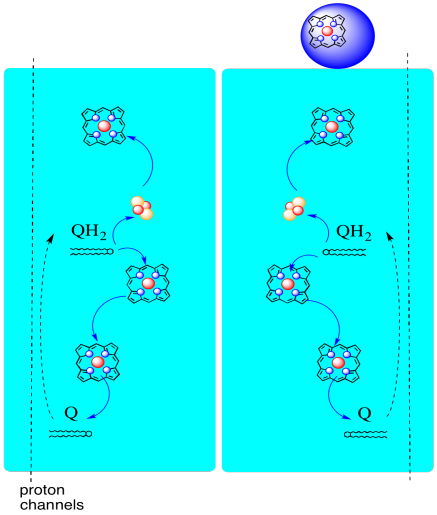
fordelen ved K-sløjfen er forklaret i det følgende diagram. I diagrammet er indgange til kompleks III vist i rødt, udgange er vist i blåt, og genanvendte elementer er i grønt. Hvis en allestedsnærværende simpelthen leverede sine elektroner og protoner og blev udført, ville der være to protoner leveret pr. Det er en protonudgang pr.
en anden allestedsnærværende ville gøre nøjagtig det samme. Der ville være fire protoner output for fire elektroner oprindeligt input. Det er stadig en protonudgang pr.
hvis der i stedet genbruges en elektron hver gang, fører hvert sekund allestedsnærværende til levering af et ekstra par protoner. Det skyldes, at ved opsamling af de genanvendte elektroner har en allestedsnærværende været nødt til at rejse tilbage til membranens matriksside og hente yderligere to protoner. Samlet set betyder det, at seks protoner leveres til fire elektronindgange eller 1,5 protonudgang pr. Da protongradienten er det, der genererer ATP, øges effektiviteten ved at øge antallet af protoner, der pumpes pr.
- kV-sløjfen øger antallet af protoner, der pumpes pr.
lad os nu komme tilbage til den udgående elektronbærer, cytochrom c, som vil færge elektronerne videre til kompleks IV. På billedet nedenfor, fra en anden Røntgenkrystallstruktur, er komplekset fundet med en cyctochrome c-docking på bindingsstedet. Cytochrom c er et lyserødt kugleformet protein fastgjort øverst på billedet, på venstre halvdel af dimeren, som vi ser på det her. Det sidder ved kanten af intermembranrummet, som er vandige medier. I modsætning til allestedsnærværende, der glider langs gennem membranens lipiddobbelte lag, cytochrom c ruller eller glider eller svømmer over toppen til sin destination.
den samme visning er vist nedenfor uden proteinet. Den nederste del af billedet er temmelig rodet med lipider, og der er et sukker hængende øverst til venstre, men lige øverst kan du se jernporfyrinet, der er beliggende inde i cytochrom c.
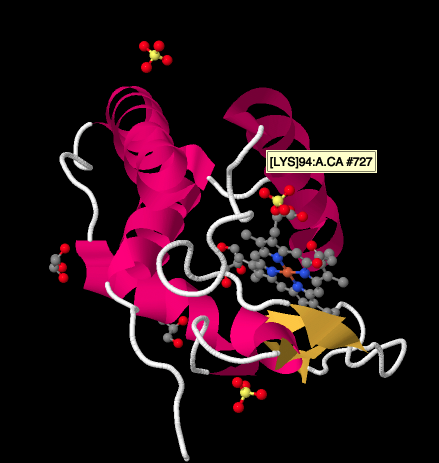
et nærmere kig på en Røntgenstruktur af en cyctochrom c nedenfor viser et relativt simpelt billede sammenlignet med de komplekser, vi har set på. Der er et par helices, et par ark, nogle sløjfer, og det jernporfyrin eller hæm igen. Et par sulfationer flyder rundt i nærheden såvel som et par glycerolmolekyler, sandsynligvis introduceret under oprensning eller krystallisering af proteinet. Bemærk, at hæmen findes ved kanten af proteinet. Denne placering kan gøre det lettere for elektronoverførsel fra Kompleks III eller til kompleks IV.
- cytochrom c er den endelige destination for elektroner, der bevæger sig gennem kompleks III.
- cytochrom c er en mobil, en-elektronbærer.
- cytochrom c er faktisk et lille, hydrofilt protein.
- cytochrom c findes over mitokondriemembranen ved kanten af intermembranrummet.
hvad holder cyctochrome c fra at vandre ud i intermembranrummet? Hvis det gjorde det, ville det afbryde den effektive strøm af elektroner. Det er muligt, at cytochrom c bevæger sig frem og tilbage mellem kompleks III og kompleks IV via en mekanisme kaldet “styring”. Ved styring styres bæreren langs en vej via komplementære ladninger. For eksempel, hvis membranen er negativt ladet på grund af polære grupper på membranoverfladen, kan positive ladninger på overfladen af cytokrom c begrænse dens bevægelse til membranoverfladen. Det alene ville reducere dets mobilitet fra tre dimensioner (hvor som helst i intermembranrummet) til to dimensioner (hvor som helst på membranoverfladen). Det er muligt, at yderligere interaktioner reducerer dens mobilitet endnu længere til et endimensionelt spor mellem de to komplekser.
- styring, baseret på komplementære ladninger, forhindrer cytokrom c i at gå tabt i intermembranrummet.
øvelse \(\Sideindeks{1}\)
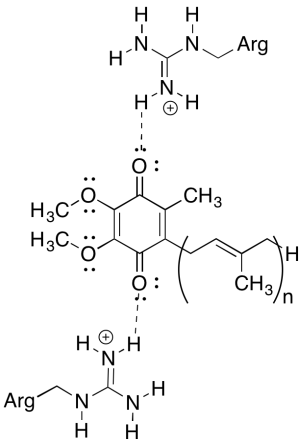
foreslå mulige aminosyrerester på overfladen af cytochrom c, der kan hjælpe det med at forblive på en negativt ladet membranoverflade.
svar
arginin og lysin er positivt ladet ved neutral pH.
øvelse \(\Sideindeks{2}\)
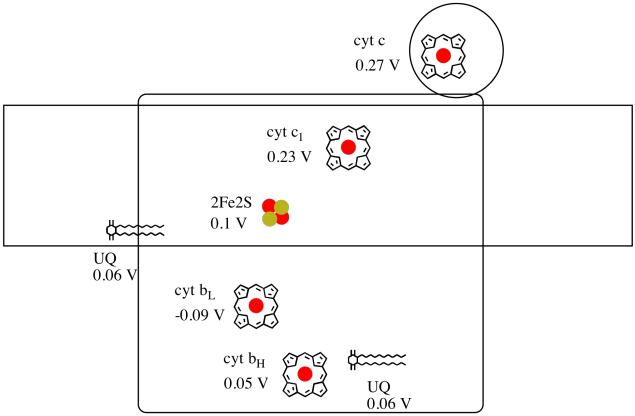
det er svært at måle reduktionspotentialet for et individuelt sted inden for et protein. Forskere har imidlertid været i stand til at estimere disse værdier ved at måle EPR-spektre under forskellige forhold. Under forudsætning af reduktionspotentialerne nedenfor, tegne et reaktionsfremgangsdiagram til transport af en elektron helt fra den indledende allestedsnærværende donor hele vejen til cytochrom c.
 svar
svar
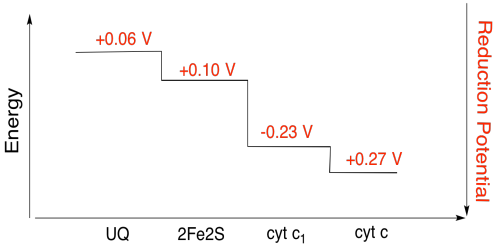
øvelse \(\Sideindeks{3}\)
brug værdierne i figuren ovenfor til at beregne energiændringen, når en elektron overføres fra 2fe2s-klyngen til cytokrom C1.
Svar
Antages reduktionen potentialer er:
2Fe2S(ox) + e- → 2Fe2S(red) Eored = 0.10 V
cyt c1(ox) + e- → cyt c1(red) Eored = 0.230 V
Så er den potentielle forskel for den reaktion, ΔEo = 0.23 – (0.10) V = 0.13 V.
Faraday forhold ΔG = – n F ΔEo giver
ΔG = – 1 x 96,485 J V-1 mol-1 x 0.13 V = 12,543 J mol-1 = 12.5 kJ mol-1
øvelse \(\Sideindeks{4}\)
en af de forvirrende ting ved dette kompleks er det, i elektrongenvindingssløjfen, elektronoverførsel ser ud til at gå fra en indledende allestedsnærværende til en endelig allestedsnærværende, uden nogen samlet drivkraft. Reduktionspotentialer er dog meget følsomme over for miljøet. Vis, hvordan nærliggende argininrester kan gøre reduktionspotentialet for en allestedsnærværende mere positiv.
svar
de positive argininrester ville give delvis positiv ladning på allestedsnærværende via hydrogenbinding; den allestedsnærværende ville have et mere positivt reduktionspotentiale som et resultat.
se fokussiden på strukturen af kompleks III på Biochemistry online.
Røntgenkrystalstruktur af kompleks III fra: Gao, H., ven, H., Esser, L., Kvinn, B., Yu, L., Yu, C.-A., Hia, D. strukturelt grundlag for kinonreduktionen i bc1-komplekset: en sammenlignende analyse af krystalstrukturer af mitokondrie cytochrom bc1 med bundet substrat og inhibitorer på Chi-stedet. Biokemi 2003, 4, 9067-9080. (1NTS)
RØNTGENKRYSTALLSTRUKTUR af kompleks III med bundet cytokrom c fra: Solmas, S. R., Hunte, C. struktur af kompleks III med bundet cytokrom c i reduceret tilstand og definition af en minimal kernegrænseflade til elektronoverførsel. J. Biol. Chem. 2008, 283, 17542-17549. (3CH)
RØNTGENKRYSTALSTRUKTUR af cytokrom c fra: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. A. strukturelle beviser for en protonoverførselsvej kombineret med hæmreduktion af cytokrom c” fra Methylophilus methylotrophus. J. Biol. Inorg. Chem. 2006 11, 189. (1OAE)
tilskrivning
Chris P Schaller, Ph. D., (College of Saint Benedict / Saint John ‘ s University)