7.5: kompleks IV
kompleks IV er den endelige destination i elektrontransportkæden. Her leveres elektronerne, der har rejst gennem de andre medlemmer af respiratorisk superkompleks, endelig til O2, hvilket reducerer det til vand. Det er en imponerende bedrift, fordi der skal dannes et antal reaktive iltarter mellem den første tilsætning af en elektron og den endelige frigivelse af vand, men reaktionen styres på en sådan måde, at muligheden for celleskader minimeres. Samtidig pumpes flere protoner over den indre mitokondriemembran.
- i kompleks IV leveres elektroner til deres endelige destination, et molekyle af O2.
- O2 reduceres til vand.
øvelse \(\Sideindeks{1}\)
Skriv en afbalanceret redoks halvreaktion for at vise, hvor mange elektroner der er nødvendige for at reducere et iltmolekyle til vand.
svar
O2 liter H2O
O2 liter 2 H2O (o afbalanceret)
O2+ 4 timer + liter 2 H2O (H afbalanceret)
O2 + 4e – + 4 timer + liter 2 H2O (ladningsbalanceret))
Røntgenstrukturen af kompleks IV er vist nedenfor. Igen er matricen i den nederste ende af billedet, og intermembranrummet er øverst. Det er her cytochrome c dokker, øverst.
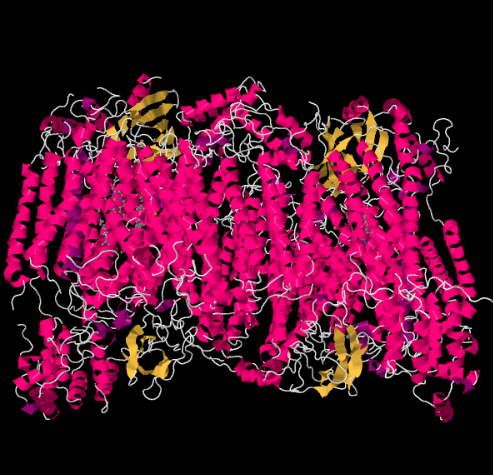
den mobile elektronbærer, cytochrom c, binder ved kompleks IV og leverer en elektron til et binukleært kobbersted kaldet CuA. Vi kan se det binukleære kobbersted, når vi ser inde i proteinet nedenfor. Det er bundet bare til proteinet og intet andet, så vi ser bare de to kobberioner alene øverst på billedet. Dette par kobberatomer sender elektronen videre til en hæm, cytochrom A, som du kan se nedenfor og til venstre. Derfra fortsætter elektronen til en anden binuklear klynge, denne gang bestående af et hæmbundet jern (cytochrom a3) og et nærliggende kobber (CuB). Dette binukleære sted udfører reduktionen af diilt til vand. I strukturen er der et kuliltemolekyle bundet på det aktive sted mellem cytochrom A3 og CuB. Carbonatomerne er fastgjort til jernet, og iltet er fastgjort til kobberet. Det er her iltmolekylet ville binde og vente på at blive reduceret til vand.
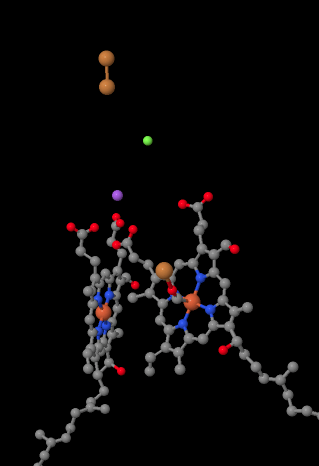
hvis du tænker over det, betyder det, at elektroner bevæger sig i den modsatte retning fra det, vi så i de første tre komplekser. I komplekser I og II blev elektroner leveret fra mitokondriematricen og rejste op mod intermembranrummet og stoppede ved en allestedsnærværende i mitokondriemembranen. I kompleks III fortsatte elektroner i den” opadgående ” retning fra mitokondriemembranen til cytokrom c i intermembranrummet. I kompleks IV, elektroner vender kurs, rejser tilbage mod mitokondrie matricen. Husk, at mitokondriematricen er n-doteret på grund af protonpumpning, så disse elektroner bevæger sig fra den positive side af membranen til den negative side. Det må være svært.
- i kompleks IV er elektrontransport i modsat retning fra de andre komplekser.
- elektroner bevæger sig fra den intermembrane rumside til den mitokondrielle matriceside mod ladningsgradienten.
lad os tage endnu et kig på de vigtige ligander for komplekset. En tegneserie er vist nedenfor. I tegneserien vises O2-molekylet bindende i den position mellem hæm a3 og Ungen. Det dinukleære metalsted er, hvor iltmolekylet reduceres til vand.
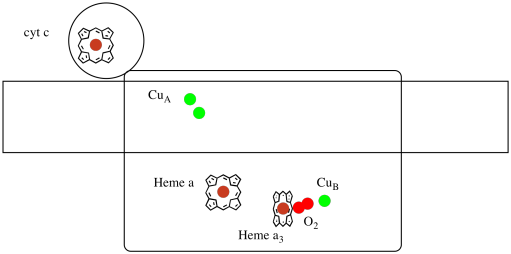
fordi fire elektroner er nødvendige for at reducere O2 til H2O, skal fire cytokrom C-molekyler binde ved kompleks IV, før denne reduktion kan fortsætte. Det er sandsynligt, at koordinationsmiljøet af iltmolekylet-mellem to metaller, snarere end blot bundet til en-gør det muligt at blive hurtigere reduceret helt til vand i stedet for at danne reaktive iltarter, der vedvarer i cellen, såsom peroksider.
øvelse \(\Sideindeks{2}\)
Antag, at jernet i hæm A3 starter i en reduceret Fe(II) tilstand, og Ungen starter i en reduceret Cu (I) tilstand. Giv en mekanisme til reduktion af ilt til vand med tilsætning af fire elektroner og fire protoner. Brug Fe (II) som elektrondonor og lysin som protondonor.
svar
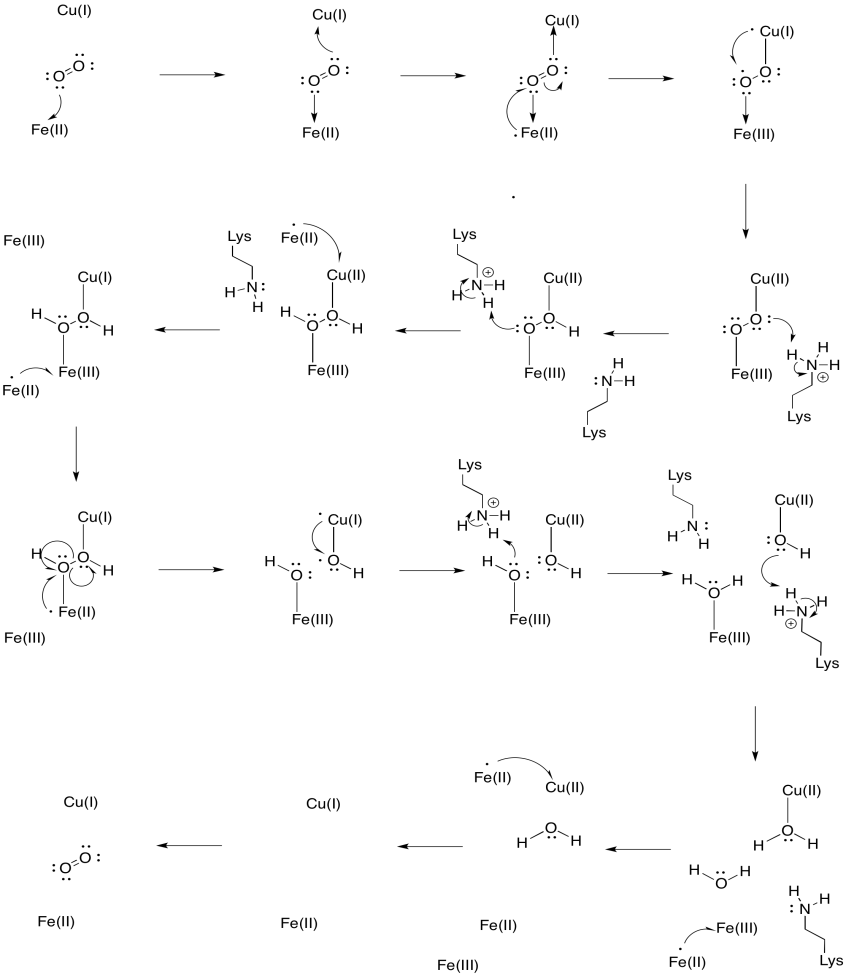
ud over disse to metaller er der også et modificeret histidin-tyrosinkonjugat bundet til CuB. Det er blevet foreslået, at denne tyrosin giver en anden kilde til øjeblikkelige elektroner, der kan anvendes til reduktion.
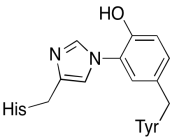
øvelse \(\Sideindeks{3}\)
vis hvorfor en tyrosin kan være en kilde til både en proton og en elektron i biokemiske processer.
svar
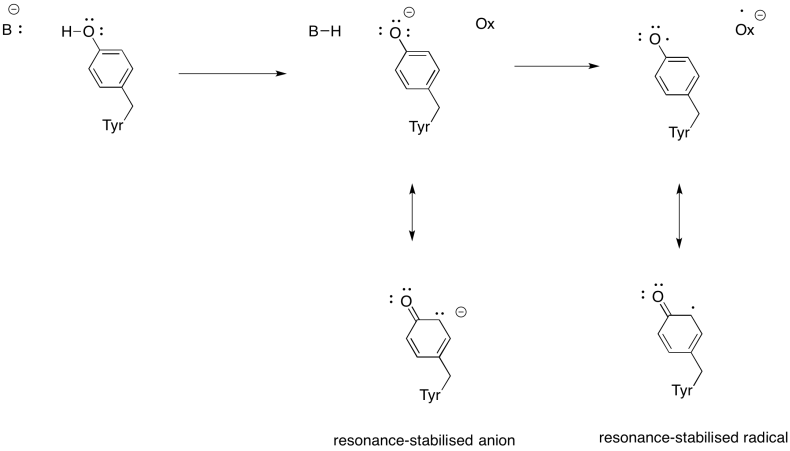
ud over behovet for at reducere ilt til vand bidrager kompleks IV også til protongradienten og pumper yderligere protoner over mitokondriemembranen. Denne opgave giver yderligere udfordringer. En simpel koblingsmekanisme er ikke mulig, fordi elektronerne bevæger sig i modsat retning. Det er dog, at mekanismen involverer konformationsændringer i proteinet, der opstår, når metallerne ændrer iltningstilstande. Subtile ændringer i koordinationsmiljøet kan resultere i forskydning af aminosyrerester i nærheden. Det er let at forestille sig, at hvis en bestemt aminosyre skifter opad mod intermembranrummet, kan den trække en proton med den.
- Protonpumpning og elektrontransport kører i modsatte retninger i kompleks IV og skal afkobles.
- Protonpumpning i kompleks IV skal stole på konformationsændringer.
øvelse \(\Sideindeks{4}\)
Cua-stedet indeholder to kobber, bound af to brodannende cysteiner. Begge er bundet af terminale histidiner. Derudover er et kobber bundet af en yderligere methionin, mens den anden er bundet af en carbonyl fra proteinrygraden.
- tegn kobberne på deres bindingssteder.
- beskriv geometrien for hvert kobber.
- hvis hvert kobber er Cu(I), hvad er det koordinerede elektronantal på hvert kobber i komplekset?
- hvis hvert kobber er Cu(I), hvad er den samlede ladning på komplekset?
svar A)
a)
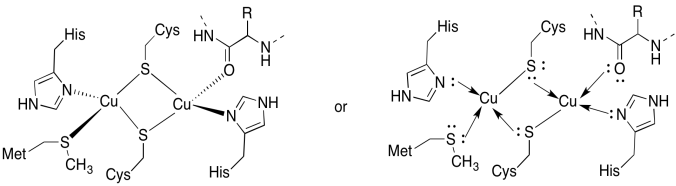
svar B)
b) tetrahedral
svar c)
c) Cu(I) = d10
4 donorer = 8 e-
total = 18E –
svar D)
d) 2 cu(I) = 2+
2 Cys-S- = 2-
alle andre neutrale
i alt = 0
øvelse \(\Sideindeks{5}\)
kobberet på Ungstedet er bundet af to histidiner og histidin-tyrosinkonjugatet.
- træk Kobberet i bindingsstedet.
- beskriv kobberets geometri.
- hvis kobber er Cu(I), hvad er det koordinerede elektronantal i komplekset?
- hvis kobber er Cu(I), hvad er den samlede ladning på komplekset?
svar A)
a)
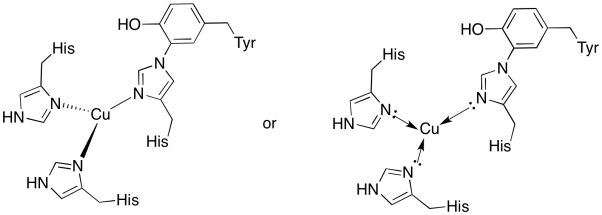
svar b)
b) trigonal plan
svar c)
c) Cu(I) = d10
3 donorer = 6 e-
total = 16 e-
svar D)
d) cu(I) = 1+
histidiner neutral
i alt = 1+
øvelse \(\Sideindeks{6}\)
det er svært at måle reduktionspotentialet for et individuelt sted inden for et protein. Forskere har imidlertid været i stand til at estimere disse værdier ved at måle EPR-spektre under forskellige forhold. Under forudsætning af reduktionspotentialerne nedenfor tegner du et reaktionsfremgangsdiagram til transport af en elektron helt fra cytokrom c til molekylært ilt.
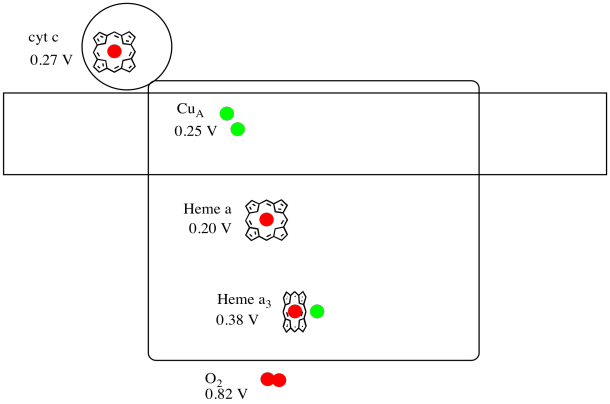 svar
svar
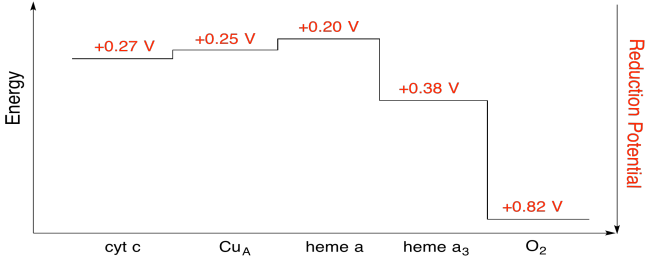
øvelse \(\Sideindeks{7}\)
brug værdierne i figuren ovenfor til at beregne energiændringen, når en elektron overføres fra hæm A til hæm A3.
svar
under forudsætning af reduktionspotentialerne er:
heme a(okse) + e – Kur heme a(rød) Eored = 0.20 V
heme a3(okse) + e – Kur heme a3(rød) Eored = 0.38 V
derefter giver den potentielle forskel for reaktionen, Kriseo = 0,38 – (0,20) V = 0,18 V.
Faraday – forholdet KRISG = – n f Kriseo
KRISG = -1 * 96.485 J V-1 mol-1 * 0,13 V = 17.367 J mol-1 = 17,4 kJ mol-1
tilskrivning
Chris P Schaller, Ph. D., (College of Saint Benedict / Saint John ‘ s University)