beslægtet antigenengagement på parenkymceller stimulerer CD8+ T-celleproliferation in situ
- beslægtet CD8+ T-celler findes i LN og betændt væv
- CD8 + T-celler ekspanderer på inflammationsstedet
- beslægtet interaktion med holme fremmer ekspansion
- beslægtet interaktion med residente leukocytter er ikke påkrævet
- beslægtet interaktion med parenkymale celler er vigtig
- T-celler prolifererer på stedet for betændelse
- beslægtet interaktion med parenchymale celler driver proliferation
- IL – 2 er vigtigere på stedet for betændelse
beslægtet CD8+ T-celler findes i LN og betændt væv
i indledende eksperimenter (Fig. 1) vi etablerede en model, hvor CD8 T-celleresponser på et parenkymalt antigen, ovalbumin (OVA), kunne analyseres. Ot-i-mus udtrykker en transgen TCR, der medierer CD8+ T-cellegenkendelse af OVA257-264 peptid præsenteret på MHC klasse i-molekylet H-2kb. CD8 T-celler blev beriget fra ot-i / CD45.1-mus, CFSE-farvestofmærket og adoptivt overført af i.V. til B6 (CD45.2+) værtsmus. Adoptivt overførte T-celler kunne skelnes fra værtsceller ved CD45.1-farvning (såvel som CD8 og Va2-kæden i OT-i TCR), mens CFSE-farvestoffortynding blev anvendt til at identificere celler, der havde spredt sig (for eksempel Fig. 1a, supplerende Fig. 1). Parenkymalt antigen blev introduceret ved podning B6.- holme (sådanne holme udtrykker æg i parenchymale-celler under rotteinsulinpromotoren, supplerende tabel 1) under nyrekapslen hos værtsmus, der allerede havde modtaget ot-i/CD45.1 T-celler. Alle tre kilder (vært, T-celle donor og Holm donor) har en B6 baggrund og dermed udtrykke H-2kb. Således, selvom OVA-antigenekspression var begrænset til podede kar-celler,antog vi, at præsentation af kar-celleafledt æg ved ikke-parenkymal APC, såsom DC via krydspræsentation, ville være påkrævet til Ln-priming og måske lokale t-celleresponser17, 18.

opdelte ot-i-celler (levedygtige CD45.1+CD8+Va2+ gate) ved dræning af renal LN og graft 3 eller 6 dage efter modtagelse af et enkelt transplantat på 400 B6.Krotova holme. a) repræsentative strømningscytometri-plots. Placeringen af den udelte ot-i-top blev bestemt under anvendelse af ‘intet antigen’ – kontrol af et B6-holmtransplantat. B) Samlet antal opdelt OT-i i renal LN og graft, hvor hvert punkt repræsenterer en individuel mus. Samlede data fra syv uafhængige eksperimenter: N=8 transplantatmodtagere på dag 3 og N=14 transplantatmodtagere på dag 6. En dag gik 6 graft tabt på grund af en strømningscytometerfejl. Vandrette stænger er midler, p-værdier blev beregnet ved uparret, to-tailed t-test med Vechs korrektion.
CD8 + T-celler ekspanderer på inflammationsstedet
som forventet blev der først påvist et potent ot-i-respons i det renale LN, der dræner transplantatstedet, og dette var afhængigt af tilstedeværelsen af OVA-antigen (Fig. 1a, b). 3 dage efter transplantatet kunne delt ot-i detekteres i LNs, der dræner B6.korpsø-transplantater (Fig. 1a) og var rigelige (Fig. 1B, gennemsnit=9,2 til 104). I modsætning hertil kunne 100 gange færre opdelte ot-i-celler detekteres inden for B6.graftene af karruseller (Fig. 1a, b, gennemsnit=6,6 gir 102). Antallet af opdelte ot-i-celler steg 300 gange på graftstedet fra dag 3 til dag 6 (Fig. 1B, gennemsnit=6,6 liter 102 på dag 3 til 2,1 liter 105 på dag 6, P<0,0001, uparret to-tailed t-test med Vechs korrektion), mens der ikke var nogen stigning i LN (Fig. 1b). OT-i-svaret i B6.Krotova-transplantater kunne forklares ved infiltration af OT-i-celler, der havde spredt sig i LN. CFSE-profiler var imidlertid forskellige mellem transplantat-og LN-stederne, da OT-i-celler i transplantater var mere stærkt opdelt end dem i LN på dag 6 (Fig. 1a). Der er mindst to mulige forklaringer på denne forskel. Kun celler, der havde delt sig mange gange, infiltrerede transplantatet. Alternativt cellerne, der når graften hurtigere opdelt, muligvis på grund af overflod af tilgængeligt antigen. Stigningen i absolutte celletal i transplantatet sammenlignet med LN på dag 6 førte os til at undersøge denne sidstnævnte forklaring.
beslægtet interaktion med holme fremmer ekspansion
for at bestemme det mulige bidrag fra beslægtet MHC i transplantatet til lokal ekspansion brugte vi holme afledt af bm1.musene i Kvik (supplerende tabel 1). I bm1.h–2kbm1-molekylet er ude af stand til at præsentere OVA257-264-peptidet på grund af tre mutationer til H-2kb (ref. 19). En sammenligning af svar på B6.BM1 og BM1.på trods af lignende ot-i-reaktioner i den drænende nyre LN blev udvidelsen af OT-i reduceret seks gange i bm1.i forhold til B6.Krotova-transplantater (gennemsnit=4.7, 104, sammenlignet med 2, 6, 105, delt ot-I; P=0, 0153, uparret, to-tailed t-test med Vechs korrektion; Fig. 2a). Denne mindre effektive udvidelse af OT-i-celler, der infiltrerer bm1.krisova-transplantater foreslog, at beslægtede interaktioner med podede øceller bidrog til lokal t-celleudvidelse.

Strømningscytometrianalyse af OT-i-celler (levedygtig CD45.1+CD8+Va2+ gate) 6 dage efter transplantat. a) samlet opdelt OT-i i det drænende renale LN og transplantat efter modtagelse af et enkelt transplantat på 400 B6.larvova eller bm1.Krotova holme. Data for B6.de podede mus er en delmængde af dem, der er vist i Fig. 1b. hvert punkt repræsenterer en individuel mus. Samlede data fra to uafhængige eksperimenter vises i hvert panel: n=5 modtagere af B6.n=6 modtagere af bm1.Krotova-transplantater. Vandrette stænger er midler, p-værdier blev beregnet ved uparret, to-tailed t-test med Vechs korrektion. (B) skematisk af bipolar transplantatmodel, hvor transplantater på 200 holme er placeret ved modsatte poler af den samme nyre og deler en fælles drænet nyre LN. Samlet opdelt OT-I i (c) B6.Kristian og KbKO.bipolære transplantater og (d) B6.kristova og B6 bipolære transplantater (n=5 modtagermus samlet fra to uafhængige eksperimenter i hver af c og d) Data for den samme mus er forbundet med stiplede linjer: P-værdier blev beregnet ved forhold parret t-test.
for at eliminere ethvert bidrag fra H-2kbm1 alloantigen genererede vi kbko.der udtrykker ÆGANTIGEN i ø-beta-celler, men mangler alloantigen eller H-2kb (supplerende tabel 1). Vi brugte derefter en ‘bipolar transplantatmodel’ til at sammenligne svar på B6.Kristian og KbKO.i en B6-værtsmus, således at graftinfiltrerende T-celler blev afledt af T-celler primet i samme LN (Fig. 2b). Der var 10-100 gange flere T-celler til stede i B6.kbko.graftene af karruseller (Fig. 2c). Ved hjælp af forholdet mellem delt ot-i ved modsatte poler af nyren beregnet for individuelle mus afledte vi et relativt responsforhold (RRR). RRR indikerede, at lokal t-celleudvidelse var 26 gange større, når beslægtet engagement med graftceller forekom (RRR=26,4-tion 14,1 i B6.kbko.Krotova-transplantater, P=0,0025, forholdet parret t-test, Fig. 2c).
vi sammenlignede også svarene på bipolar B6.transplantater af karrosseri og B6 (ingen antigen) (Fig. 2d). Meget få OT – I kunne detekteres inden for B6-transplantater (Fig. 2d) og vi anser det for sandsynligt, at mange af disse cirkulerede OT-i stammer fra blodforurening. Således fører ikke-specifik inflammation forbundet med transplantation af transplantater, der mangler antigen, ikke til effektiv t-celleudvidelse i det betændte væv. I modsætning hertil svaret på B6.Krotova-transplantater var igen meget potente og mere end 900 gange større end B6-transplantaterne (RRR=950 liter 252 for B6.pristova: B6-transplantater, P< 0,0001, forholdet parret t-test, Fig. 2d).
tilsammen viste disse eksperimenter, at CD8 T-celleudvidelse inden for det betændte målvæv blev signifikant fremmet ved lokal antigenpræsentation. Dette udelukker ikke nødvendigvis andre bidrag til T-celleudvidelse, for eksempel ved krydspræsenterende vært DC i transplantatet. Vi kun aver der kognate interaktion mellem T-celler og ø-celler resulterer i betydelig T-celle ekspansion.
beslægtet interaktion med residente leukocytter er ikke påkrævet
holme er komplekse klynger af celler, der inkluderer LARP-celler, endotelceller og holme-residente leukocytter (IRL). Derfor forsøgte vi næste gang at afklare, hvilke øceller der præsenterede antigen til infiltrerende T-celler for at drive t-celleudvidelse. Den mest oplagte kandidat ville være IRL. Disse CD45 + celler er forskelligt blevet defineret som DC eller makrofager, co-Ekspres CD11c og F4/80, og har vist sig at behandle og præsentere antigens20,21,22,23. Vi undersøgte derfor donor IRL ‘ s rolle i at drive lokal CD8 T-celleudvidelse. B6.ropova mus blev krydset til CD11c.DTR.GFP-mus for at opnå CD11c.DTR.GFP.- mus, hvis celler udtrykker æg, og hvis CD11c+ – celler kunne ablateres ved difteritoksin (dt) injektion8. Vi testede først af FACS, at holme isoleret fra CD11c.DTR.GFP-mus behandlet med DT blev udtømt af CD11c+ celler (Fig. 3a, b). CD11c + IRL i ubehandlede kontrolmus blev identificeret ved farvning for CD45 og CD11c såvel som deres ekspression af GFP-reporteren og blev tydeligt udtømt ved dt-behandling (Fig. 3a, b, P=0,0002, uparret to-tailed t-test med Vechs korrektion). Vi bekræftede også, at CD11c+IRL Co-udtrykt F4/80 og H-2 Kb MHC klasse i (supplerende Fig. 2A) og følgelig F4/80+ celler blev også udtømt fra øerne af DT-behandlede mus (supplerende Fig. 2b). CD11c.DTR.GFP.holme, der blev isoleret fra ubehandlede og DT-behandlede mus, blev podet ved modsatte poler af den samme nyre. Delt ot-i-nummer var ens mellem transplantaterne, hvilket indikerer, at IRL-udtømning ikke havde nogen effekt på CD8+ T-celleudvidelse på graftstedet (Fig. 3c). For at bekræfte, at IRL ikke var vigtig for lokal CD8 T-celleudvidelse, udførte vi et andet sæt eksperimenter. KbKO.de blev bestrålet og rekonstitueret med enten kbko eller B6 knoglemarv (BM) for at generere en kilde til holme, hvor h-2kb-ekspression var fraværende fra alle celler eller selektivt gendannet til IRL (Fig. 3d). Sammenligning af sådanne holme i den bipolære graftmodel viste lignende niveauer af OT-i-celleudvidelse i begge transplantater (Fig. 3e). Derfor er IRL ikke vigtige drivkræfter for lokal CD8 T-celleudvidelse.

Strømningscytometrianalyse, der viser udtømning af CD11c+ IRL i CD11c.DTR.GFP-mus behandlet med DT: (a) repræsentative plots, der viser gating af CD11c+IRL i Holme fra ubehandlede kontrolmus og deres udtømning dagen efter en enkelt dt-behandling, og (b) optælling af CD11c+IRL i ubehandlede og DT-behandlede mus. Hvert punkt repræsenterer et individuelt holmpræparat indeholdende puljede holme fra 1 til 8 mus, n=5 ubehandlede holmpræparater og 6 dt-behandlede holmpræparater samlet fra fire uafhængige eksperimenter. P-værdi beregnet ved uparret, to-tailed t-test med Vechs korrektion. c) samlet opdelt OT-i 6 dage efter bipolar graft af Holme opnået fra CD11c.DTR.GFP.der blev ubehandlet eller behandlet med DT (N=6 modtagermus samlet fra to uafhængige eksperimenter). Data for den samme mus er forbundet med stiplede linjer; P-værdier beregnet efter forholdet parret t-test. D) repræsentative plots, der viser fravær eller tilstedeværelse af H-2kb-ekspression på CD11c+IRL af kbko-mus rekonstitueret med henholdsvis kbko eller B6 BM. Pregeret på levedygtige celler. (e) samlet opdelt OT-i 6 dage efter bipolar graft af Holme opnået fra kimærmus (n=3 modtagermus fra et enkelt eksperiment). Data for den samme mus er forbundet med stiplede linjer; P værdier beregnet ved forholdet parret t-test.
beslægtet interaktion med parenkymale celler er vigtig
B6.RIP-Kb-mus udtrykker transgenisk H-2kb i kur-celler under kontrol af rotteinsulinpromoter24. Ved at krydse disse mus til KbKO.vi genererede kbko.- Kristian.- mus, hvor h-2kb-ekspression var begrænset til-celler (supplerende tabel 1). Ekspression af H-2kb på kur-celler blev bekræftet ved FACS-analyse af Holme (Fig. 4a). Vi gated på holme hæmatopoietiske celler (CD45+) og endotelceller (CD31+) og viste, at H-2kb ikke blev udtrykt på disse celler i enten KbKO.kbko eller kbko.- Kristian.kurtkb-mus sammenlignet med stærkt udtryk i B6-mus (Fig. 4a). De resterende CD45-CD31-celler er autofluorescerende positive og beriget i endokrine celler. FACS analyse af holme fra KbKO.- Kristian.musene viste h-2kb-ekspression inden for den autofluorescerende population, der berigede celler, på niveauer svarende til dem, der ses på B6-holme (Fig. 4a). Sammenligning i den bipolære graftmodel indikerede, at ekspansion af OT-i var 14 gange større, når kognatantigen blev udtrykt på CRP-celler (RRR=14,0 CRP 4,1 for kbko.- Kristian.kbko.Krotova-transplantater, P=0,0008, forholdet parret t-test, Fig. 4b).

(a) Strømningscytometri-plots (gated på levedygtige celler), der viser selektiv restaurering af H-2kb-ekspression på parenchymale celler. Histogrammer repræsenterer holme fra KbKO (skraveret), B6 (stiplet) eller KbKO.prirkb (fed) mus. (B) samlet opdelt OT-i 6 dage efter bipolar graft af KbKO.Kristian og KbKO. – Kristian.løjtnant. øer (N=6 modtagermus samlet fra tre uafhængige eksperimenter). Data for den samme mus er forbundet med stiplede linjer; P-værdier beregnet efter forholdet parret t-test.
T-celler prolifererer på stedet for betændelse
vores ovennævnte fund indikerer, at der var lokal proliferation på målstedet. For at detektere aktivt prolifererende celler krydsede vi ot-i/CD45.1 mus til Fucirg mus for at generere Fucirg/OT-i / CD45.1 mus (forkortet Fuciot-I). I sådanne mus fluorescerer celler rødt (FucciR) under G0/G1 og grønt (FucciG) under s/G2/M cellecyklusfaser25,26. Den gradvise nedbrydning og ophobning af FucciR−og FucciG− journalister under overgangen mellem cyklusfaser muliggør yderligere sondringer: mere intens FucciR-ekspression i hvilende G0 versus cykling G1-celler, dobbelt negative FucciR-G-celler i meget tidlig G1 og svagt dobbelt positive FucciR+G+ – celler i G1/s (refs 26, 27). Hvilende FucciOT-i-celler fra ikke-podede mus var FucciG – (Fig. 5a, øverste panel, ikke podet). For at undgå interferens med Fucci-farvestofferne erstattede vi CFSE med CTV. Hos mus, der havde modtaget B6.en analyse af CTV-fortynding viste, at delt Fuciot-i var til stede i den drænende nyre LN, og nogle af disse var FucciG+, der tyder på aktiv celledeling (Fig. 5a, øverste panel, dræning LN). På graftstedet opdagede vi FucciOT-i, der havde gennemgået mange divisioner (CTV ikke længere detekterbar), og mange af disse var FucciG+ understøttende for løbende spredning (Fig. 5a, øverste panel, frisk graft). Sammenligning af andelen af FucciG + celler inden for den opdelte ot-i-population (Fig. 5c) indikerede, at den igangværende proliferation inden for friske transplantater (26,8 g 8,8% FucciG+) oversteg den i enten den drænende renale LN (7,3 g 1,6%, P=0,008, uparret to-tailed t-test med Vechs korrektion) eller ikke-drænende renal LN (2,1 g 2,1%, P=0,003, uparret to-tailed t-test med Vechs korrektion). Faktisk viste undersøgelse af både FucciG og FucciR-ekspression, at de fleste graftinfiltrerende ot-i aktivt delte sig, det vil sige meget få celler udviste høj ekspression af FucciR, der var karakteristisk for hvilende celler i LN af ugraftede mus (Fig. 5a, nederste paneler). Selvom vi antog, at denne spredning på stedet for betændelse blev genereret in situ, kunne vi ikke helt rabat muligheden for, at dette simpelthen afspejlede den nylige ankomst af prolifererende celler. For at afklare dette høstede vi de bipolære transplantater af B6.holme til at analysere det ene transplantat umiddelbart efter udskæring og kultur det andet transplantat i 1 dag (Fig. 5a). Mens antallet af OT – i ikke steg i løbet af kulturperioden (Fig. 5b), som formodentlig afspejler celledød under suboptimale eks-vivo-forhold, fortsatte mange FucciG+ OT-i-celler med at blive detekteret (14,2 til 4,2% FucciG+, Fig. 5c). Profilen af det dyrkede transplantat uden mulig rekruttering i en dag ville indikere, at der var høj de novo-spredning i transplantatet.

(a) skematiske og repræsentative strømningscytometri-plots (gated på levedygtige CD45.1+CD8+Va2+ lymfocytter), der viser respons fra FucciOT-i-celler i renal LNs eller bipolar B6.Krotova-transplantater. LNs og transplantatet fra en pol blev undersøgt straks (frisk 6 dage efter graft), mens transplantatet fra den modsatte pol blev dyrket i 1 dag før analyse. LN fra en ikke-podet mus blev inkluderet for at vise fravær af opdeling og FucciG-ekspression (øverste panel) og overvægt af FucciR-høje celler (nederste panel) i hvilende Fuccciot-I. (b) samlet opdelt Fuccciot-i i friske og dyrkede transplantater. Gennemsnit + s. d., n=5, p værdier beregnet ved to-tailed ratio parret t-test. c) % FucciG+ opdelt OT-i i friske ikke-drænende og graftdrænende renale LN samt friske og dyrkede transplantater. Gennemsnit + s. d., n=5 med undtagelse af ikke-drænet LN, for hvilket n=4 på grund af tab af en LN under behandlingen. P-værdier blev beregnet ved to-tailed uparret t-test med Vechs korrektion. Data samles fra to uafhængige eksperimenter.
beslægtet interaktion med parenchymale celler driver proliferation
vi udnyttede derefter Fuciot-i-modellen til at vurdere rollen som en anden potentiel lokal driver af T-celleproliferation i transplantatet, værtsafledt APC, såsom inflammatorisk DC. For at eliminere ethvert bidrag fra vært APC afledte vi først en KbKO-baggrund. Da KbKO-mus afviste ot-i-celler, oprettede vi KbKO BM til B6-kimæraer til brug som værter; således manglede de hæmatopoietiske celler H-2kb, men var tilladte for OT-i-celler. Disse kimærer fik FucciOT-i T-celler og bipolære transplantater af KbKO.holme (mangler h-2kb ekspression og dermed evnen til at præsentere OVA antigen) og KbKO.- Kristian.holme med lerkb (både H – 2kb og OVA-antigen var begrænset til lerks celler). Da chimaera manglede h-2kb positiv APC, var det nødvendigt at administrere OVA257-264 peptidbelagte miltceller for at initiere OT-i-responsen. Succes med denne priming blev vist ved CTV-fortynding i Fuccciot-i− celler i renal LN, skønt disse på høsttidspunktet var FucciG-og ikke syntes at være aktivt at dele sig (0,1 liter 0,0% FucciG+, Fig. 6a, d). Meget få ot-i infiltrerede KbKO.men blev klart udvidet inden for KbKO.- Kristian.krorkb transplantater (RRR på 61,4 til 26,6 til KbKO.- Kristian.kbko.Kristian, Fig. 6B, P=0,0008, to-tailed forhold parret t-test). Således, selv i fravær af beslægtet antigen på vært APC, var beslægtet antigen på parenchymale Lars-celler tilstrækkeligt til at drive CD8 T-celleudvidelse på graftstedet. De få FucciOT-i T-celler, der findes i KbKO.kritova-transplantater lignede dem i LN både med hensyn til deres ineffektive progression til den stærkt opdelte fraktion (Fig. 6a, c, 7,5 kr 0,9% stærkt opdelt i LN og 19,3 kr 3,3% stærkt opdelt i KbKO.og mangel på fuccig ekspression (Fig. 6a, d, 0,1 liter 0,0% i LN og 0,1 liter 0,1% i KbKO.tyder på, at lille ot-i-proliferation forekom på graftstedet i fravær af beslægtet antigen. I modsætning hertil ot-i inden KbKO.- Kristian.prirkb-transplantater var overvejende stærkt opdelte (92,3 liter 1,0%, Fig. 6a, c) og nogle af disse var FucciG+ og således aktivt prolifererende (Fig. 6a, d, 5.0 til 1.2% FucciG+). Derfor var kognat antigenpræsentation af Holme-parenchymale kurvceller i stand til at drive de novo-proliferation af Fuciot-i In situ.

FucciOT-i-respons på transplantater i KbKO BM i B6-værtsmus, hvor værtshematopoietiske celler mangler h-2kb-ekspression. Podede mus modtog peptidbelagte miltceller på podningsdagen for at indlede ot-i-priming. (a) repræsentative strømningscytometri-plots (gated på levedygtige CD45.1+CD8+Va2+ lymfocytter). Øverste panel viser manglende opdeling og fuccig udtryk i hvilende OT-i i Ln af en mus, der hverken blev podet eller primet. Lavere tre paneler viser reponses i en bipolar podet og primet mus: dræning renal LN, KbKO.Kristian og KbKO.- Kristian.- podninger. Opdelte celler i podede mus blev opdelt i to sektorer, hvor de stærkt opdelte celler faldt ind i sektoren, hvor CTV blev fortyndet ud over detektionsgrænsen. B) samlet opdelt Fuciot-I i KbKO.Kristian og KbKO.- Kristian.prirkb bipolære transplantater, P-værdier beregnet ved to-tailed ratio parret t-test. (C) % stærkt opdelt og (d) % FucciG+ OT-i i dræning af renal LN og transplantater af bipolære podede mus. P-værdier blev beregnet ved to-tailed parret t-test. Resultater for individuelle mus er forbundet med stiplede linjer, n=6 modtagermus samlet fra to uafhængige eksperimenter.
IL – 2 er vigtigere på stedet for betændelse
vi viser, at IL-2RA-ekspression var vigtigere for CD8+ T-celleproliferation og akkumulering inden for perifer parenchyma (holmtransplantater) sammenlignet med inden for stedet for priming ved dræning af LN (Fig. 7a). Ud over, vi analyserede svaret på et andet sted fjernt fra stedet for priming, det er, ikke-drænet LN. CTV-mærkede CD8+ T-celler fra OT-I. IL−2RAKO (IL-2RA-CD45.2+) og OT-i/Ly5.1 (IL-2RA+, CD45.1+CD45.2+) mus blev co-overført til B6.CD45.1 værtsmus (CD45.1+) Før du modtager et enkelt graft af B6.Krotova holme. De forskellige CD45-alleliske signaturer for hver af de overførte t-cellepopulationer (i kombination med farvning for CD8 og Va2) gjorde det muligt for os at kvantificere og sammenligne forholdet mellem delt vægt:IL-2rako OT-i (Fig. 7a, supplerende Fig. 3). IL – 2RA vægt klart udkonkurreret IL-2RA KO OT-i på transplantationsstedet sammenlignet med enten dræning (P=0,025, to-tailed parret t-test) eller ikke-dræning (P=0,044, to-tailed parret t-test) LN. Dette er i overensstemmelse med øget afhængighed af CD8+ T-celler på IL-2 på tidspunktet for sekundært møde med antigen på inflammationsstedet sammenlignet med under indledende priming i drænet LN.
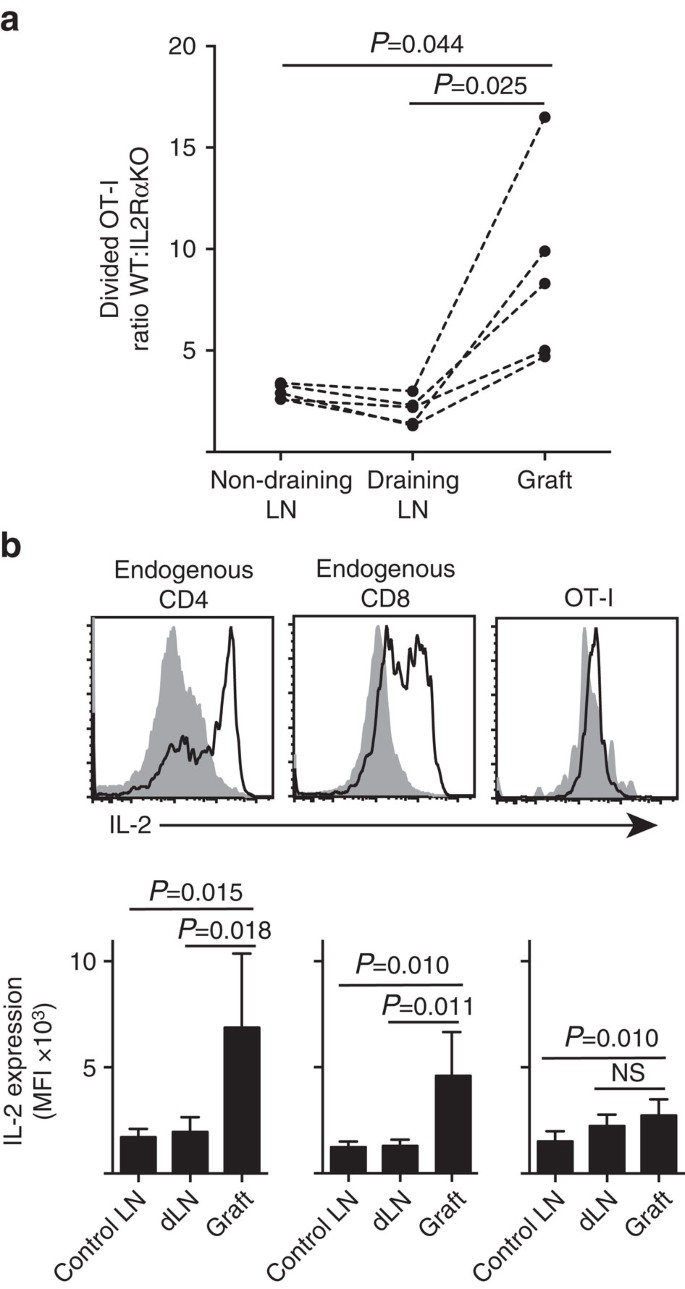
(a) forholdet mellem opdelt IL-2RA vægt: IL – 2RA KO OT-i-celler genvundet fra B6.efter co-overførsel (106 af hver) til B6.CD45.1 værtsmus. Forhold blev beregnet for individuelle organer med resultater for individuelle mus forbundet med stiplede linjer og sammenlignet med to-tailed parret t-test. Resultater vist for N=5 modtagermus og repræsentative for tre uafhængige eksperimenter. B) Il-2-ekspression i endogene CD4+ – og CD8+ – celler og overførte OT-i-celler i B6-modtagere af B6.Krotova islet grafts. Øvre paneler viser repræsentative strømningscytometri-plots til graftdræning af renal LN (fast grå) og graft (sort linje). Nedre paneler opsummerer gennemsnitlig fluorescerende intensitet (MFI) af IL-2-ekspression for renal LNs taget fra ugraftet (kontrol LN) såvel som graft og dræning renal LN (dLN) af podede mus. Resultater vist som middel + s. d., n=6 samlet fra to uafhængige eksperimenter og sammenlignet med to-tailed uparret t-test med Vechs korrektion.
den øgede afhængighed af IL-2 for CD8+ T-celleproliferation på inflammationsstedet udledte et krav til lokal IL-2-produktion. Derfor undersøgte vi potentialet for forskellige T-celler (endogene værtsafledte CD4+ og CD8+ samt overførte OT-i CD8+ T-celler) for kapaciteten til at producere IL-2 (Fig. 7b). Cellesuspensioner fremstillet ud fra transplantater eller LN blev kort (4 timer) restimuleret med PMA og ionomycin før farvning til ekspression af intracellulær IL-2. Undersøgelse af endogene værtsafledte CD4+-og CD8+ T-celler gav overbevisende bevis for IL-2-produktion på stedet for graftinflammation med en klar stigning i MFI af IL-2-farvning sammenlignet med enten dræning eller ikke-dræning LN. IL – 2-niveauer i ot-i CD8+ T-celler på inflammationsstedet blev moderat forøget i forhold til dem i den ikke-drænende LN, men adskiller sig ikke signifikant fra dem i dræningen LN. En fortolkning af disse data er, at beslægtet interaktion mellem OT-i og parenchymale celler inducerer hurtig proliferation, men dårlig IL-2-produktion, således at OT-i er afhængig af parakrin IL-2 afledt af endogene CD4+ og CD8+ T-celler i det lokale transplantatmiljø. Et yderligere eksperiment indikerede imidlertid, at eksogen IL-2 i fravær af parenkymalt antigen ikke kunne drive ot-i CD8+ celleudvidelse. IL – 2 (rekombinant hIL-2, 25.000 IE) blev administreret intraperitonealt til B6-mus, der modtog bipolære transplantater af B6.B6 holme og B6 holme. Sammenligning af OT-i-genvinding i organer, der blev genvundet fra IL – 2 eller vehikelbehandlede mus på dag 6 efter podning, viste ingen signifikant stigning i akkumulering af opdelte ot-i-celler på to steder, der mangler parenkymalt antigen, nemlig B6-øtransplantater (3-kar-3 i vehikel behandlet sammenlignet med 49-kar-64 i IL-2-behandlede mus, P=0.342) og ikke-drænende inguinal LN (1.648+633 i vehikel behandlet sammenlignet med 1.660 + 1.023 i IL-2 behandlede mus, P=0,987, middelkr.