Chloridionkanaler og transportører: fra naturens kuriositeter og kilde til menneskelig sygdom til lægemiddelmål
sendt: 20 August 2013 | |
tidligt i deres bacheloruddannelse introduceres den studerende til forskellige typer integreret membranprotein: receptorer, adhæsionsproteiner, ionkanaler, ionpumper og iontransportører. Når de skrider frem gennem deres studier, finder de ud af, at diskrete genfamilier og proteinstrukturer er ansvarlige for disse forskellige proteinklasser, og der er aldrig nogen grund til at overveje, at der kan være nogen tvetydighed ved at tildele et bestemt protein til dets passende proteinklasse.
dette opfylder stort set alle tilfælde fra klasseværelset til forskningslaboratoriet, indtil vi overvejer kloridkanaler. Vi ved, at de eksisterer, er vigtige og kan gøre gode lægemiddelmål på flere sygdomsområder, men indtil for nylig har de været noget stigmatiseret og umoderne i terapiens verden. Manglen på selektive ligander har slet ikke hjulpet. Den eneste undtagelse herfra har været GABA-en receptor, der er koblet til en iboende chloridkanal, der åbner ved binding af den hæmmende neurotransmitter GABA. Valium blev tilgængelig i 1960 ‘ erne, hvilket gav beroligende og antikonvulsive virkninger. Dette introducerer et vigtigt koncept: der er flere genfamilier og forskellige proteintyper, der kan beskrives som kloridkanaler.
dette er i modsætning til hvad vi forstår af kation-selektive ionkanaler, hvor der er ringe fleksibilitet i proteinstrukturen, der kan danne en pore, der er selektiv for kalium, natrium eller calcium; mangfoldigheden af disse ionkanaler er forårsaget af variationerne i proteindomænerne, der adskiller sig fra den pore, der påvirker åbnings-lukningsadfærden. For at være retfærdig synes der ikke at være mange fysiologiske grunde til, at en anionkanal skal udvise chlorid-selektivitet, da der er ringe fysiologisk rolle i membrantransporten af andre halogenider eller små anioner; enhver anionkanal vil som standard være en chloridkanal fra et fysiologisk synspunkt. På den anden side spiller kalium -, natrium-og calciummembranstrømme forskellige grundlæggende roller, og selektiv membranpermeabilitet for disse kationer er afgørende for cellulær funktion og faktisk selve livet.
GABA-A-receptorer er medlemmer af cys-loop pentameriske ligand-gated ionkanalfamilier, som inkluderer flere typer ophidsende og hæmmende neurotransmitter-gated kanaler. Det cystisk fibrose transmembran regulator (CFTR) protein er en nukleotidreguleret chloridkanal. Det er medlem af den forskellige ATP-bindende kassette (ABC) transportørfamilie og er den eneste, der ikke ser ud til at transportere noget substrat over en membran, men snarere fungerer som en kloridkanal. CLC-familien af spændingsstyrede chloridkanaler stammer fra en anden særskilt genfamilie og har en generel struktur unik blandt membranproteiner. Denne familie af proteiner har medført mange overraskelser i løbet af de sidste 30 år, og medlemmer af denne familie vil blive introduceret her, og også hvordan de kan betragtes som lægemiddelmål.
andre spændende udviklinger fra chloridkanalfeltet er opstået efter molekylær identifikation af proteiner underliggende calciumaktiverede chlorid (ClCa) kanaler. Funktionelt, vi har kendt til deres fysiologiske roller i nogen tid, men nylig molekylær identifikation af kanalproteinerne har gjort det muligt at udvikle molekylære og farmakologiske værktøjer til at undersøge og ændre deres aktivitet. Denne gennemgang fokuserer på det farmakologiske potentiale ved at målrette ClCa-kanaler og CLC-proteiner; deres funktion og subcellulære lokalisering er opsummeret i Figur 1.
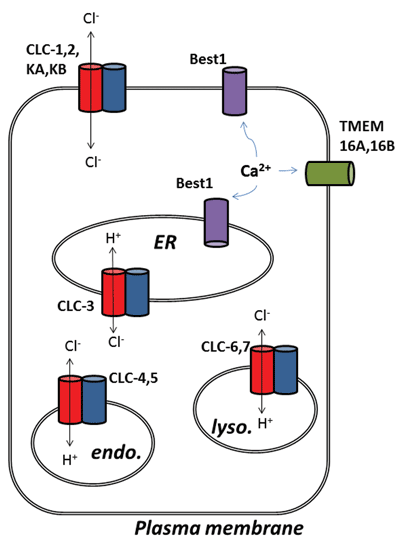
Figur 1
en introduktion til CLC-proteiner
de ni medlemmer af denne proteinfamilie er CLC-1 til 7, CLC-KA og KB. Stiftermedlemmet, CLC-1, er den spændingsstyrede chloridkanal i skeletmuskulatur og vil blive diskuteret nedenfor. Mange funktionelle undersøgelser er blevet udført på en homolog med æresbetegnelsen CLC-0, isoleret fra Elektroplakselelektrisk organ, som gør det muligt for strålen at bedøve sine akvatiske ofre. Rekonstitution af CLC – 0 i lipid-dobbeltlag og elektrofysiologisk registrering af strømme, der strømmer gennem enkelt ionkanaler, afslørede en spændende egenskab. Når man optager strøm fra en lille membranplaster indeholdende en enkelt ionkanal, observerer man normalt udsving mellem to strømamplituder: den ene repræsenterer den lukkede kanal og den anden repræsenterer strømmen, der strømmer gennem den åbne kanal. Udsvingene afspejler overgange mellem åbne og lukkede kinetiske tilstande. Med CLC-0 var det imidlertid tydeligt, at enkelt ionkanalproteinet bestod af to ækvivalente porer, der kunne åbne uafhængigt1. Denne kanal blev derfor beskrevet som værende dobbeltløbet (figur 2). Det kom således ikke til nogen stor overraskelse, at krystalstrukturerne af homologer fra enteriske bakterier afslørede, at proteinkomplekset var en dimer, hvor hver underenhed havde en ionledende sti2 (figur 2).
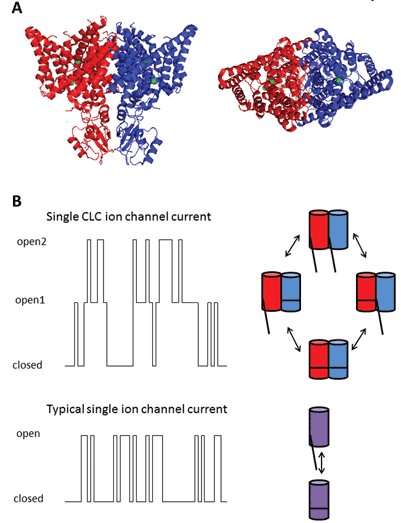
figur 2
den anden overraskelse opstod, da detaljerede funktionelle eksperimenter blev udført på CLC-ec1 fra E. coli. I stedet for at fungere som en kloridkanal, ligesom dens længe mistede slægtning i hvirveldyr skeletmuskulatur, er CLC-ec1 en 2CL-/H+ udvekslingstransportør eller antiporter med streng 2:1 udveksling støkiometry3. Dette protein er vigtigt for overlevelsen af enteriske bakterier i lav pH4 og vil sandsynligvis udnytte en chloridgradient for at holde cellulær pH på et acceptabelt niveau. Prokaryote CLC ‘ er kan derfor være mål for inhibitorer til behandling af patogen E. coli eller Salmonella infektion4. Opdagelsen af ionbytningsadfærd stimulerede naturligvis yderligere anstrengelser for at bestemme, om nogen af denne chlorid-for-proton–udveksling eksisterede i pattedyrs CLC ‘er, under antagelse af, at Cl – /H+ – udveksling kan være den sande funktion af arketypiske CLC’ er, og dem, der identificeres som chloridkanaler, kan bare være undtagelser fra reglen. Dette ser ud til at være tilfældet, da der er stærke beviser for, at CLC-3 igennem til CLC-7 fungerer som 2CL–/H+ udvekslingstransportører, primært bosiddende i intracellulære organeller, mens CLC-1, CLC-2, KA og KB er ægte plasmamembranchloridledende ionkanaler5-9. Fordi den arketypiske CLC-egenskab er udvekslingstransport, der findes på tværs af alle former for cellulært liv, kan den sidstnævnte underklasse af proteiner, bona fide chloridkanalerne, derfor betragtes som ‘ødelagte’ chloridtransportører, som har mistet koblingen af chloridtransport til bevægelsen af en anden substration.
CLC-1
denne grundlægger af CLC-familien er den spændingsstyrede chloridkanal i skeletmuskulaturen og tjener til at regulere membranpotentialet og repolarisere membranen efter handlingspotentialer for at slappe af muskelen. I de fleste væv ville vi forvente, at kaliumkanaler spiller denne rolle, som de gør i hjerte-og glat muskel, samt regulerer membranens ophidselse i andre celletyper. Det tværgående tubulesystem er en udvidelse til plasmamembranen (sarcolemma) og trænger ind i det kontraktile væv. Det er afgørende for den hurtige spredning af elektrisk aktivitet i hele musklen og orkestrerer hurtig og kontrolleret sammentrækning. Kaliumudstrømning fra muskelcellerne ind i det begrænsede rum i t-tubulen ville hæve den ekstracellulære kaliumkoncentration og kollapse denne iongradient, hvilket ville føre til langvarig membran depolarisering. Da kloridkanaler spiller den dominerende repolariserende rolle, forhindres dette. Tab af funktionsmutationer i CLC-1 fører til myotoni hos mennesker, geder og mus (for en nylig gennemgang SE10) og er kendetegnet ved nedsat muskelafslapning i overensstemmelse med tabet af en repolariserende membranstrøm.
med ekspression begrænset til skeletmuskulatur kan CLC-1 være et attraktivt mål for lægemidler, der styrer muskelkontraktion ved at øge eller formindske CLC-1-funktionen og derved reducere eller øge muskelopspændingen henholdsvis. Forbindelser, der øger CLC-1-funktionen, kan muligvis behandle myotoni, især i tilfælde, hvor de kunne kompensere for delvis tab af chloridkanalaktivitet. Inhibering af CLC-1 kan reducere tærsklen for muskelsammentrækning og kan være nyttig i tilfælde af muskelsvaghed eller degenerative sygdomme, såsom muskeldystrofi.
CLC-2
den indadrettede chloridkanal, CLC-2, har noget udbredt vævsfordeling. Det kan findes i centrale neuroner, hvor det regulerer neuronal aktivitet11-13. I astrocytter reguleres dens subcellulære målretning mod cellekryds af en interaktion med GlialCAM (MLC1), mutationer, hvor forstyrrer denne målretning og forårsager megalencephalisk leukoencefalopati14. Nylige terapeutiske interesser involverer CLC-2-ekspression i tarmslimhinde og lungebronkioler, hvor det spiller en rolle i henholdsvis tarm-og lungesekretioner. Lubiprostone, et lægemiddel, der anvendes klinisk til at lindre forstoppelse, blev foreslået at udøve sin virkning ved at aktivere CLC-2, men denne effekt er kontroversiel. Mens denne forbindelse aktiverer CLC-2-kanaler i nogle undersøgelser, regulerer den i andre CLC-2-Handel og øger CFTR-funktionen via prostaglandinreceptoraktivering15,16. Der er dog stadig tilstrækkelig dokumentation for, at stigende luftvejs CLC-2-funktion kunne tilvejebringe en alternativ chloridvej i cystisk fibrose17.
CLC-KA/KB
disse chloridkanaler udtrykkes især i nyrepitel og bidrager til permeabiliteten af cellemembraner til passiv chloridstrøm. De har en nøglerolle i den stigende lem og distale tubuli i nefronen, hvilket giver en basolateral rute for chloridreabsorption efter transport fra den primære urin via den apikale membran. CLCKB-genet, der koder for CLC-KB, er et af fem gener, der ligger til grund for Bartters syndrom. Tab af funktionsmutationer i CLC-KB resulterer i defekt chloridreabsorption og fører således til en saltspildende lidelse, som er forbundet med polyuri. Et af hovedtrækkene hos personer, der er påvirket af CLC-KB-mutationer (Bartter ‘ s type III) er lavt blodtryk. En mere alvorlig form for sygdommen er forårsaget af mutationer i BSND-genet (Bartter ‘ s type IV), som koder for Barttin, et tilbehørsprotein, der er vigtigt for handel med både CLC-KA og KB til plasmamembranen18. Denne form for lidelsen inkluderer også sensorisk døvhed, som menes at være forårsaget af tabet af handel med både CLC-KA og KB til epitelmembraner i det indre øre. Formentlig kan tab af enten CLC-KA eller KB-aktivitet, men ikke begge, tolereres af det auditive system. Dette antyder, at hæmmere, der er selektive for enten CLC-KA eller CLC-KB, eller delvis hæmning af begge, kan fungere som et nyt loop-diuretikum med potentialet til at sænke blodtrykket og med få bivirkninger. Dette har ført til undersøgelsen af deres farmakologi og udviklingen af nye inhibitorderivater med lav mikromolær affinitet19, som havde diuretiske virkninger, når de blev administreret til rats20. På den anden side kan lægemidler, der aktiverer CLC-KB-kanaler, forbedre restaktiviteten af defekte kanaler hos Bartters type III-patienter.
CLC-7
af underklassen 2CL–/H+ udvekslingstransportør er CLC-7 et lovende mål for lægemiddelvirkning, og dets hæmning kan være gavnlig ved osteoporose. Endnu en gang stammer denne indikation fra observationer af human sygdom forårsaget af tab af funktionsmutationer i CLC-7, som forårsager osteropetrose21. I denne lidelse er knoglemodellering af osteoklaster mangelfuld, hvilket menes at være forårsaget af defekt syre-og syresekretion. Dette fører til tæt knogle,som, hvis den gengives af en CLC-7-hæmmer, kunne reducere opløsningen af knogler og derfor styrke skeletet hos osteoporosepatienter22, 23. I proof-of-concept-undersøgelser reducerede farmakologisk inhibering af forsuring24 eller forstyrrelse af CLC-7-funktion af antistoffer25 knogleresorption. Imidlertid er CLC-7-hæmning muligvis ikke uden komplikationer, fordi humane og musestudier antyder, at mangel på CLC-7-funktion også kan være forbundet med neuronal opbevaring og degenerationsforstyrrelser på grund af reduceret lysosomal funktion26.
tab af funktion menneskelige mutationer-lektioner fra CFTR
det er værd at en kort pause på dette tidspunkt at overveje, at nogle af de terapeutiske indikationer for nye CLC-målrettede lægemidler sigter mod at behandle lidelser, der er forskellige og i den modsatte ende af spektret til dem, der er forårsaget af defekt CLC – funktion. Ud over dem, der er beskrevet ovenfor, er Dent ‘ s i-sygdom en Røntgenforbundet nyresygdom, der er forårsaget af tab af CLC-5-funktion (SE27 for en nylig gennemgang). Alle er sjældne arvelige lidelser, og en større proteindefekt involverer enten reduceret proteinaktivitet eller handel med målmembranen. Faktisk forårsager mange individuelle mutationer ER-retention og mangel på proteinmodning. En parallel kunne laves med cystisk fibrose, hvor de fleste af de berørte individer besidder den er-tilbageholdte LUTF508-mutation. Nylige og stratificerede tilgange til behandling af cystisk fibrose har været resultatet af et dobbeltstrenget angreb for at korrigere mutant proteinfoldning (CF-korrektorer) og/eller øge aktiviteten af plasmamembran CFTR-chloridkanaler (CF-potentiatorer). Succes opstår med potentiatorklassen28, som er effektive hos patienter med mutationer, der reducerer CFTR-aktivitet uden tab af proteinbiosyntese eller menneskehandel (f.eks. G551D), men effektiviteten af foldekorrektorer (som kræves i de fleste tilfælde) er stadig at blive etableret29. Selvom sygdommene forbundet med tab af CLC-funktion alle er sjældne genetiske lidelser, kan vi en dag være i stand til at behandle personer med myotoni, Bartters syndrom, Dents sygdom og osteopetrose samt cystisk fibrose med lægemidler, der korrigerer den faktiske årsag til deres lidelse.
Calciumaktiverede chloridkanaler
endelig vil der blive nævnt calciumaktiverede chlorid (ClCa) kanaler, som har klart definerede fysiologiske roller i en række celletyper, men deres molekylære identifikation led et par falske og stammede starter. Historien involverer fire typer protein: medlemmer af CLCA, Bestrophin, diskenhed og TMEM16 genfamilier. I alle tilfælde resulterede deres rekombinante overekspression i dannelsen af membranchloridstrømme, der stimuleres ved at hæve den intracellulære calciumkoncentration og i varierende omfang membran depolarisering. Rejsen til CLCA sluttede, da det blev fundet, at dette var et protein, der blev udskilt, men også sandsynligvis opreguleret membranekspression af ClCa-kanaler endogene til ekspressionssystemet30. Diskant-og Bestrophinproteiner udviser ikke alle egenskaberne af ClCa-kanaler undersøgt i større væv, selvom Best1 synes ansvarlig for en komponent af ClCa i sensoriske neuroner31 og kan også være en vigtig regulator for calciumfrigivelse fra det endoplasmatiske retikulum32,33. Tre uafhængige undersøgelser foreslog TMEM16A (også kaldet Ano1) som kandidat til en hovedkomponent, hvis ikke i sin helhed, til en calciumaktiveret chloridkanal34-36. Mange efterfølgende undersøgelser, lettet ved generering af molekylære værktøjer, har understøttet dette. TMEM16A er vigtigt for regulering membran ophidselse i vaskulær glat muskulatur, opreguleres i et dyr model af pulmonal hypertension og tone kan reduceres ved kanal inhibering37, 38. I sensoriske neuroner parrer TMEM16A tilstedeværelsen af inflammatoriske mediatorer til membranhypereksponering, og tmem16a-hæmning har antinociceptive virkninger39. I dyremodeller af astma øges ekspressionen af denne særlige chloridkanal, og dens inhibering kan have gavnlige virkninger40. Det findes også i interstitielle celler af Cajal i tarmen, og kanalfunktionen er nødvendig for den rytmiske sammentrækning af glat muskel i tarmvæggen41. Endvidere kan tmem16a-aktivering tilvejebringe en alternativ vej til epitelchloridsekretion i cystisk fibrose42. Mens der stadig er en vis debat omkring den nøjagtige funktion af resten af tmem16-familien, er ClCa-funktionen også blevet tilskrevet TMEM16B (Ano2), som menes at ligge til grund for ClCa-kanalen i olfaktoriske hårceller43,44. Der kan også være roller for denne klasse af ionkanal i kræftcellebiologi, og dens hæmning kan forhindre celleproliferation45-48.
afsluttende bemærkninger
denne gennemgang har fremhævet de forskellige roller, som chlorid udfører eller transporterer proteiner, og hvordan deres dysfunktion er koblet til menneskelig lidelse eller sygdomslignende symptomer i dyremodeller. Der er en alvorlig mangel på farmakologiske reagenser, der hæmmer, aktiverer eller forbedrer membranhandel med kloridkanaler og transportører. Der gøres fremskridt med lægemidler, der vender den defekte funktion af CFTR ved cystisk fibrose, hvilket forhåbentlig vil resultere i medicin, der er specifikke for de forskellige typer arvelig mutation. Inhibitorer og aktivatorer af tmem16a calciumaktiverede chloridkanaler42,49 viser sig nyttige laboratorieværktøjer, og nye forbindelser kan gøre effektive lægemidler, især hvis de kan levere vævsspecifikke effekter. Molekyler, der er specifikke for bestemte CLC ‘ er, er sandsynligvis de mest undvigende. Forståelse af det strukturelle grundlag for spændingsgated CLC-aktivering50 kan identificere proteindomæner, der kan målrettes ved rationel strukturbaseret lægemiddeldesign. Sådanne værktøjer vil gøre det muligt for os at sætte nogle af de nye terapeutiske ideer, der er blevet gennemgået og præsenteret her, på prøve.
Forfatterbiografi

Dr. Jon Lippiat afsluttede sin ph. d.om kaliumkanalers struktur, funktion og farmakologi ved University of Leicester. Han studerede pancreas beta-cellefunktion og diabetes ved University of Leeds før hans udnævnelse som lektor i farmakologi ved University of Leeds. Hans forskning involverer at belyse de strukturelle og fysiologiske egenskaber ved flere forskellige typer ionkanal og transportør og deres potentielle målretning ved hjælp af nye farmakologiske reagenser.
udsendelse
udgave 4 2013
relaterede emner
Kloridkanaler, lægemiddelmål, ionkanaler