Citrat-antikoagulation under CRRT for akut nyreskade
- akut nyreskade
- håndtering af AKI – nyreerstatningsterapier til AKI
- hæmodialyse, hæmofiltrering og hæmodiafiltrering
- initiering og timing af RRT for AKI – intermitterende versus kontinuerlig RRT
- antikoagulation under kontinuerlig nyreerstatningsterapi (CRRT)
- Citrat – mekanismen for dets antikoagulerende virkning og dets anvendelse i CRRT
- potentielle metaboliske forstyrrelser under citrat-antikoaguleret CRRT
- biokemisk overvågning af patienter, der får citrat-antikoaguleret CRRT
akut nyreskade
akut nyreskade (AKI), et klinisk syndrom med mange mulige årsager, defineres simpelthen som et pludseligt fald i nyrefunktionen over en periode på timer eller dage, hvilket fremgår af den nylige stigning i serumkreatininkoncentration og/eller reduktion i urinproduktion .
det adskiller sig fra kronisk nyresygdom (CKD), hvor nedsat nyrefunktion er langsomt, men irreversibelt progressivt og forekommer over en periode på måneder og år. AKI kan naturligvis forekomme hos dem med underliggende CKD, og en diagnose af AKI er forbundet med større end normal risiko for en eventuel diagnose af CKD .
internationalt vedtagne retningslinjer angiver, at en diagnose af AKI kan stilles, hvis:
• serumkreatinin øges med 0,3 mg/dl (26,5 liter/l) inden for 48 timer; eller
• der har været en 50% eller større stigning i serumkreatinin inden for de sidste 7 dage; eller
• urinvolumen er
AKI omfatter det fulde spektrum af sværhedsgrad fra et mildt fald i nyrefunktionen (trin 1 AKI) til nyresvigt (Trin 3 Aki). Iscenesættelse afhænger af serumkreatininmåling med eller uden urinproduktionsdata (tabel I)
|
Stage |
serumkreatinin |
urinproduktion |
|
1 |
1.5-1.9 gange baseline |
i 6-12 timer |
|
2 |
2.0-2.9 gange baseline |
⩾ 12 timer |
|
3 |
3.0 gange baseline |
for 24 timer |
tabel I: de tre faser af AKI sværhedsgrad (fra ref 1)
årsagerne til AKI klassificeres traditionelt under tre overskrifter: prerenal; nyre (iboende); og postrenal, understreger det faktum, at AKI kan have en specifik renal etiologi, men kan også skyldes primært problem uden for nyrerne.
enhver tilstand, der har den virkning at reducere blodgennemstrømningen til nyrerne (renal perfusion) er en potentiel årsag til prerenal AKI; disse tilstande inkluderer: hypovolæmi på grund af opkastning, diarre, blødning, forbrændinger eller septisk chok; og reduceret hjerteproduktion på grund af for eksempel hjertesvigt og leversvigt (cirrose). Den største årsag til iboende AKI er renal tubulær nekrose, der skyldes renal iskæmi eller indtagelse af nefrotoksiske lægemidler/toksiner.
Sepsis, den mest almindelige årsag til AKI hos kritisk syge, skyldes delvis dårligt defineret iboende nyreskade, der ligner renal tubulær nekrose . Endelig er postrenal AKI resultatet af enhver tilstand, der forhindrer urinstrømmen distalt til nyrerne; disse inkluderer: nyresten (calculi); prostata sygdom (tumor/hypertrofi); blære dysfunktion; og urethral stricture.
håndtering af AKI – nyreerstatningsterapier til AKI
der er ingen specifik behandling for AKI, og behandling er stort set støttende med behandling rettet mod den underliggende årsag. Tilbagetrækning af nefrotoksiske lægemidler, væskeoplivning og korrektion af elektrolyt-og syre-base-forstyrrelse er alle en del af denne generelle understøttende behandling . Administration af vasopressor eller inotrope lægemidler for at genoprette normalt blodtryk og hjerteudgang kan være nødvendigt.
Nyreerstatningsterapi (RRT), fokus for denne artikel, repræsenterer den sidste udvej behandling for patienter med svær AKI, der ikke reagerer på konservativ understøttende behandling. Cirka 23% af ICU-patienter med AKI (dvs .omkring 13% af alle ICU-patienter) får RRT.
Nyreerstatningsterapi (RRT) er den generiske betegnelse for alle behandlinger, der søger at erstatte nyrefunktion. Transplantation af donornyr til dem med nyresygdom i slutstadiet kan betragtes som den ultimative RRT , men udtrykket er oftere forbeholdt de terapier, der erstatter nyrens blodfiltrering og homeostatiske funktioner ved dialyse, en proces, der bruger en semipermeabel membran som blodfilter. To brede typer af dialytisk RRT er tilgængelige til behandling af AKI (og for den sags skyld, sluttrin CKD): peritonealdialyse og hæmodialyse.
derimod involverer hæmodialyse filtrering af blod i en maskine uden for kroppen (ekstrakorporeal). Blod pumpes til filteret / dialysatoren, hvor affaldsprodukter og overskydende væske fjernes og derefter returneres til kroppen. Dette ekstrakorporale kredsløb (dialysemaskinen og dens forbindelsesrør fra og tilbage til patienten) er et prokoagulerende miljø.
hæmodialyse, hæmofiltrering og hæmodiafiltrering
moderne dialysemaskiner har mulighed for hæmofiltrering (HF) såvel som hæmodialyse (HD), hvilket giver mulighed for tre forskellige dialytiske modaliteter til behandling af AKI: hæmodialyse (HD); hæmofiltrering (HF); og hæmodiafiltrering (HDF).
kernen i alle tre modaliteter er den semipermeable membran, der udgør et blodfilter. Når blod pumpet fra patienten strømmer på den ene side af denne membran, passerer overskydende vand og affaldsopløste stoffer over membranen. Filtratet eller spildevandet pumpes til affald, når det filtrerede blod returneres til patienten.
processen med hæmodialyse (HD) involverer brugen af en dialysevæske, der strømmer kontinuerligt og modstrøm til blod på den anden side af membranen. Sammensætningen og strømningshastigheden af dialysevæske sikrer en konstant koncentrationsgradient over den semipermeable membran med hensyn til blodopløste stoffer. Disse koncentrationsgradienter letter igen kontrolleret diffusion af opløste molekyler over membranen.
for opløste stoffer som urinstof og kreatinin, som skal fjernes fra blod, er koncentrationsgradienten sådan, at diffusionsretningen er fra blod til dialysevæske, mens for opløste stoffer som bicarbonat, som ofte skal tilsættes til blod for at korrigere acidosen forbundet med svær AKI, sikrer dialysevæske med høj bicarbonatkoncentration i forhold til blod, at diffusion er i den modsatte retning, fra dialysevæske til blod. Justering af dialysevæskesammensætning og strømningshastighed tillader således patientspecifik metabolisk korrektion.
væskeoverskud er ofte et træk ved AKI, der korrigeres under hæmodialyse. Dette opnås ved ultrafiltrering, som afhænger af den hydrostatiske trykgradient, der findes på tværs af den semipermeable membran. Det relative positive hydrostatiske tryk på membranens blodside “skubber” effektivt vand fra blod til dialysevæske.
denne ultrafiltrering letter også passage af opløste molekyler, der trækkes sammen med vand under ultrafiltrering ved hjælp af en mekanisme kaldet opløst konvektion (eller opløsningsmiddeltræk). Den kombinerede virkning af opløst diffusion, opløst konvektion og ultrafiltrering under hæmodialyse sigter mod at sikre, at væskevolumen og sammensætning inden for både ekstracellulært og intracellulært rum gendannes så tæt som muligt på det, der vedrører dem med normalt fungerende nyrer.
Hæmodiafiltrering (HDF) er kombinationen af HF og HD. Det muliggør optimal clearance af opløste stoffer med lav molekylvægt ved diffusion til dialysevæske kombineret med optimal clearance af opløste stoffer med høj molekylvægt ved konvektion og ultrafiltrering. Som med HF kræver HDF kontinuerlig udskiftningsvæske; og som med HD kræver HDF dialysevæske.
initiering og timing af RRT for AKI – intermitterende versus kontinuerlig RRT
alle nyreerstatningsterapier (PD, HD, HF og HDF) kan leveres intermitterende (dvs.typisk i 3-4 timers sessioner) eller kontinuerligt, indtil nyrefunktionen er genoprettet. For patienter med nyresvigt i slutstadiet, der kræver livslang (kronisk) RRT, er behandlingen udelukkende intermitterende hæmodialyse (IHD), der næsten altid leveres i fire timesessioner tre gange om ugen .
patienter med AKI har kun et midlertidigt krav til RRT for at understøtte nyrefunktionen under opløsning af den kritiske/akutte sygdom, der udfældede AKI. Den gennemsnitlige varighed af RRT blandt patienter med AKI er omkring 13 dage , selvom det i særlige tilfælde kun kan være nødvendigt i et par dage eller strække sig i mange uger.
traditionelle (absolutte) indikatorer til initiering af RRT i AKI inkluderer:
• hyperkalæmi (plasmakalium > 6,0-6,5 mmol/L)
• alvorlig uræmi (plasma-urinstof > 30 mmol/L)
• tegn på uremisk encefalopati
• acidose (pH • akut lungeødem
det kan være fordelagtigt at starte behandlingen, før disse ekstreme virkninger af AKI er tydelige, men det kan være optimal timing for at starte (og stoppe) RRT er i øjeblikket uklar og genstand for løbende forskning . Der er i øjeblikket ingen pålidelige data til støtte for en bestemt type RRT for AKI, og derfor er alle typer RRT blevet anvendt.
nuværende retningslinjer afspejler imidlertid en enighed om , at RRT uanset modalitet skal leveres kontinuerligt snarere end intermitterende til de mest kritisk syge (hæmodynamisk ustabile) patienter. Nylige undersøgelser viser, at der i dag anvendes kontinuerlige nyreerstatningsterapier (CRRT ‘ er) meget hyppigere end intermitterende terapier til AKI, og at den mest almindeligt anvendte CRRT er kontinuerlig venøs venøs hæmofiltrering (CVVHF) efterfulgt af kontinuerlig venøs venøs hæmodiafiltrering (CVVHDF).
antikoagulation under kontinuerlig nyreerstatningsterapi (CRRT)
CRRT, som alle andre nyreerstatningsterapier undtagen peritonealdialyse, involverer pumpning af blod gennem et ikke-fysiologisk, ekstrakorporalt kredsløb. Den iboende egenskab ved blod til koagulering (koagulering) ved kontakt med ikke-fysiologiske overflader bestemmer, at blod skal antikoaguleres for at opretholde et “koagulationsfrit” patient-ekstrakorporalt kredsløb.
CRRT har et særligt behov for antikoagulation sammenlignet med intermitterende modaliteter på grund af de langvarige behandlingssessioner og den relativt langsomme hastighed, hvormed blod pumpes gennem kredsløbet . Derudover er blodet fra patienter, der har brug for CRRT, ofte allerede i en relativ prokoagulant tilstand på grund af underliggende kritisk sygdom (f .eks.
i mange år var heparin, enten ufraktioneret heparin (UF) eller heparin med lav molekylvægt (lmvh), den eneste antikoagulant, der blev anvendt i dialytiske procedurer, herunder CRRT. Heparin anvendes fortsat; det er et billigt og generelt sikkert middel til antikoagulation for de fleste patienter, der kræver RRT.
imidlertid medfører systemisk heparin-antikoagulation, som ikke kan undgås, uundgåeligt en øget risiko for blødning, så heparin-antikoagulation under dialytiske procedurer er absolut kontraindiceret for dem, der i øjeblikket bløder eller har en højere risiko for blødning end normal.
derudover kan heparin i et lille mindretal (
den potentielle blødning og HIT-II-risici forbundet med heparinbrug fremhævede behovet for en alternativ antikoagulant til nogle patienter, der kræver RRT. Citrat gav et sådant alternativ. Regional citrat-antikoagulation af dialysekredsløbet, der først blev brugt med succes i begyndelsen af 1980 ‘ erne , var oprindeligt forbeholdt det lille mindretal af patienter, for hvilke heparin er kontraindiceret. Det ændrede sig med resultaterne af randomiserede kontrollerede forsøg, der sammenlignede heparin-antikoaguleret CRRT med citrat-antikoaguleret CRRT; disse viste, at citrat er både en mere effektiv og sikrere antikoagulant end heparin .
citrat er derfor opstået i de senere år som det valgte antikoagulant for alle AKI-patienter, der kræver CRRT . Intensivafdelinger rundt om i verden rapporterer nu om at skifte fra heparin til regional citrat-antikoagulation for CRRT . Nogle myndigheder anbefaler endda brugen af citrat snarere end heparin-antikoagulation til intermitterende (kronisk) hæmodialyse (IHD).
Citrat – mekanismen for dets antikoagulerende virkning og dets anvendelse i CRRT
citrat, som er blevet brugt til at antikoagulere/konservere doneret blod til transfusion i godt over et århundrede , forhindrer blod i at størkne gennem dets evne til at binde (chelat) det ioniserede calcium (ICA), der cirkulerer i blodplasma. Denne iCa er en nødvendig cofaktor for både blodpladeaggregering og flere vigtige trin i de indre og ydre koagulationsveje, der er ansvarlige for fibrinproduktion og derved dannelse af fibrinkoagel.
blodkoagulation forhindres ved reduktion i plasma-ICA-koncentrationen til omkring 0,35 mmol/L (normalt ref-interval 1,15-1,30 mmol/L). Denne ikke-fysiologiske, alvorligt hypokalcemiske tilstand opnås ved at hæve plasmacitratkoncentrationen til omkring 3 mmol/L (normal plasmacitratkoncentration ~0,1 mmol/L ).
selvom der er forskelle i detaljer skitseret af Morabito et al , involverer alle protokoller for citrat-antikoagulation under CRRT kontinuerlig infusion af citratholdig opløsning (normalt enten trinatriumcitrat eller syre-citrat-dekstrose (ACD) opløsning) til forfilter/dialyselinjen, tæt på hvor den forlader patienten, enten som en separat opløsning eller kombineret med præfortyndingsudskiftningsvæske. Strømningshastigheden for denne infusion justeres for at opnå en blodcitrat-koncentration på ~3 mmol/L og derved en plasma-iCa på omkring 0,35 mmol/L.
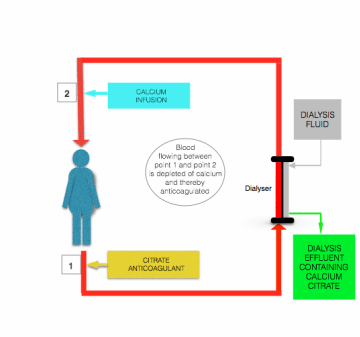
hypokalcæmi induceret af citratinfusion korrigeres, før blod vender tilbage til patienten, ved infusion af calciumholdig opløsning (calciumchlorid eller calciumgluconat) til postfilterlinjen tæt på, hvor den kommer ind i patienten (se figuren ovenfor).
den største sikkerhedsfordel ved citrat-antikoagulation i forhold til heparin-antikoagulationsbehandling er, at antikoagulation er begrænset til det ekstrakorporale kredsløb. Denne såkaldte “regionale antikoagulation” opnås, fordi det meste af det infunderede citrat fjernes (som enten citratanioner eller calciumcitrat chelat) fra blod under passage gennem filteret/dialysatoren .
ethvert resterende citrat i postfilterblod fortyndes i systemisk cirkulation og metaboliseres hurtigt til kulsyre og vand af den iltafhængige Krebs-cyklus i mitokondrion af vævsceller (overvejende leverceller ).
metabolisme af citrat er forbundet med produktion af bicarbonat: for hver metaboliseret 1 mmol citrat genereres 3 mmol bicarbonat. Den hurtige clearance af citrat (halveringstiden for citrat i blod er normalt omkring 5 minutter ) via denne hovedsageligt levervej sikrer normalt fraværet af systemisk antikoagulation under CRRT og derved ingen yderligere risiko for blødning.
potentielle metaboliske forstyrrelser under citrat-antikoaguleret CRRT
den tilsyneladende modvilje mod fuldt ud at omfavne citrat-antikoaguleret CRRT for alle AKI-patienter indtil for nylig er blevet tilskrevet bekymring med hensyn til syre-base-og elektrolytforstyrrelser, der kan forekomme hos patienter, der får behandlingen .
følgende elektrolyt-og syrebaseforstyrrelser er rapporteret hos patienter, der får citrat-antikoaguleret CRRT :
• hypokalcæmi/hypercalcæmi
• hypomagnesi/hypermagnesi
• hyponatremi/hypernatremi
• metabolisk alkalose
• metabolisk acidose
disse forstyrrelser kan opstå af en række årsager, men akkumulering af citrat i den perifere cirkulation (citrattoksicitet) kan være central for de fleste af disse forstyrrelser. Årsager til, at Citrat kan ophobes under CRRT, omfatter:
• progressiv reduktion i membranpatency under dialyse med deraf følgende reduceret filtrering af citrat og samtidig stigning i citratafgivelse til systemisk cirkulation
• operationel fejl – utilsigtet øget hastighed af citratinfusion til det ekstrakorporale kredsløb og samtidig øget levering af citrat til systemisk cirkulation
• blodprodukttransfusion – citratkonserveringsmiddel til stede i blodprodukter øger citratbelastningen i systemisk cirkulation som følge af CRRT
uanset årsagen, akkumulering af citrat i den perifere cirkulation kan resultere i citratchelering af cirkulerende ioniseret calcium med deraf følgende reduceret plasmaioniseret calciumkoncentration (hypokalcæmi). Hvis tilstrækkelig alvorlig hypokalcæmi kan forårsage hjertearytmi og i sidste ende hjertestop .
selvom plasmaioniseret calcium reduceres under citratakkumulering (toksicitet), øges det samlede calcium (indikerer hypercalcæmi), fordi det calcium, der er bundet til citrat, er inkluderet i målt total calcium. En stigning i forholdet mellem total og ioniseret calcium (normalt 2,0) til > 2.1 har vist sig at være det mest pålidelige signal om citrattoksicitet i fravær af rutinemæssigt tilgængelig plasmasitrat estimering .
risikoen for øget plasmanatrium (hypernatræmi) forbundet med citrat-antikoagulation skyldes det høje natriumindhold (hypertonicitet) af nogle citratopløsninger, der anvendes i CRRT. For eksempel indeholder den 4% opløsning af trinatriumcitrat, der anvendes i nogle protokoller, natrium i en koncentration på 420 mmol/L. i praksis kan brugen af hypotonisk dialyse/erstatningsvæsker mindske denne risiko, og hypernatræmi er efter alt at dømme en sjælden komplikation af citrat-antikoagulation .
risikoen for hypomagnesi (reduceret serummagnesium) under citrat-antikoagulation afspejler det faktum, at magnesium til fælles med calcium er en divalent ion, der også kan binde til (chelat) citrat. Hvis magnesiumtab på grund af chelationsvirkningen af citrat ikke kompenseres fuldt ud af magnesium i dialyse/erstatningsvæsker, kan hypomagnesi forekomme .
biokemisk overvågning af patienter, der får citrat-antikoaguleret CRRT
Point-of-care-test ved hjælp af en blodgasanalysator placeret i intensivafdelingen muliggør hurtig og bekvem måling af de fleste parametre (ioniseret calcium, pH, bicarbonat, baseoverskud, natrium og lactat), men serum total calcium-og magnesiumestimering er normalt ikke tilgængelig på disse platforme, og prøver skal sendes til laboratoriet til disse målinger.
to nylige undersøgelser viser, at nogle blodgasanalysatorer muligvis ikke er pålidelige til måling af ioniseret calcium ved de ekstremt lave, ikke-fysiologiske koncentrationer (~0.3 mmol/L) til stede i postfilterblod, selvom deres evne til nøjagtigt at måle plasmaioniseret calcium i systemisk cirkulation (hvor koncentrationen er meget højere) ikke er i tvivl.
|
Parameter målt |
Overvågningsinterval |
målværdier eller ca. referenceområder |
målingens formål |
korrigerende handling, hvis det er uden for målet |
|
Postfilter ioniseret calcium (ICA) koncentration, dvs. blod udtaget fra postfilter port. |
inden for 1 time efter start og efter enhver citratdosisændring, derefter hver 4-6 timer |
0.25-0.35 mmol / L |
|
justering af citratdosis: Forøg hvis ICA > 0,35, fald hvis iCa |
|
systemisk ioniseret calcium (Ica), dvs. blod udtaget fra patienten |
Baseline (før start), derefter 1 time efter start, derefter mindst hver 4-6 timer |
1.15-1.30 mmol / L |
|
justering af calciuminfusionshastigheden øges, hvis iCa 1.30 |
|
systemisk total calcium (TotCa), dvs. blodprøveudtagning fra patient (TotCa = Ica + calcium bundet til albumin + calcium bundet til citrat) |
mindst hver 12-24 timer (skal være samtidig med systemisk ioniseret calciumestimering) |
kun påkrævet til bestemmelse af totCa:ICA ratio (se nedenfor) |
||
|
forholdet mellem total og ioniseret calcium (TotCa:iCa) |
mindst hver 12-24 timer |
at detektere citratakkumulering / toksicitet, der undertiden kaldes “citratlås” |
valgmulighederne inkluderer:
|
|
|
arteriel blodgasanalyse
|
Baseline (før start). inden for 1 time efter start, derefter mindst hver 4-6 time. |
pH 7, 35-7, 45 bicarb 23-28 mmol/L BE–2-+3 mmol / L |
til påvisning af syre-base forstyrrelser: metabolisk alkalose metabolisk acidose |
valg i tilfælde af metabolisk alkalose omfatter:
|
|
serumnatrium |
en gang dagligt |
135-145 mmol / L |
at opdage hypernatremi / hyponatremi |
sjælden forekomst-kontroller korrekt dialyse / udskiftningsvæske |
|
Serumlactat |
Baseline (før start), derefter i henhold til kliniske behov |
at hjælpe med at identificere dem, der er i risiko for citrattoksicitet |
overveje, sammen med TotCa:ICA ratio, risiko for citrat toksicitet |
|
|
Serum magnesium |
mindst en gang dagligt |
at opdage hypomagnesi |
korrektion med magnesiuminfusion |
tabel II: biokemisk monitorering under citrat-antikoaguleret CRRT (Ref 24)