Frontiers in Medicine
- introduktion
- patienter og metoder
- patientvalg i overvågnings -, Epidemiologiog Slutresultatdatabase
- statistisk analyse
- resultater
- patientkarakteristika
- forbedret risiko for T1-trin sammenlignet med andre T-trin i sammenhæng med Serum Cea-forhøjelse
- effekt af præoperativ Serum Cea – forhøjelse i T-trin
- Diskussion
- data Tilgængelighedserklæring
- etisk Erklæring
- Forfatterbidrag
- interessekonflikt
- anerkendelser
introduktion
rektal cancer er en af de mest almindelige maligniteter på verdensplan (1). Ifølge American Joint Committee on Cancer (AJCC) iscenesættelsessystem er den anatomiske udstrækning af primær tumor (T-fase) en af de vigtigste prognostiske forudsigere. Imidlertid, patienter med det samme T-Stadium af rektal kræft kan vise betydeligt forskellige kliniske resultater.
først rapporteret i 1965, carcinoembryonisk antigen (CEA) er et 180-200 kDa glycoprotein og et medlem af immunoglobulin superfamilien (2). CEA udskilles af en række faste tumorer, herunder 90% af kolorektal cancer (3). Som den vigtigste og mest pålidelige serumprognostiske biomarkør i kolorektal cancer er forhøjede præoperative CEA-niveauer fundet at være forbundet med dårligere prognose for kolorektal cancer (4-9).
tidligere undersøgelser har vist, at CEA var forbundet med kræftcelleadhæsion og medfødt immunitet i kolorektal cancer. Derudover blev CEA også rapporteret for at lette binding af kolorektal cancerceller til metastasesteder og understøtte tumorprogression (10-12).
traditionelt er den fjerne spredning af tumorceller blevet betragtet som en sen begivenhed, men fund fra flere tidligere undersøgelser viste, at erhvervelse af metastatisk potentiale kunne forekomme i det meget tidlige stadium af tumorprogression (13-16). Et al. (17) rapporterede, at en meget lille tumorstørrelse involveret i lymfeknudepositivitet kan være et surrogat for aggressiv biologi. Vi har derefter mistanke om, at meget tidligt stadium rektal kræft med serum cea elevation kunne antyde den tidlige erhvervelse af metastatisk potentiale og forudsige en meget dårlig overlevelse af rektal kræft.
men så vidt vi ved, blev der rapporteret få undersøgelser for at undersøge sammenhængen mellem T-Stadium og serum CEA-niveauer (C0 og C1) til bestemmelse af prognose for rektal kræft. Derfor gennemfører vi denne store befolkningsbaserede undersøgelse for at undersøge, om meget tidligt T-Stadium i sammenhæng med serum cea-forhøjelse kan være et surrogat for biologisk aggressiv sygdom og forudsige for dårlig årsagsspecifik overlevelse (CSS) af rektal kræft. For at fjerne effekten af lymfeknudepositivitet på vores forskning udelukkede vi derefter knudepositive patienter og fokuserede analysen på fase I-II patienter.
patienter og metoder
patientvalg i overvågnings -, Epidemiologiog Slutresultatdatabase
som en autoritativ kilde til information om kræftforekomst og overlevelse i USA og en omfattende kilde til befolkningsbaseret information inklusive alle de nydiagnosticerede kræfttilfælde, der forekommer i overvågnings -, Epidemiologiog slutresultater (SEER) – deltagende områder, omfatter SEER-databasen ~28% af den amerikanske befolkning. SEER-databasen indeholdt ingen identifikatorer og var offentligt tilgængelig for forskere. SEER * Stat er et program, der leveres af SEER-programmet til at indhente patientoplysninger ved hjælp af onlineadgang. Først blev case-notering-sessionen for SEER * Stat-programmet (SEER*Stat 8.3.5) brugt til at liste alle patientrelaterede oplysninger, og patienter diagnosticeret med fase I-II (node–negativ) rektal kræft mellem 1.januar 2004 og 31. December 2015 blev identificeret fra SEER-databasen (Figur 1). Rektalkræftpatienter blev identificeret ved hjælp af ICD-O-3-stedskoderne C199 og C209 og adfærdskode 3 (NAACCR-punkt 522 og 523) (9). Vi valgte at inkludere disse år, fordi oplysningerne om præoperativ serum CEA blev registreret fra 2004, og SEER-opfølgningen sluttede i 2015.

Figur 1. Rutediagram over patientkohortdefinitioner.
derefter modtog de neoadjuvant strålebehandling, mangel på positiv histologisk bekræftelse med ukendt race, ikke-adenocarcinomhistologier eller ikke aktiv opfølgning blev udelukket fra vores undersøgelse. Patienter med præoperativt serum cea-niveau til rådighed blev inkluderet i vores undersøgelse, og vi grupperede “positiv / forhøjet” og ” negativ / normal; inden for normale grænser ” som C1 og C0 (C-trins information). Afskæringsværdierne for CEA var henholdsvis 2,5 ng/ml for ikke-rygere og 5 ng/ml for rygere. Ud over, følgende patientklinikopatologiske variabler blev også hentet fra SEER-databasen: t-fase, race, køn, tumorplacering, alder ved diagnose, diagnoseår, karakter, og histologi.
statistisk analyse
i denne undersøgelse blev Pearsons chi-kvadrerede test brugt til at sammenligne alle patienternes klinikopatologiske variabler hentet fra seer-databasen mellem de normale og forhøjede præoperative serum cea-niveauer. Nogle multivariable forholdsmæssige faremodeller blev bygget til at identificere uafhængige prognostiske variabler af endetarmskræft i vores analyser. Overlevelseskurver blev genereret ved hjælp af Kaplan–Meier-metoden, og forskelle mellem kurverne blev analyseret ved log-rank-test. De primære resultater af interesse i denne undersøgelse var CSS og samlet overlevelse (OS). CSS blev beregnet fra datoen for diagnosen til datoen for kræftspecifik død. Dødsfald, der tilskrives endetarmskræft, blev behandlet som begivenheder, og dødsfald af andre årsager blev behandlet som censurerede observationer på dødsdatoen. For at bestemme, om der var en signifikant interaktion mellem det præoperative serum CEA-niveau og T-trin i forudsigelsen af CSS, definerede vi også en interaktionsvariabel (T-trin og serum CEA-niveau). Tosidet P < 0,05 blev betragtet som statistisk signifikant. Statistiske analyser blev hovedsageligt udført ved hjælp af SPSS version 22 (IBM Corporation, Armonk, NY, USA).
resultater
patientkarakteristika
samlet set blev 19.184 patienter diagnosticeret med Fase I–II rektalkræftpatienter identificeret fra SEER-databasen mellem 1.januar 2004 og 31. December 2015 (Figur 1). Af disse patienter blev 13.007 (67,8%) patienter tildelt C0-trin, og 6.177 (32,2%) patienter blev tildelt C1-trin. AJCC iscenesættelsessystem antydede, at 6.077 patienter var i T1-stadiet, 4.783 patienter i T2-stadiet, 7.021 i T3-stadiet og 1.303 var i T4-stadiet. I alt 2.560 (13,3%) patienter døde af rektal kræft i slutningen af opfølgningstiden. Den mediane opfølgningstid for hele kohorten var 44 måneder (0-143 måneder). Patienternes baseline-karakteristika er opsummeret i tabel 1.
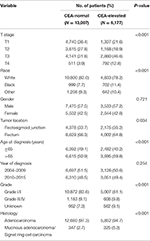
tabel 1. Sammenligning af baseline karakteristika for fase I-II rektal cancer ved serum carcinoembryonisk antigen (CEA) niveau.
forbedret risiko for T1-trin sammenlignet med andre T-trin i sammenhæng med Serum Cea-forhøjelse
det blev fundet, at C1-trin var mere sandsynligt at korrelere med højere T-trin, sort, rektosigmoid kryds, ældre alder, højere grad og slimhindigt adenocarcinom/Signet ringcellekarcinom (tabel 1, P < 0,05). Som vist i tabel 2, race, køn, tumorplacering, alder ved diagnose, diagnoseår, klasse, histologi, T-Stadium, og serum CEA-niveau blev inkluderet i den multivariate koks-analyse. Disse omfattede race, køn, tumorplacering, alder ved diagnose, tumorgrad, T-Stadium og serum cea niveau, mens risikoen mellem T2,C0 og T1,C0 ikke var statistisk forskel (P = 0,925). Det blev vist, at T1-stadiet i forbindelse med serum-cea-forhøjelse udgjorde uventet højere risiko for rektal-kræftspecifik dødelighed sammenlignet med trin T2 og T3. I fase T1 sygdom var forhøjet niveau af serum cea forbundet med 227,6% øget risiko for dødelighed sammenlignet med normalt niveau af serum cea.

tabel 2. Multivariate regressionsanalyser af årsagsspecifik overlevelse (CSS) i fase I–II rektal cancer.
Kaplan–Meier overlevelseskurver er afbildet i figur 2, 3. Den 5-årige CSS-rate var 92,2% i T1C0, 75,2% i T1C1, 93,1% i T2C0, 86,7% i T2C1, 84,6% i T3C0, 76,3% i T3C1, 62,9% i T4C0 og 43,6% i T4C1 (figur 2, P < 0,001). Derfor præsenterede T1C1 en lignende 5-årig CSS-sats sammenlignet med T3C1 (75,2 mod 76,3%, P = 0,238). Derudover var fundet endnu mere udtalt i OS. Den 5-årige OS-rate var 78,6% i T1C0, 48,3% i T1C1, 77,1% i T2C0, 62,3% i T2C1, 68,5% i T3C0, 54,5% i T3C1, 45,3% i T4C0 og 30,0% i T4C1 (figur 3, P < 0,001). T1C1 præsenterede signifikant lavere 5-årig CSS-sats sammenlignet med T3C1 (48.3 vs. 54.5%, P < 0.001).
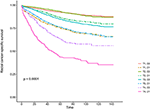
figur 2. Kaplan-Meier årsagsspecifikke overlevelseskurver (CSS) i T-trin kombineret med serumcarcinoembryonisk antigen (CEA) niveau.
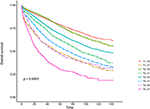
figur 3. Kaplan-Meier Total survival (OS) kurver af T-trin kombineret med serumcarcinoembryonisk antigen (CEA) niveau.
effekt af præoperativ Serum Cea – forhøjelse i T-trin
skovplottet blev tegnet for at vise fareforhold (HRs) for at sammenligne CSS mellem normale og forhøjede cea-grupper i respektive t-trin (figur 4). Sammenlignet med normale niveauer af serum CEA, i trin T2, var forhøjede niveauer af serum cea forbundet med 69,0% øget risiko for rektal-cancer-specifik dødelighed ; i trin T3 var forhøjede niveauer af serum CEA forbundet med 67,2% øget risiko for rektal-cancer-specifik dødelighed (HR = 1,672, 95% CI = 1,486–1,882, P < 0,001); i trin T4 var forhøjede niveauer af serum CEA forbundet med 81,3% øget risiko for rektal-cancer-specifik dødelighed (HR = 1,672, 95% CI = 1,486–1,882, P < 0,001); i trin T4 var forhøjede niveauer af serum CEA forbundet med 81,3% øget risiko for rektal-cancer-specifik dødelighed (HR = 1,813, 95% CI = 1,485-2,213, p < 0,001); derimod, i trin T1, forhøjede niveauer af serum CEA præsenterede endda op til 211.6% øget risiko for rektal-kræftspecifik mortalitet (HR = 3, 116, 95% CI = 2, 639-3, 679, P < 0, 001).
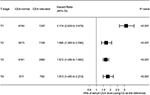
figur 4. Risikoforhold (HRs) for årsagsspecifik overlevelse (CSS) mellem normalt og forhøjet niveau af serumcarcinoembryonisk antigen (CEA) i henhold til T-stadiet.
Diskussion
vi havde til formål at undersøge sammenhængen mellem T-Stadium og serum CEA-niveauer ved bestemmelse af CSS for rektal kræft. Vi antog, at endetarmskræft med meget tidligt T-Stadium (Stadium T1) og serum cea-forhøjelse kan være et biologisk surrogat for aggressiv sygdom og dermed forudsige et dårligt onkologisk resultat. Med ~20.000 patienter diagnosticeret med stadium I-II rektal kræft inkluderet i vores undersøgelse.
i denne undersøgelse blev det fundet, at serum cea-forhøjelse var mere tilbøjelig til at korrelere med højere T-Stadium, sort, rektosigmoid kryds, ældre alder og højere grad og slimhindigt adenocarcinom/Signet ringcellekarcinom. Kaplan-Meier-overlevelsesanalyser viste, at i forbindelse med serum cea-forhøjelse var 5-årig CSS-hastighed på trin T1 75,2%, hvilket ikke opnåede statistisk forskel fra trin T3 (76,3%). Når det kommer til samlet overlevelse, 5-årig OS-hastighed på trin T1 med præoperativ serum cea-forhøjelse (48,3%) var endnu lavere end trin T3 involveret i CEA-forhøjelse (54,5%) og opnåede ikke statistisk forskel fra trin T4 (45.3%), hvilket betyder forhøjet præoperativt serumniveau af CEA kunne identificere en undergruppe af stadium T1 rektal kræft med lignende CSS sammenlignet med nogle stadium T3 sygdomme og med lignende OS sammenlignet med nogle stadium T4 sygdomme.
efter justering for kendte prognostiske faktorer for rektal kræft (race, køn, tumorplacering, alder ved diagnose, diagnoseår, grad og histologi) blev interaktionsvariablen (T-Stadium og serum CEA-niveau), vi definerede, vist at være en uafhængig prognostisk faktor for rektal kræft. I forbindelse med serum-cea-forhøjelse viste T1-stadiet uventet højere risiko for rektal-kræftspecifik dødelighed sammenlignet med trin T2 og T3. I fase T1 sygdom var forhøjet niveau af serum cea forbundet med 227,6% øget risiko for dødelighed sammenlignet med normalt niveau af serum cea. Ud over, race, køn, tumorplacering, alder ved diagnose, og tumorkvalitet blev også identificeret som uafhængige prognostiske faktorer i fase I–II rektal kræft. Bortset fra T1 blev det fundet, at præoperativ serum cea-forhøjelse udgjorde ~75% højere risiko for rektal-kræftspecifik dødelighed i det respektive T-Stadium, men antallet steg kraftigt til 211,6% i T1-stadiet.
i 2000 foreslog AJCC ‘ s kolorektale arbejdsgruppe inkludering af serumniveau af CEA (C-fase) i det konventionelle AJCC TNM-iscenesættelsessystem for kolorektal cancer (18). Desuden har American Society of Clinical Oncology og Den Europæiske Gruppe for tumormarkører begge støttet inkluderingen af præoperativt serum CEA-niveau som et prognostisk værktøj i kolorektal cancer (19-21).
flere tidligere undersøgelser rapporterede serum CEA-niveauet som en stærk prognostisk rolle i tyktarmskræft (4-7, 22-26). I 2011, Thirunavukarasu et al. (25) rapporterede, at præoperativt serum CEA-niveau var en uafhængig prognostisk biomarkør for tyktarmskræft, og prognosen var værre hos patienter med højt CEA med et lavere Stadium sammenlignet med patienter med lavt CEA med et højere stadium. I denne undersøgelse blev høj CEA endda betragtet som stærk som nodepositivitet til forudsigelse af dårlige onkologiske resultater af tyktarmskræft.
men få undersøgelser fokuserer på at belyse den prognostiske rolle af serum CEA-niveau i rektal cancer. I 2016, også ved hjælp af SEER-databasen, Tarantino et al. (9, 27) gennemførte de to store populationsbaserede undersøgelser, som gav overbevisende bevis for, at forhøjet niveau af præoperativt serum CEA var en stærk forudsigelse for værre samlet og kræftspecifik overlevelse i rektal kræft. I 2018 Liu et al. (8) viste, at præoperativt serum CEA var en uafhængig prognostisk faktor for rektal kræft, og forhøjet serum CEA–niveau præsenterede åbenbart dårligere overlevelse sammenlignet med normalt serum CEA-niveau i trin i-IV. de eneste to tidligere undersøgelser fokuserede imidlertid på at undersøge den prognostiske rolle af præoperativt serum CEA-niveau undersøgte ikke sammenhængen mellem CEA-niveau og T-Stadium i forudsigelse af tumorresultaterne af rektal kræft.
selvom det konventionelle viser, at kræft erhverver det metastatiske potentiale trin for trin, når de vokser til en stor størrelse (28), viste nogle tidligere undersøgelser imidlertid, at erhvervelse af metastatisk potentiale kunne forekomme meget tidligt i tumorprogression. En tidligere undersøgelse viste den ekstremt dårlige overlevelse af meget lille tumorstørrelse, når den var involveret i lymfeknudepositivitet (17). Derudover viser resultaterne af vores forskning, at forhøjelse af præoperativt serum CEA-niveau i meget tidligt stadium (Stadium T1) rektal kræft er forbundet med meget dårlig OS og CSS og kan være et surrogat af aggressiv biologi. Vi mener, at både lymfeknudeinddragelse og serum cea-forhøjelse betragtes som erhvervelse af metastatisk evne. Vores undersøgelse, kombineret med den af vo et al. støt konsekvent den førnævnte ide om, at erhvervelse af metastatisk potentiale kunne forekomme meget tidligt i tumorprogression, således forbundet med dårlige onkologiske resultater, og den indledende biologiske funktion er mere tilbøjelige til at bestemme potentialet for fjern metastase under kræftprogression snarere end den akkumulerede metastatiske evne (29).
desuden er resultaterne af vores undersøgelse af klinisk betydning. I øjeblikket, fase i rektal kræft behandles med radikal kirurgisk resektion alene på grund af relativt gunstige onkologiske resultater. 10-15% af patienterne udvikle tumorgenfald efter radikal resektion (30, 31). I den foreliggende undersøgelse, vi tilfældigvis identificere en undergruppe af fase T1 rektal kræft med meget dårlig prognose sammenlignet med resten af fase i rektal kræft, hvilket betyder, at disse fase T1 rektal kræft med involvering af præoperativ serum cea elevation bør fange mere opmærksomhed af onkologer.
der er dog to begrænsninger i vores undersøgelse. På den ene side inkluderede denne undersøgelse ikke nogle kendte prognostiske faktorer for rektal kræft i vores analyser, herunder mikrosatellit ustabilitetsstatus og postoperative komplikationer, som ikke var tilgængelige fra SEER-databasen og muligvis kunne indføre forstyrrelser til en vis grad. Vi kan ikke angive intervaller og middelværdier for CEA i begge grupper. På den anden side var den nuværende undersøgelse retrospektiv snarere end baseret på potentielle data. Derfor skal vores fund stadig valideres i andre kohorter, især i store prospektive kliniske studier.
afslutningsvis viser vores undersøgelse, at stadium T1 rektal kræft, når det er involveret i præoperativ serum cea elevation, kan være et surrogat af biologisk aggressiv sygdom og korrelere med ugunstigt OS og CSS. Desuden fortjener denne undergruppe af rektal kræft mere klinisk opmærksomhed hos onkologer. Vores resultater, hvis valideret i fremtidige databasestudier, ville give en ny terapiidee til tidlig stadium rektal kræft.
data Tilgængelighedserklæring
datasættene genereret til denne undersøgelse er tilgængelige på anmodning til den tilsvarende forfatter.
etisk Erklæring
patienter i denne undersøgelse blev identificeret fra SEER-databasen, og godkendelsen til brug af dataene blev opnået gennem en anmodning indsendt til SEER-programmet. Godkendelsen fra det institutionelle revisionsudvalg var ikke nødvendig, fordi seer-databasen er offentligt tilgængelig.
Forfatterbidrag
SV og arbejdsgruppe har ydet et væsentligt og direkte bidrag til denne undersøgelse og godkendt det til indsendelse.
interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
anerkendelser
dette arbejde blev delvist støttet af medicinsk videnskab og teknologi udviklingsplan projekt af Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimater af forekomst og dødelighed over hele verden for 36 kræftformer i 185 lande. CA kræft J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
2. Guld P, Freedman så. Demonstration af tumorspecifikke antigener i humane coloncarcinomata ved immunologisk tolerance og absorptionsteknikker. Med. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
3. Goldstein MJ, Mitchell EP. Carcinoembryonisk antigen i iscenesættelse og opfølgning af patienter med kolorektal cancer. Kræft Invest. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
4. Det er en af de mest almindelige måder at gøre det på. Evaluering af den prognostiske rolle af forhøjede præoperative carcinoembryoniske antigenniveauer hos patienter med tyktarmskræft: resultater fra national cancer database. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori s, Ushijima M, et al. Forhøjet præoperativt serumcarcinoembrionisk antigenniveau kan være en effektiv indikator for behov for adjuverende kemoterapi efter potentielt helbredende resektion af fase II tyktarmskræft. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
6. HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Identifikation af patienter med højrisiko fase II tyktarmskræft til adjuverende behandling. Dis Kolon Endetarm. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-fra
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
7. Spindler BA, Thiels CA, Habermann EB, Kelley SR, Larson DV, et al. Inkorporering af CEA forbedrer risikostratificering i fase II tyktarmskræft. J Gastrointest Surg. (2017) 21: 770-7. doi: 10.1007 / s11605-017-3391-4
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
8. Liu P, Lian P, Luo D, Cai S, Li P, Li S. Kombination af carcinoembryonisk antigen med American Joint Committee on Cancer TNM staging system i rektal cancer: en virkelig verden og stor befolkningsbaseret undersøgelse. Onco Mål Ther. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
9. Tarantino I, Cerny T, Schmied BM, g Larrer U, Mieth M, Cerny T, et al. Forudsigelig værdi af CEA for overlevelse i fase i rektal kræft: en populationsbaseret tilbøjelighed score-matchet analyse. J Gastrointest Surg. (2016) 20: 1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Onkogen. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
12. Cai J, han J, Ke J, Han Y, Chen Y, et al. Adgang til ny prognostisk betydning af præoperativt carcinoembryonisk antigen i kolorektal cancer, der modtager tumorresektion: mere end positiv og negativ. Kræft Biomark. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed abstrakt | CrossRef Fuld tekst / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, F G, Richter R, et al. Processen med metastasering for brystkræft. Eur J Kræft. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
14. JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. Systemisk spredning er et tidligt skridt i brystkræft. kræftcelle. (2008) 13:58–68. doi: 10.1016 / j. ccr.2007.12.003
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
15. Podsypanina K, du YC, Jechlinger M, Beverly LJ, Hambardsumyan D, Varmus H. Såning og formering af ikke-transformerede musembrystceller i lungen. Videnskab. (2008) 321:1841–4. doi: 10.1126 / videnskab.1161621
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, granny M, Ahr a, Blankenstein TJ, et al. Fra latente disseminerede celler til åbenlys metastase: genetisk analyse af systemisk brystkræftprogression. Proc Natl Acad sci USA. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
17. Hvem, Chen K, Neville BA, Lin NU, Punglia RS. Effekt af meget lille tumorstørrelse på kræftspecifik dødelighed i knudepositiv brystkræft. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j. breastdis.2012.01.026
CrossRef Fuld Tekst / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigre N, Fielding LP. American joint committee on cancer prognostic factors consensus conference: kolorektal arbejdsgruppe. Kræft. (2015) 88:1739–57. doi: 10.1002 / (SICI)1097-0142(20000401)88:7<1739::støtte-CNCR30>3.0.CO;2-T
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Tumormarkører i kolorektal cancer: European Group on tumor Markers (EGTM) retningslinjer for klinisk brug. Eur J Kræft. (2007) 43:1348–60. doi: 10.1016 / j.ejca.2007.03.021
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 opdatering af anbefalinger til brug af tumormarkører i gastrointestinal cancer. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
21. Duffy MJ, Lamer R, Haglund C, Nicolini a, Kalousov Kurt m, Holubec L, et al. Tumormarkører i kolorektal cancer, gastrisk cancer og gastrointestinale stromale kræftformer: europæisk gruppe om tumormarkører 2014 retningslinjer opdatering. Int J Kræft. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen er. Præoperativt carcinoembryonisk antigen forudsiger resultater hos node-negative tyktarmskræftpatienter: en multivariat analyse af 572 patienter. J Am Coll Surg. (1997) 185: 55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
23. Hej, Oh BR, Kim HR, Kim YJ. Præoperativ carcinoembryonisk antigenniveau som en uafhængig prognostisk faktor i potentielt helbredende tyktarmskræft. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
24. Det er et af de mest populære områder i verden. Inkorporering af serumcarcinoembryoniske antigenniveauer i det prognostiske grupperingssystem for tyktarmskræft. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatekrig KD, Pingpank JF, et al. C-stadium i tyktarmskræft: implikationer af carcinoembryonisk antigenbiomarkør i iscenesættelse, prognose og ledelse. J Natl Kræft Inst. (2011) 103:689–97. doi: 10.1093 / jnci / djr078
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
26. Margalit O, Mamtani R, Yang YKS, Reiss KA, Golan T, Halpern N, et al. Vurdering af den prognostiske værdi af carcinoembryoniske antigenniveauer i fase i og II tyktarmskræft. Eur J Kræft. (2018) 94:1–5. doi: 10.1016 / j.ejca.2018.01.112
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
27. Tarantino I, Schmied BM, m, Merati-Kashani K, K, Schmied BM, et al. Forhøjet præoperativ CEA er forbundet med dårligere overlevelse hos patienter med rektal kræft i fase I-III. Br J Kræft. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
28. Norton L, Massage J. er kræft en sygdom med selvsåning? Nat Med. (2006) 12:875–8. doi: 10.1038 / nm0806-875
PubMed abstrakt / CrossRef fuldtekst / Google Scholar
29. Yu KD, Jiang YS, Chen S, Cao yg, Yu J, Shen YS, et al. Effekt af stor tumorstørrelse på kræftspecifik dødelighed i node-negativ brystkræft. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j. mayocp.2012.07.023
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Trin i rektal kræft: identifikation af højrisikopatienter. J Am Coll Surg. (1998) 186: 574-9; diskussion: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed abstrakt / CrossRef Fuld tekst / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, O ‘ Connell MJ, Begovic M, Et Al. Virkning af T og N Stadium og behandling på overlevelse og tilbagefald i adjuverende rektal cancer: en samlet analyse. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Abstrakt / CrossRef Fuld Tekst / Google Scholar