Hvad er colony PCR?
Colony PCR er en hurtig PCR-metode med høj kapacitet til bestemmelse af tilstedeværelsen eller fraværet af det indsatte DNA i plasmid direkte fra bakteriekolonierne.
molekylær kloning er en af de mest populære metoder til DNA-transformation siden længe. For at bestemme tilstedeværelsen eller fraværet af DNA-indsatsen er vi imidlertid nødt til at udføre transformationseksperimenter.
Colony PCR er en ny metode, hvor vi ved at designe de indsatte DNA-specifikke primere kan identificere, om vores DNA af interesse er indsat i plasmidet eller ej.
det er dog ikke så simpelt som vi diskuterer.
i denne artikel vil vi fokusere på kolonien PCR især, princippet om kolonien PCR, dens fordele og begrænsninger.
For det er vi nødt til at forstå flere udtryk og emner. Vi starter vores emne fra det grundlæggende. Indholdet af artiklen er,
centrale emner:
“et plasmid er det bakterielle cirkulære DNA, som replikerer uafhængigt af bakteriekromosomet og anvendes til genmanipulation og genoverførsel.”
genetisk kloning er et traditionelt molekylærgenetisk værktøj, der er brugt siden længe i laboratorierne. Kort sagt, i genkloningen indsættes genet af vores interesse i plasmidet gennem kunstige midler. Dette DNA replikeres uafhængigt af det bakterielle kromosom.
plasmider bruges faktisk til at generere mange kopier af korte segmenter af DNA. Fordi bakterier replikerer hurtigere end nogen andre organismer, kan vi generere mange kopier af genet af vores interesse ved at indsætte det i bakterieplasmidet.
F-plasmid, Col-plasmid, nedbrydeligt plasmid og resistensplasmid er flere almindelige typer plasmider, der findes i bakterier.
desuden kan plasmidet fungere som en molekylær bærer, der overfører korte DNA-segmenter fra en celle til en anden celle.
vi har dækket en fantastisk dybdegående artikel om plasmid DNA. Læs det her: Plasmid DNA-struktur, funktion, Isolation og applikationer.
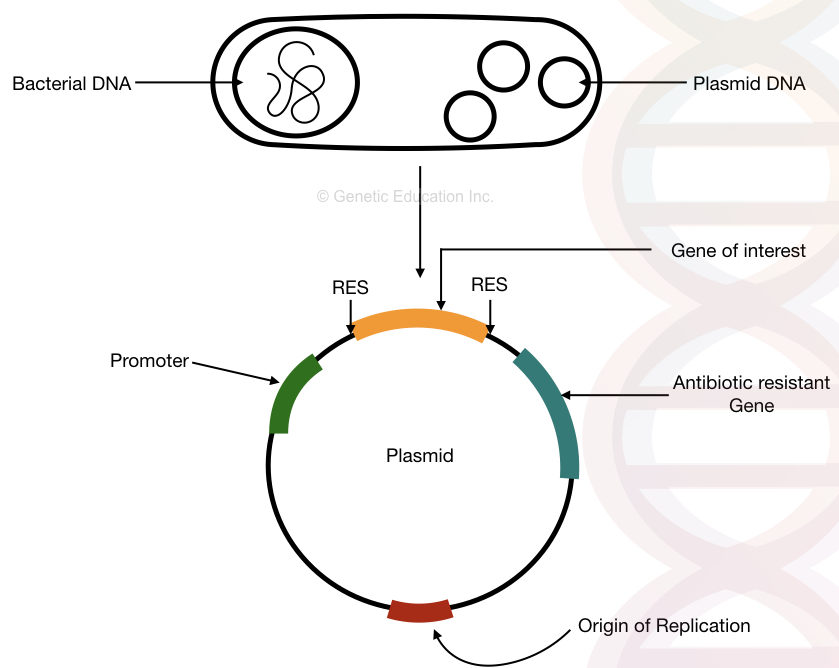
strukturen af det bakterielle plasmid DNA med, oprindelsen af replikation, antibiotikaresistensgen, promotor og gen af interesse.
bortset fra bakterier indeholder flere andre prokaryoter også plasmid-DNA. Plasmidets hovedfunktion i bakterier er for deres overlevelse under de barske forhold.
da plasmidet overfører gen af vores interesse, er det meget vigtigt at afgøre, om vores gen af interesse er indsat eller ej i plasmidet.
til det kan vi bruge flere metoder såsom PCR og mikrobiel dyrkning.
Platning af kolonierne tager mere tid, og metodens følsomhed er heller ikke god. Risikoen for forurening er altid høj i bakteriekulturmetoder.
så resultaterne er ikke korrekte.
vores PCR hjælper også her. Ved hjælp af colony PCR-metoden kan en DNA-indsats bestemmes eller identificeres.
- Sådan oprettes et DNA-ekstraktionslaboratorium: en omfattende guide (kemikalier, instrumenter og andre værktøjer).
- kromosom 6p-sletning: en grund til ingen smerte, ingen sult og ingen søvn
Hvad er koloni PCR?
koloni PCR er modifikationen af den konventionelle PCR, hvor bakteriekolonierne direkte anvendes som en PCR-skabelon.
plasmid-DNA ‘et, der indeholder DNA’ et af vores interesse, forstærkes under de cyklisk-temperaturafhængige forhold.
den grafiske repræsentation af kolonien PCR er vist i nedenstående figur,
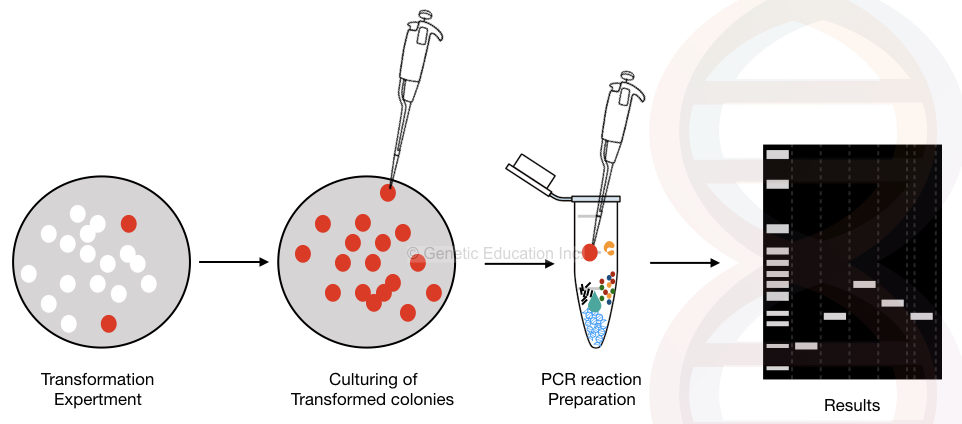
den generelle oversigt over koloniens PCR-metode.
princippet om koloni PCR:
den bakteriekoloni, der indeholder plasmidet, kan forstærkes direkte ved hjælp af to sæt primere. Indsatsspecifikke primere, som forstærker indsættelsessekvensen og vektorspecifikke flankerende primere, som forstærker plasmid-DNA andet end det indsatte DNA (flankerende regioner på begge sider af indsatsen).
ved at bruge indsatsens flankerende primere (som forstærker resten af DNA ‘ et) kan størrelsen af vores DNA-indsats bestemmes.
en bakteriekoloni plukkes og tilsættes direkte i masterblandingen, der indeholder alle PCR-reagenserne. Ved at tilføje et indledende opvarmningstrin til PCR kommer plasmid-DNA ‘ et ud fra bakteriecellen og forstærkes i reaktionen.
dette er det grundlæggende princip i kolonien PCR, men det kan ændres afhængigt af kravene.
protokollen for koloni PCR:
kolonien PCR er en af de fremragende modifikationer af den konventionelle PCR. I stedet for skabelon-DNA tilsættes bakteriekolonierne direkte til reaktionen. Derudover tilsættes DNA-polymerase, primere, PCR-reaktionsbuffer og DD/H i PCR-reaktionen også.
her i kolonien PCR er udvælgelsen af primere meget vigtig. Udvælgelsen af primere afhænger også af formålet med vores eksperiment.
hvilken type information ønsker vi fra vores colony PCR-eksperiment?
-
-
- oplysninger om tilstedeværelsen eller fraværet af indsatsen kun.
- oplysninger om indsatsens størrelse.
- oplysninger om indsatsens retning.
-
afhængig af, at forskellige PCR-primere er designet til kolonien PCR.
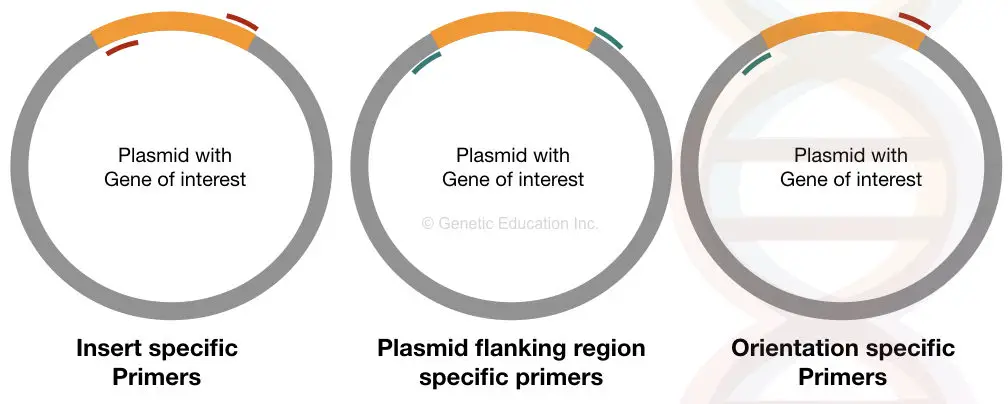
indsatsspecifikke primere binder til den specifikke placering på begge sider af det indsatte DNA af vores interesse. Hvis det overføres korrekt til plasmidet, kan disse primere binde til det, ellers kan det ikke være i stand til at binde.
dette primersæt giver information om tilstedeværelsen eller fraværet af indsatsen.
Orienteringsspecifikke primere er unikke primere, hvor en primer binder inde i indsatsen, og en anden primer binder til plasmid-DNA-sekvensen (anden sekvens end indsæt-DNA).
denne type primersæt giver information om orienteringen af indsat DNA af vores interesse. Hvis vores indsæt-DNA ikke er korrekt ligeret i vektoren, kan primeren, der er specifik for den side af sekvensen, ikke binde, og vi får ikke forstærkningen.
Plasmidspecifikke primere er også lige så vigtige som de orienteringsspecifikke primere. Dette sæt primere er designet fra det flankerende område af indsatsen, der binder til ydersiden af DNA ‘ et af vores interesse.
dette sæt primer hjælper med at bestemme indsatsens størrelse. Det udvider andre regioner end indsæt DNA.
PCR-reaktionen til udførelse af kolonien PCR er som følger,
| komponent | koncentration | mængde |
| Masterblanding (speciel
til kolonien PCR) |
1 | 12 |
| PCR – reaktionsbuffer
med 2 mm MgCl2* |
1 | 5 |
| fremad primer | 10pM | 1 liter |
| omvendt primer | 10pM | 1 liter |
| Supernatant | 3 | |
| vand | 3 kr | |
| i alt | ——— | 25 kr |
proceduren for koloni PCR:
nå, kolonien PCR behøver ikke ekstraheret DNA.
vi udvinder ikke DNA her. I stedet anvendes flere andre metoder til at øge reaktionens følsomhed.
Ok, Hvorfor vi ikke udvinder DNA til plasmid DNA?
fordi årsagen er enkel, er cellemembranen i bakteriecellen meget glat.
vi havde allerede diskuteret cellemembranen i bakteriecellen. Læs det her: Forskellige typer DNA-ekstraktionsmetoder
en bakterie indeholder blød cellemembran, som let kan lyseres ved opvarmning eller centrifugering af den i høj hastighed.
vi har heller ikke brug for det bakterielle eget DNA. Det cirkulerende cirkulære plasmid er til stede i bakteriens cytoplasma, derfor er der ikke behov for yderligere rensningstrin. Ved at bryde cellemembranen er vores skabelon-DNA klar til amplifikationen.
Ok, lad os hurtigt gennemgå metoden til opnåelse af godt plasmid-DNA.
ved hjælp af den sterile plukker skal du vælge flere bakteriekolonier og overføre den til Eppendorf-røret.
Tilføj nu te buffer i det og bland det godt. Du kan også bruge D/H.
opvarm prøven i det kogende vandbad i 20 minutter.
vend forsigtigt det.
centrifuger prøven ved høj hastighed i 2 minutter.
Overfør supernatanten til et andet rør og brug det som en skabelon-DNA.
der tilsættes en 20-liters prøve til reaktionen.
yderligere oplysninger:
hvorfor supernatant og ikke pellet?
DNA er et biomolekyle af livet. Plasmid-DNA ‘ et er endnu mindre end det bakterielle nukleare DNA. Den indeholder kun flere gener på op til 1000 BP til 20.000 bp.
ved kun at centrifugere det kommer det lettere plasmid-DNA ud af cellen og aflejres i supernatanten, mens pelleten indeholder proteiner og nukleart DNA, så vi bruger det ikke.
nu kommer til det punkt.
vores plasmid er klar til amplifikation.
i en anden metode,
brug bakteriekolonien direkte.
denne metode er en kombination af Hotstart PCR og colony PCR.
bakteriekolonierne plukkes og tilsættes til PCR-reaktionsrøret.
rørene placeres i PCR-maskinen. Et yderligere opvarmningstrin tilføjes.
ved at opvarme det 5 til 7 minutter kommer plasmid-DNA ‘ et ud af cellen.
nu forstærker de indsatsspecifikke primere det DNA, vi indsatte. Og de flankerende primere forstærker resten af DNA ‘ et.
forstærkningen udføres i 20 til 25 cyklusser. Cykelbetingelserne for kolonien PCR er angivet nedenfor,
| PCR-trin | Initial denaturering | denaturering | Annealing | udvidelse | endelig udvidelse |
| temperatur | 95 C | 95 C | 55-65 C | 72 C | 72 C |
| tid | 3min | 10 sek | 45 sek | 50 sek | 5 min |
| ——- | ——- | 25 cykler | —– | ——- |
Læs den interessante artikel om konventionel PCR: en komplet Guide til polymerasekædereaktionen
tips til forbedring:
Brug kun et par kolonier, da mange kolonier øger chancen for de ikke-specifikke bindinger.
brug positiv kontrol og negativ contol.
som en positiv kontrol anvendte den flankerende primer, selvom indsatsen ikke er til stede, giver PCR-reaktionen DNA-bånd af plasmid-DNA ‘ et, hvilket indikerer, at den reaktion, vi forberedte, er korrekt.
som en negativ kontrol skal du bruge det ikke-transformerede plasmid (plasmid uden indsæt DNA), dette plasmid-DNA forstærkes kun, hvis indsatsen er til stede.
som en indsats bruger korte DNA-sekvenser, længere DNA-sekvenser øger chancen for ikke-specifikke bindinger og PCR-reaktionssvigt.
brug desuden kortere PCR-programmer.
den vigtigste anvendelse af koloni-PCR er identifikation af korrekt ligering og indsættelse af Indsæt DNA i bakterier såvel som gærplasmid.
efter afslutningen af koloniens PCR-reaktion køres PCR-produkterne på 2% agarosegelen. Resultaterne af eksperimentet er vist i nedenstående figur,
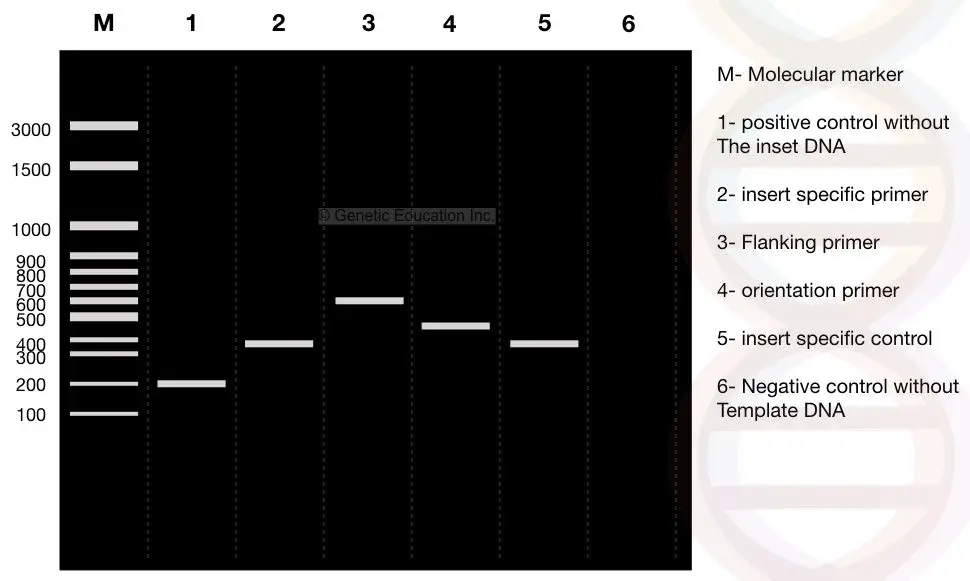
Observer nu omhyggeligt resultaterne, M er 3000bp molekylær DNA markør. Antag, at DNA ‘ et af vores interesse, “indsæt” er et 400bp fragment, der indsættes i plasmidet.
se Bane 2: 400 bp-fragmentet af vores indsats.
vi designede flankerende primere 100bp væk fra begge sider af indsatsen. Hvis den flankerende primer forstærker DNA ‘ et sammen med indsatsen, er produktet 600 bp, se Bane 3 (400 bp af Indsæt DNA + 200 bp flankerende region).
se Bane 1, Det er en positiv kontrol uden indsatsen eller et normalt plasmid uden det transformerede DNA. Derfor forstærker de flankerende primere kun 200 BP DNA.
se Bane 1, 200bp fragment af DNA uden indsats (positiv kontrol).
følg bane 4. Bane 4 er resultatet af de orienteringsspecifikke primere. Den orienteringsspecifikke primer er en kombination af indsatsspecifik primer og flankerende regionspecifik primer.
en primer fra indsæt DNA og en primer fra den flankerende regionspecifikke primer vælges til orienteringsspecifik primerforstærkning.
derfor forstærkes 100 BP fragment fra den flankerende region primer og 400bp fra indsat DNA, og 500 bp fragment af DNA observeres i bane 4.
bane 5 er den indsatsspecifikke kontrol, der giver 400 BP DNA-fragment.
bane 6 er den negative kontrol uden skabelonen. Ved at bruge negativ kontrol kan enhver forurening identificeres. Reaktionsrøret indeholder alle ingredienserne undtagen skabelonen. Så ideelt set er der ingen DNA-bånd til stede i denne bane.
hvis der observeres et DNA-bånd, er prøven forurenet.
fordele ved koloni PCR:
- teknikken er hurtig og omkostningseffektiv.
- yderligere er nøjagtigheden og specificiteten af teknikken højere.
- opsætningen er enkel ligesom den konventionelle PCR, DNA-ekstraktion og plasmidrensning som besværlige trin er ikke påkrævet.
- intet behov for restriktion fordøjelse til identifikation af Indsæt DNA.
- hele eksperimentet kan afsluttes inden for 90 minutter.
ulemper ved koloni PCR:
- metoden er omkostningseffektiv, hurtig og pålidelig, men enhver mutation i indsatsen kan ikke detekteres.
- desuden kan sekvensinformationen ikke opnås ved kolonien PCR. vi skal gøre sekventering for at bekræfte DNA-transformationen.
- chancen for falske positive resultater er høj.
Læs mere;
- hvad er en multipleks PCR?
efter afslutningen af eksperimentet sendes prøven til sekventeringen, hvor DNA-sekvensen af vores interesse kan bestemmes.
vi kan endda gøre multipleks PCR ved at kombinere både indsæt specifikke primere og plasmidspecifikke primere.
konklusion:
selvom kolonien PCR er det bedste valg til identifikation af genoverførsel, er den eneste koloni PCR-teknik ikke tilstrækkelig til at fortolke resultaterne. Det kan være muligt, at nogle af de mutationer, der er til stede i indsatsen, der ikke kan detekteres af PCR.
til bekræftelse af resultaterne kræves DNA-sekventering. Efter bestemmelse af sekvensrækkefølgen kan vi sige, om vores gen af interesse er indsat korrekt eller ej.