Institut for Skabelsesforskning
 et af de mere populære argumenter, der bruges til mennesker, der angiveligt udvikler sig fra aber, er kendt som kromosomfusion. Drivkraften for dette koncept er det evolutionære problem, at aber har et ekstra par kromosomer-mennesker har 46, mens aber har 48. Hvis mennesker udviklede sig fra en abelignende væsen for kun tre til seks millioner år siden, en simpel blip i den store plan i den evolutionære historie, Hvorfor har mennesker og aber denne uoverensstemmelse?
et af de mere populære argumenter, der bruges til mennesker, der angiveligt udvikler sig fra aber, er kendt som kromosomfusion. Drivkraften for dette koncept er det evolutionære problem, at aber har et ekstra par kromosomer-mennesker har 46, mens aber har 48. Hvis mennesker udviklede sig fra en abelignende væsen for kun tre til seks millioner år siden, en simpel blip i den store plan i den evolutionære historie, Hvorfor har mennesker og aber denne uoverensstemmelse?
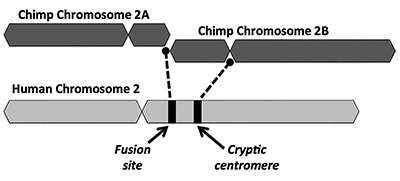
den evolutionære løsning foreslår, at en end-to-end fusion af to små abelignende kromosomer (kaldet 2A og 2b) producerede humant kromosom 2 (Figur 1). Begrebet fusion opstod først i 1982, da forskere undersøgte lighederne mellem humane og ape-kromosomer under et mikroskop. Mens teknikken var noget rå, var det nok til at få ideen til at gå.1
Det Såkaldte Fusionssted
den første egentlige DNA-signatur af en mulig fusionshændelse blev opdaget i 1991 på humant kromosom nummer 2.2 forskere fandt en lille, forvirret klynge af telomerlignende slutsekvenser, der vagt lignede en mulig fusion. Telomerer er en seksbasesekvens af DNA-bogstaverne TTAGGG gentaget igen og igen i enderne af kromosomer.
fusionssignaturen var dog noget af en gåde baseret på de virkelige fusioner, der lejlighedsvis forekommer i naturen. Alle dokumenterede fusioner hos levende dyr involverer en bestemt type sekvens kaldet satellit-DNA (satDNA) placeret i kromosomer og fundet i brud og fusioner.3-5 fusionssignaturen på humant kromosom 2 manglede denne fortællende satDNA.6
et andet problem er fusionsstedets lille størrelse, som kun er 798 DNA-bogstaver lange. Telomer-sekvenser i enderne af kromosomer er 5.000 til 15.000 baser lange. Hvis to kromosomer var smeltet, skulle du se en smeltet telomer signatur på 10.000 til 30.000 baser lang—ikke 798.
ikke kun er den lille størrelse et problem for fusionshistorien, signaturen repræsenterer ikke rigtig en klar fusion af telomerer. Figur 2 viser DNA-bogstaverne på 798-base fusionsstedet med de seks-base (DNA-bogstav) intakte telomer-sekvenser fremhævet med fed skrift. Når fusionssekvensen sammenlignes med en uberørt fusionssignatur af samme størrelse, er den kun 70% identisk samlet.

sekulære forskere har påpeget denne uoverensstemmelse og har mærket fusionsstedet som markant “degenereret.”7 i betragtning af den standard teoretiske model for menneskelig evolution, bør den være omkring 98 til 99% identisk, ikke 70%. Forskerne, der beskriver denne opdagelse, kommenterede, “Head-to-head arrays af gentagelser på fusionsstedet er degenereret betydeligt (14%) fra de næsten perfekte arrays af (TTAGGG)n fundet ved telomerer” og stillede det relevante spørgsmål “hvis fusionen fandt sted inden for de telomere gentagelsesarrays mindre end ~6 Mya, hvorfor er arrays på fusionsstedet så degenererede?”7 Det skal bemærkes, at den 14% degeneration, der er Citeret af forfatterne, henviser til korruptionen af kun seksbasesekvenserne selv, ikke hele 798 baserne.
Fusionsstedet inde i et gen?
det mest bemærkelsesværdige anti-evolutionære fund om fusionsstedet viste sig at være dets placering og hvad det faktisk gør. Denne opdagelse opstod, mens jeg læste forskningspapiret, der rapporterede en detaljeret analyse af 614.000 baser af DNA-sekvens omkring det påståede fusionssted. Jeg bemærkede i en af figurerne, at fusionsstedet var placeret inde i et gen, og ganske bemærkelsesværdigt blev denne underlighed ikke engang anerkendt i papirets tekst.8
et fund som dette er meget bemærkelsesværdigt. Måske ville dette stykke information have været neglen i den evolutionære Kiste, så at sige, hvorfor forskerne nægtede at diskutere det. Denne store anomali inspirerede mig til at give fusionsstedet en meget nærmere undersøgelse. Dette papir blev offentliggjort i 2002, og jeg tog mærke til det i 2013. En enorm mængde data om strukturen og funktionen af det menneskelige genom var blevet offentliggjort i mellemtiden, og der var sandsynligvis meget mere til historien, der skulle afdækkes.
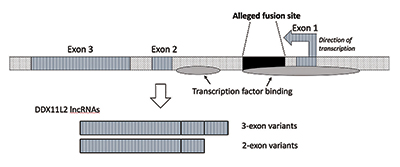
da jeg udførte yderligere forskning, bekræftede jeg, at fusionsstedet var placeret inde i et RNA-helicase-gen, der nu hedder DDKS11L2. De fleste gener i planter og dyr har deres kodende segmenter i stykker kaldet eksoner, så de alternativt kan splejses. Baseret på tilsætning eller udelukkelse af eksoner kan gener producere en række forskellige produkter. De mellemliggende regioner mellem eksoner kaldes introner, som ofte indeholder en række signaler og afbrydere, der styrer genfunktionen. Det påståede fusionssted er placeret inde i den første intron af ddks11l2-genet (figur 3).9
DNA-molekylet er dobbeltstrenget med en plus-streng og en minus-streng. Det blev konstrueret på denne måde for at maksimere informationstætheden og samtidig øge effektiviteten og funktionen. Som følge heraf er der gener, der løber i forskellige retninger på de modsatte tråde. Som det viser sig, er ddks11l2-genet kodet på minusstrengen. Fordi gener hos mennesker er som svejse hærknive og kan producere en række RNA ‘ er, producerer det i tilfælde af ddks11l2-genet korte varianter bestående af to eksoner og lange varianter med tre (figur 3).9
Fusionsstedet er en Genpromotor
hvad kan dette ddks11l2-gen gøre? Min forskning viste, at det er udtrykt i mindst 255 forskellige celle-eller vævstyper.9 Det er også co-udtrykt (tændt på samme tid) med en række andre gener og er forbundet med processer forbundet med cellesignalering i den ekstracellulære Matrice og blodcelleproduktion. Placeringen af den såkaldte fusionssekvens inde i et funktionelt gen forbundet med genetikken i en række cellulære processer afviser stærkt tanken om, at det er det utilsigtede biprodukt af en head-to-head telomer fusion. Gener er ikke dannet af katastrofale kromosomale fusioner!
endnu mere forbløffende er, at fusionsstedet selv er funktionelt og tjener et vigtigt konstrueret formål. Stedet fungerer faktisk som en omskifter til styring af genaktivitet. I denne henseende viste et væld af biokemiske data, at 12 forskellige proteiner kaldet transkriptionsfaktorer regulerer dette segment af genet. En af disse er ingen ringere end RNA-polymerase II, det vigtigste middel, der kopierer RNA-molekyler fra DNA i en proces kaldet transkription. Yderligere støtte til denne opdagelse er det faktum, at den egentlige transkriptionsproces initierer inden for regionen af det såkaldte fusionssted.
teknisk set vil vi kalde aktiviteten i det påståede fusionssted en promotorregion. Promotorer er de vigtigste kontakter i begyndelsen af gener, der tænder dem, og er også hvor RNA-polymerasen begynder at skabe et RNA. Mange gener har alternative promotorer som ddks11l2 genet.
der er faktisk to områder af transkriptionsfaktorbinding i ddks11l2 genet. Den første er i promotoren direkte foran den første ekson, og den anden er i den første intron svarende til fusionsstedssekvensen. Ikke alene er selve ddks11l2-genet komplekst kontrolleret, idet den påståede fusionssekvens spiller en nøglerolle, men selv de producerede RNA-transkripter er meget indviklede. RNA ‘erne selv indeholder en bred vifte af bindings-og kontrolsteder for en klasse af små regulatoriske molekyler kaldet microRNA’ er.9
funktionelle interne telomer-sekvenser er overalt i genomet
tilstedeværelsen af internt placeret telomer-sekvens findes overalt i det menneskelige genom. Disse tilsyneladende out-of-place telomer gentagelser er blevet døbt interstitielle telomerer. Tilstedeværelsen af disse sekvenser udgør en anden udfordring for fusionsiteideen. Det er en kendsgerning, at meget få af telomer-gentagelserne på fusionsstedet forekommer i tandem. Som bemærket i figur 2 indeholder sekvensen af 798-base fusionsstedet kun nogle få tilfælde, hvor to gentagelser faktisk er i tandem og ingen, der har tre gentagelser eller mere. Imidlertid, der er mange andre interstitielle telomersteder overalt i det menneskelige genom, hvor gentagelserne forekommer i perfekt tandem tre til ti gange eller mere.10-11
selv ud over deres rolle i enderne af kromosomer ser det ud til, at interstitielle telomere gentagelser kan tjene en vigtig funktion i genomet relateret til genekspression. I et nyligt forskningsprojekt identificerede jeg telomer-gentagelser over hele det menneskelige genom og krydsede derefter deres genomiske placeringer med en mangfoldighed af datasæt indeholdende funktionel biokemisk information til genaktivitet.12 bogstaveligt talt tusinder af interne telomere gentagelser på tværs af genomet var direkte forbundet med kendetegnene for genekspression. Den samme type transkriptionsfaktorbinding og genaktivitet, der forekom på det påståede fusionssted, forekom også genomomfattende ved adskillige andre interstitielle telomere gentagelser. Det er klart, at disse DNA-funktioner ikke er evolutionsulykker, men målrettet og intelligent designet funktionel kode.
falske kryptiske Centromere inde i et gen
et andet nøgleproblem med fusionsmodellen er manglen på levedygtige beviser for en underskrift af en ekstra centromerregion. Centromerer er sektioner af kromosomer, ofte på centrale steder, der spiller nøgleroller under celledeling. Som afbildet i Figur 1 ville det nydannede kimære kromosom have haft to centromere-steder umiddelbart efter den påståede hoved-til-hoved-fusion af de to kromosomer. I et sådant tilfælde ville en af centromererne være funktionel, mens den anden ville være deaktiveret. Tilstedeværelsen af to aktive centromerer er dårlige nyheder for kromosomer og vil føre til dysfunktion og celleødelæggelse.
interessant nok er beviset for en kryptisk (handicappet) centromere på humant kromosom 2 endnu svagere end for et telomerrig fusionssted. Evolutionister forklarer manglen på en klart skelnelig ikke-funktionel sekundær centromere ved at argumentere for, at en anden centromere hurtigt ville være blevet valgt imod. Derefter ville den handicappede centromere have forværret sig over tid, da der ikke var nogen funktionelle begrænsninger placeret på det længere ved at gøre noget nyttigt i genomet.
imidlertid er beviset for en anden restcentromere på ethvert stadium af sekvensdegeneration problematisk for det evolutionære paradigme. Funktionelle centromere-sekvenser er sammensat af en gentagen type DNA kaldet alphoid-sekvenser, hvor hver alphoid-gentagelse er omkring 171 baser lang. Nogle typer af alphoid gentagelser findes over hele genomet, mens andre er specifikke for centromerer. Strukturen af sekvenserne fundet på det kryptiske centromersted på humant kromosom 2 stemmer ikke overens med dem, der er forbundet med funktionelle humane centromerer.13 endnu værre for den evolutionære model er, at de ikke har nogen meget lignende modstykker i chimpanse—genomet-de er menneskespecifikke.13
den påståede fossile centromere er også usædvanligt lille sammenlignet med en rigtig. Størrelsen af en normal menneskelig centromere varierer i længde mellem 250.000 og 5.000.000 baser.14 den påståede kryptiske centromere er kun 41.608 baser lang, men det er også vigtigt at bemærke, at der er tre forskellige regioner af det, der ikke engang er alphoid gentagelser.15 to af disse kaldes retroelementer, hvor den ene er en lpa3/LINE gentagelse 5.957 baser lang og den anden et SVA-e element med 2.571 baser. Når vi trækker indsætningerne af disse ikke-alfoide sekvenser, giver den en længde på kun 33.080 baser, hvilket er en brøkdel af længden af en reel centromere.
det mest alvorlige evolutionære problem med ideen om en fossil centromere er dog, at den ligesom det påståede fusionssted er placeret inde i et gen. Den påståede kryptiske centromere er placeret inde i ANKRD30BL-genet, og dens sekvens spænder over både intron-og eksonregioner i genet.12,15
faktisk koder den del af den påståede fossile centromersekvens, der lander inde i en ekson, faktisk for aminosyrer i det resulterende gens protein. Genet producerer et protein, der menes at være involveret i interaktionen mellem det strukturelle netværk af proteiner inde i cellen kaldet cytoskelet i forbindelse med receptorproteiner indlejret i cellemembranen.16 det faktum, at den såkaldte fossile eller kryptiske centromere er en funktionel region inde i et vigtigt proteinkodende gen, afviser fuldstændigt tanken om, at det er en nedlagt centromere.
konklusion: Ingen Fusion
på grund af de forvirrede signaturer og små størrelser af de påståede fusions-og fossile centromere-steder er det meget tvivlsomt, at deres sekvens evolutionært stammer fra en gammel kromosomfusion. Ikke kun det, de repræsenterer funktionel sekvens inde i gener. Det påståede fusionssted er en vigtig genetisk omskifter kaldet en promotor inde i ddks11l2 langt ikke-kodende RNA-gen, og den såkaldte fossile centromere indeholder både kodende og ikke-kodende sekvens inde i et stort ankyrin-gentaget proteinkodende gen.
dette er en ubestridelig dobbelthumling mod hele den mytiske fusionsidee, der fuldstændig ødelægger dens gyldighed. Den overvældende videnskabelige konklusion er, at fusionen aldrig skete.
- Yunis, J. J. og O. Prakash. 1982. Menneskets oprindelse: en kromosomal billedlig arv. Videnskab. 215 (4539): 1525-1530.
- Ijdo, J. V. et al. 1991. Oprindelse af humant kromosom 2: en forfædres telomer–telomerfusion. Forløbet af National Academy of Sciences. 88 (20): 9051-9055.
- Chaves, R. et al. 2003. Molekylær cytogenetisk analyse og centromerisk satellitorganisation af en roman 8;11 translokation hos får: et muligt mellemprodukt i biarmed kromosomudvikling. Pattedyrs Genom. 14 (10): 706-710.
- Tsipouri, V. et al. 2008. Sammenlignende sekvensanalyser afslører steder med forfædres kromosomale fusioner i Det Indiske muntjac-genom. Genombiologi. 9 (10): R155.
- Adega, F., H. Guedes-Pinto og R. Chaves. 2009. Satellit-DNA i karyotype-udviklingen af husdyr-kliniske overvejelser. Cytogenetisk og genomforskning. 126 (1-2): 12-20.
- Tomkins, J. P. og J. Bergman. 2011. Telomerer: implikationer for aldring og bevis for intelligent design. Tidsskrift for oprettelse. 25 (1): 86-97.
- Fan, Y. et al. 2002. Genomisk struktur og udvikling af det forfædres Kromosomfusionssted i 2K13–2k14.1 og Paralogøse regioner på andre humane kromosomer. Genomforskning. 12 (11): 1651-1662.
- Fan, Y. et al. 2002. Genindhold og funktion af det forfædres Kromosomfusionssted i humant kromosom 2K13–2k14.1 og Paralogiske regioner. Genomforskning. 12 (11): 1663-1672.
- Tomkins, J. P. 2013. Påstået humant kromosom 2″ fusionssted ” koder for et aktivt DNA—bindende domæne inde i en kompleks og stærkt udtrykt Gennegerende Fusion. Svar Forskning Tidsskrift. 6: 367-375.
- C. M., S. G. Nergadse og E. Giulotto. 2001. Humane intrachromosomale telomerlignende gentagelser: sekvensorganisation og oprindelsesmekanismer. Kromosomer. 110: 75-82.
- Ruis-Herrera, A. et al. 2008. Telomer gentager langt fra enderne: oprindelsesmekanismer og rolle i evolutionen. Cytogenetisk og genomforskning. 122 (3-4): 219-228.
- Tomkins, J. P. 2018. Kombinatoriske genomiske data tilbageviser det humane kromosom 2 evolutionær fusion og bygger en model for funktionelt design til interstitielle telomere gentagelser. Under den ottende internationale konference om kreationisme. J. H. Hvidmore, Red. Pittsburgh, PA: skabelse videnskab stipendium, 222-228.
- Tomkins, J. og J. Bergman. 2011. Kromosom 2-fusionsmodellen for menneskelig evolution-del 2: genanalyse af de genomiske data. Tidsskrift for oprettelse. 25 (2): 111-117.
- Aldrup-Macdonald, M. E. Og B. A. Sullivan. 2014. Fortid, nutid og fremtid for Human Centromere Genomics. Gener (Basel). 5 (1): 33-50.
- Tomkins, J. P. 2017. Debunking the Debunkers: et svar på kritik og forvirring vedrørende afvisning af det humane kromosom 2-Fusion. Svar Forskning Tidsskrift. 10: 45-54.
- Voronin, D. A. og E. V. Kiseleva. 2008. Funktionel rolle af proteiner indeholdende Ankyrin gentagelser. Celle-og vævsbiologi. 49 (12): 989-999.
* Dr. Tomkins er Life Sciences direktør ved Institut for Creation Research og fik sin ph.d. i genetik fra Clemson University.