Klassificering af humant blod / Immunologi
annoncer:
humant blod kan klassificeres i forskellige blodgruppesystemer, f.eks.
alle disse blodgrupper hos mennesker er under genetisk kontrol, idet hver række blodgrupper er under kontrol af gener på et enkelt sted eller af gener, der er tæt forbundet og opfører sig i arvelighed, som om de var på et enkelt sted.
- ABO blodgruppe:
- genetik af ABO-blodgruppen:
- underinddelinger af A -, AB-og B-blodgrupper:
- Arvemåde:
- særlige genetiske tilfælde af ABO – blodgruppe:
- mn-blodgrupper:
- Rh-faktor:
- klinisk betydning:
- detaljer om Rh faktor:
- genetisk kontrol af Antigenstruktur:
- en skematisk sammenligning af Viener-og Fisher-Race-begreberne:
- Vævekonceptet Rh:
- Fischer-Race-begrebet Rh:
- arv af Rh – Blodfaktorerne:
- betydningen af at udvikle det korrekte koncept for Rh-antigenernes genetiske forhold:
ABO blodgruppe:
hvis vi overvejer immunitetsreaktionerne i forbindelse med ABO-blodgruppen, finder vi, at nogle af dem indeholder ‘naturlige’ antistoffer mod nogle andre.
reklamer:
følgende er antistofindholdet i ABO – blodgruppen:

tilsvarende, hvis vi overvejer tilstedeværelsen af antigen i de røde blodlegemer fra forskellige Abo-blodgrupper, så finder vi: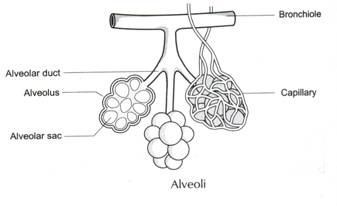
på grund af tilstedeværelsen af forskellige antigener og antistoffer i blodgrupperne af A, B,
annoncer:
AB og O, alle typer blod kan ikke blandes sammen på grund af deres agglutinationsreaktion som følger:

når der foretages en blodtransfusion, skader det ikke, hvis donorens blod indeholder antistoffer mod modtagerens for donorens blod er lille i mængde sammenlignet med det samlede volumen af modtagerens, og derfor fortyndes antistofferne.
men det ville gøre skade, hvis modtagerens blod havde antistofferne, da mængden af antistof nu er relativt stor. En person med blodgruppe O kunne for eksempel ikke være modtager af blod fra nogen anden gruppe end hans egen, da hans serum agglutinerer alle blodlegemer undtagen hans egne, skønt han måske er en donor for enhver gruppe, da ingen blod indeholder antistoffer mod hans blodlegemer.
genetik af ABO-blodgruppen:
vi ved ikke, hvilken af de fire blodgrupper der er den normale. I genetik er det generelt accepteret, at personer med normale træk er de mest talrige end i andre. For lettere forståelse, hvis vi betragter o-gruppen som den normale, opstod A-og B-gruppen fra O-gruppen som et resultat af to dominerende mutationer (en for hver gruppe), kan mutantgenet gives henholdsvis symbolerne A og B. Begge disse gener opstod på samme sted fra et af de normale gener i O-gruppen.
hvis vi betegner det normale gen ved hjælp af symbolet +, så tre gener +. A og B indtager det samme sted og er flere alleler. Da + gen er en recessiv, så O-gruppen skal være homosygøs for+/+, og da A-og B-mutantgenerne er dominerende, så kombinationerne for en gruppe enten A/A eller +/A og tilsvarende for B-gruppen, B/B eller +/B. blodgruppe AB er derimod altid
hybrid, A / B (Dette er et eksempel på den fænotypiske ekspression af co-Dominans).
nogle genetikere foreslog også, at arv af A, B, AB og O blodtype hos mennesker bestemmes af A-serie af tre allelomorfe gen, hvoraf jeg for hverken antigen, IA for antigen A, Ib for antigen B. Ia & Ib viser fuldstændig dominans over i.
underinddelinger af A -, AB-og B-blodgrupper:
annoncer:
blodlegemerne i en blodgruppe er opdelt i to undergrupper kendt som A1og A2, men af disse to undergrupper er A2 mindre almindelig. Det har vist sig, at A1-blodlegemer ikke agglutineres af A2-serum eller omvendt; men både A1-og A2-blodlegemer agglutineres af B-serum og O-serum.
det er også blevet yderligere bemærket, at yderligere to undergrupper af A (bortset fra A1 og A2) er blevet identificeret, som er A3 og a4men begge disse grupper er sjældnere end A2. Hver af A-undergrupperne bestemmes af et separat gen, og generne for alle de fire undergrupper er alleler.
tilsvarende indeholder gruppe B-serum mindst to slags antistoffer, en agglutinerer korpusklerne i både A1-og A2-gruppen og andre agglutinater kun A1. AB blodtype er også blevet opdelt i A1B, A2B, A3B og A4B.
så genet ‘i’ er en multipel allel (som bestemmer antigenproduktionen) og kan producere 15 genotyper og 10 fænotyper af blodgrupper, som er:
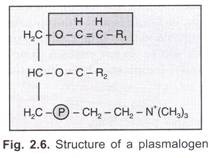
Arvemåde:
hvis begge forældre i en given familie er af O blodgruppe, skal alle børn af dem have O blodgruppe som deres forældre. Hvis begge forældre på den anden side er af en gruppe, og begge tilfældigvis er hybrid (a/+), kan de have nogle børn med O-blodgruppe.
så på denne måde, hvis vi kender blodgrupperne til et barn og hans/hendes mor, kan vi legitimt kræve eller teste den sandsynlige blodgruppe for barnets far.
følgende tabel er den opsummerede form medicolegal anvendelse af blodgrupperne :
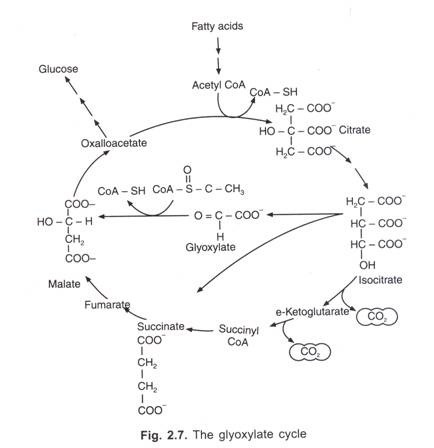
annoncer:
annoncer:
følgende tabel (tabel 13.1) er arvemåden for blodgruppe til børnene fra forældrene:
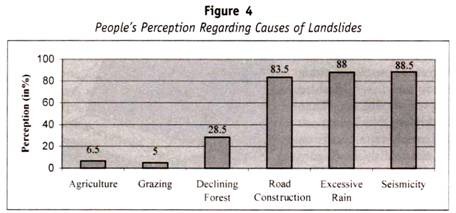
særlige genetiske tilfælde af ABO – blodgruppe:
det er blevet’ fundet, at nogle personer har A-eller B-antigener i deres kropsekretioner også (fra øjne, næse, spytkirtel og brystkirtel) og er kendt som sekretorer. Personer, der er sekretorer, har vandopløseligt antigen, som kan passere ud af de røde blodlegemer, og det er således til stede i kroppens sekretioner.
men i tilfælde af ikke-sekretorer er antigener kun alkoholopløselige og kan ikke opløses i sekretionerne. Så sekretorerne kan identificeres ved test på blodet såvel som på kroppens sekretioner. Denne sekretoregenskab arves som et dominerende gen ‘S’, mens den ikke-sekretoregenskab arves af den homosygøse recessive allel ‘s’. Det anslås, at næsten 77% af befolkningen i USA er sekretærer.
tilsvarende er et andet antigen kendt som ‘H’ antigen, også identificeret på erythrocytterne, som kan påvises ved agglutinationer af anti-H serum. Dette antigen menes at være et mellemprodukt mellem antigen A og B. Det dominerende gen H er ansvarlig for produktionen af H-antigen, og geotyperne er som følger :
det er interessant at bemærke, at de personer, hvis blod ikke giver nogen reaktion med Anti-A eller Anti-B eller Anti-h, tilhører meget sjælden gruppe og er kendt som “Bombay fænotype”, fordi det først blev beskrevet i en meget lille gruppe mennesker i Bombay city.
mn-blodgrupper:
forskellige menneskers blodlegemer kan indeholde enten den ene eller den anden eller både M og N, og disse antigener har ingen relation til ABO-blodgrupper. Det er en person af A-blodgruppe kan tilhøre nogen af de tre (M, N eller MN) mn blodgrupper. Genet, der er ansvarlig for produktionen af M-og N-antigener, er dominerende og er alleler.
reklamer:
det heterosygøse for M-og N-gen viste co-Dominans. Imidlertid forekommer disse tre klasser (M, N og MN) ikke i simpelt Mendelsk forhold i den generelle befolkning, og procentdelen af hver klasse varierer fra race til race. Mn-blodgruppen har ingen betydning i blodtransfusionen, men har fået medicolegal betydning f.eks. faderskabstest. Følgende tabel (tabel 13.2) viser faderskabstesten for mn-blodgruppe.
Rh-faktor:
et vigtigt agglutinogen er blevet påvist (1940) i humane røde blodlegemer også af Landsteiner og vener. Det er agglutinogen af Rhesusaben og er til stede hos 85% af de hvide mennesker. Selv om oplysningerne er begrænsede, er det dog konstateret, at blandt indianere og Ceylonesere er andelen endnu større (ca.95% eller mere). Der er ingen tilsvarende agglutinin i det humane plasma.
nylige undersøgelser viser, at Rh-faktoren ikke er en enkelt enhed. Der er seks Rh-agglutinogener-C, c; D, d; E, e; af disse, D og tør den mest almindelige. Disse to vil give tre undergrupper-D, Dd og d. D er Mendelsk dominerende, mens d er recessiv. Derfor vil grupper D og DD (samlet kaldet D-gruppe) være Rh-positive (Rh+) og d vil være rh-negative (Rh~). Næsten alle Rh-positive mennesker tilhører D-Gruppen og rh-negative mennesker til gruppe d.
klinisk betydning:
1. Hvis Rh + blod transfunderes til en Rh ” – patient, vil en Anti-Rh-faktor udvikle sig i patientens blod om cirka 12 dage. Hvis en anden transfusion af det samme blod gives til en sådan patient efter denne periode, vil hæmoagglutination af donorens blodlegemer finde sted. Med andre ord er blod, der var kompatibelt før, blevet uforeneligt nu. Så før transfusion skal testen for Rh-faktor udføres omhyggeligt.
2. Under graviditeten fosteret kan være Rh + mens moderen Rh -. Rh-agglutinogen (også svagt til stede i plasmaet) fra fosteret passerer ind i moderblodet og stimulerer dannelsen af anti-Rh-faktor. Dette antistof trænger ind i fosterets blod og ødelægger fosterets røde blodlegemer. Fosteret kan dø (forårsager abort) eller, hvis født i live, lider af alvorlig anæmi. Denne sygdom er kendt som erythro-blastosis foetalis.
3. En sådan mor bliver følsom over for Rh-faktor. I fremtiden, hvis hun får en transfusion af ellers kompatibelt blod, men indeholder Rh-faktor, vil agglutination finde sted.
4. Af samme grund bør en Rh” kvinde, før overgangsalderen, ikke gives transfusion af Rh+ blod. Fordi hvis hun bliver gravid med Rh-positivt foster, problemet som beskrevet under nr. (2) vil blive endnu mere akut.
de specifikke agglutininer er ikke til stede i fosterplasmaet. Men maternelle agglutininer, der filtreres gennem moderkagen, findes i fosterets plasma. Kun 50% af nyfødte spædbørn viser en mærkbar mængde af dette agglutinin.
specifikke agglutininer begynder at forekomme fra omkring den 10.dag efter fødslen og stiger til maksimum på omkring det 10. år. Agglutininer findes ligesom andre antistoffer i serumets globulinfraktion. De er også til stede i lave fortyndinger i kropsvæsker, der er rige på proteiner, såsom mælk, lymfeekssudater og transudater. De findes ikke i urin og cerebrospinalvæske. Hæmoagglutininer øges midlertidigt under serumsygdom og reduceres i leukæmi.
ligesom andre antistoffer varierer koncentrationen af specifikt agglutinin i alle aldre fra mand til mand og endog i samme individ under forskellige forhold. De fungerer bedst ved en lavere temperatur.
blodgruppen af et bestemt emne er af fast karakter og varierer ikke med alder eller sygdom.
ikke-specifikke agglutininer kan undertiden forekomme i blodet, der virker i kulde (ved 0 liter -5 liter C eller F) og ikke ved kropstemperatur. Disse kolde agglutininer kan til tider være tilstrækkeligt høje til at forårsage autoagglutination ved kropstemperatur. Af denne grund kan der forekomme intravaskulær hæmolyse, der fører til hæmoglobinuri (Paroksysomal hæmoglobinuri).
detaljer om Rh faktor:
1. Rh-agglutinogener:
der er tre par Rh-agglutinogener C, c; D, d; og E, e; C, D og e er Mendelske dominanter, og c, d og e er recessiver.
2. Humane røde celler (RBC):
R. B. C. vil altid bære tre agglutinogener – en fra hvert par, men de vil aldrig bære begge medlemmer af et par. Således er ODE, CDe og cDE mulige, men cDC og CDd er det ikke.
3. Rh-grupper (genotyper):
det følger derfor, at der er 8 mulige kombinationer, hvoraf en kan bæres af begge forældre. Derfor er der matematisk 64 mulige kombinationer (genotyper). Af disse 28 er identiske, 36 undergrupper er biologisk tilgængelige. Af disse igen er kun 5 almindeligt forekommende, nemlig CDe/CDe, CDe/cDe, CDe/cde, cDe/cde, cDe/cde og cde / cde. Andre er sjældne.
4. Rh + og Rh – grupper:
disse grupper indeholdende de dominerende agglutinogener—dvs., C, D, E—vil være Rh+. Men da C og E sjældent forbliver uden D, indeholder næsten alle Rh+ tilfælde D, dvs. tilhører
gruppe D. Rh – sagerne vil indeholde de recessive agglutinogener – c, d og e og på grund af lignende grunde STAT4 ovenfor tilhører gruppe D.hver mand bærer noget Rh-agglutinogen. Flertallet har D og er af Rh+. Resten bærer d og er af Rh -. Alle Rh-inkompatible reaktioner skyldes interaktioner mellem Gruppe D (donor) og gruppe d (modtager).
5. Rh-antistof:
a) Hver af de seks agglutinogener har antigenisk egenskab, dvs.de kan stimulere antistofdannelse. De tilsvarende antistoffer er kendt som Anti-C, Anti-D osv. D er stærkt antigenisk, andre er meget svage.
b) hvis D-celler gentagne gange injiceres i et Rh” – emne, vil Anti-d udvikle sig. Dette antistof kan være af to typer — “tidligt” og “sent”. Den tidlige Anti-D dannes først og kaldes komplet antistof. Det kan agglutinere d-celler in vitro, når de suspenderes enten i saltvand eller albuminopløsning. Derfor er det også kendt som saltvand agglutinin. Det sene Anti-D dannes senere og kaldes ufuldstændigt antistof.
det kan agglutinere d-celler in vitro, når de kun suspenderes i albuminopløsninger og ikke i saltopløsninger. Derfor kaldes det også albumin agglutinin. Men i sidstnævnte tilfælde, selvom d-cellerne ikke er agglutinerede, er de dog noget modificerede. Fordi disse celler, når de først er behandlet på denne måde, ikke vil blive agglutineret af tidligt Anti-D-serum, selv når de suspenderes i albuminopløsning. Derfor er det sene Anti-D også kendt som det blokerende antistof.
c) som nævnt ovenfor er D meget stærkt antigenisk. Det forårsager Anti – D dannelse selv ved intramuskulær injektion; således at gentagne intramuskulære injektioner af fuldblod — som ofte gøres i medicinsk praksis uden at matche blodgrupperne — ikke nødvendigvis er en sikker procedure. Derfor er direkte krydsmatchning før hver sådan virksomhed den eneste sikreste beskyttelse.
6. Racefordeling:
skriv folk – 85% Rh+, hvoraf D – 35%, Dd – 48% og de resterende 2% indeholder også D sammen med noget andet agglutinogen. indianere, Ceylonesere – 95% Rh+, Japansk omkring 100% Rh+ derfor er Rh-inkompatibilitetsreaktioner i sidstnævnte ekstremt sjældne.
7. Hæmolytisk sygdom hos nyfødte:
denne sygdom skyldes ødelæggelse af Rh+ R. B. C. I fosteret af et anti-Rh agglutinin, der er til stede i moderens serum, som har filtreret gennem moderkagen under graviditeten. Inkompatibiliteten mellem moderens og barnets blod skyldes arv af Rh-faktoren. Følgende tabel (tabel 13.3) angiver sandsynligheden for Rh-gruppe hos barn.
i denne sygdom fører ødelæggelse af den normale R. B. C. Til tilstedeværelsen af unormal nukleeret R. B. C. i omløb. Et par timer efter fødslen er der anæmi, akut gulsot og relaterede symptomer.
betydningen af blodgruppe:
1. Blodtransfusion.
2. Visse blodsygdomme.
3. Faderskabstest.
4. I retsmedicin.
5. Etnologiske studier.
6. Antropologiske undersøgelser.
7. Forskellige eksperimentelle formål.
uforenelighed af blodet kan kun opstå i tilfælde markeret asterisk ( * ) — som i disse to grupper er moderen i stand til at producere et anti-Rh agglutinin til at ødelægge Rh+ R. B. C. Til stede i fosteret.
genetisk kontrol af Antigenstruktur:
Rh-antigenerne:
de to uafhængige sæt alleliske blodgruppegener, der hidtil er diskuteret, er relativt enkle eksempler på den genetiske kontrol af blodgrupperingsstoffer. En sidste sag vil blive præsenteret i detaljer for at illustrere den mest komplekse situation hos mennesker, der er blevet gjort forståelig gennem en forståelse-af forholdet mellem gener og antigener.
dette tilfælde er tilfældet med rhesus-stofferne, som repræsenterer en række antigener, der arves uafhængigt af mn-og ABO-antigenerne, og som bestemmes af gener, der forekommer på endnu et par kromosomer. Serien af antigener henter sit navn, Rh, fra rhesusaben (Macaca mulatta), hvor det første medlem af serien blev opdaget af Landsteiner og vinder i 1940.
Levine og Stetson (1939) havde fastslået, at den hæmolytiske sygdom hos nyfødte spædbørn kaldet erythroblastosis foetalis skyldtes isoimmunisering af mødre til et ukendt antigen på deres børns røde celler. Kort efter beskrivelsen af Rh-antigenerne fandt Levine, Katsin og Burnham (1941), at dette var antigenet, der var ansvarlig for den sygdom, de studerede.
disse opdagelser indleder en intensiv undersøgelse af Rh-antigenerne, der er fortsat lige siden. Denne undersøgelse har ikke kun givet en løsning på mange problemer forbundet med sygdommen, men har meget avancerede begreber om arten af arv af blodgrupperingsstoffer generelt.
to store hypoteser er blevet fremført for at forklare den genetiske mekanisme, der styrer Rh-antigenerne. En af disse, foreslået af vener, postulerer en række alleler på et enkelt sted m Et par kromosomer, der er forskellige fra dem, der bærer andre gener til blodgrupperingsantigener.
den anden af disse, fremført af Fisher og Race, er enig i det foregående ved at sige, at de involverede gener er på deres eget kromosompar, men er uenig i, at det postulerer tre par tæt forbundne alleler ved tre separate loci.
den involverede forbindelse anses for at være så tæt, at krydsninger forekommer med så lave frekvenser, at de aldrig er blevet observeret. Desværre lever de genetiske forudsigelser af disse to hypoteser i så mange af deres aspekter, at det endnu ikke har været muligt at fastslå med endelighed, hvilken der er korrekt.
en skematisk sammenligning af Viener-og Fisher-Race-begreberne:
et af de grundlæggende punkter, der er tale om, er, om der er et en-til-en-forhold mellem antallet af slags Rh-antistof, som en celle vil kombinere med, og antallet af slags gener, der bestemmer de antigene specificiteter, der er ansvarlige for denne kombination.
dette punkt illustreres ved at overveje celler (af en individuel genetisk homosygøs), der er i stand til at kombinere med tre forskellige slags antistoffer, anti-1, anti-2 og anti-3. Hypotesen ville tillade konceptet, at alle tre antistoffer kombinerede med forskellige dele af et enkelt antigemolekyle, hvis komplekse specificiteter blev bestemt af en enkelt slags gen.
Fisher-Race-hypotesen ville ikke tillade dette koncept, men visualiserer hvert antistof, der kombinerer med et antigenmolekyle med kun en enkelt specificitet, bestemt af et enkelt gen. Det ledsagende diagram skitserer arten af kontrasten mellem disse to begreber.

der skal udvises omhyggelig opmærksomhed på det punkt, at vener-konceptet ikke er i konflikt med det ene gen-et antigenforhold, der henvises til i starten af dette kapitel. Det er snarere let tænkeligt, at antigenet bestemt af et enkelt gen kan have en kompleks topografisk struktur, der vil inducere og kombinere med mere end en slags antistof på en måde, der er analog med den, der observeres i undersøgelsen af “kunstige” antigener; Med andre ord kræver begrebet et en-til-en-forhold mellem et gen og den antigene specificitet, der er dets produkt, slet ikke et en-til-en-forhold mellem denne antigene specificitet og de antistoffer, det frembringer.
Vævekonceptet Rh:
vævens koncept postulerer en grundlæggende serie af 8 alleliske gener (yderligere medlemmer er blevet tilføjet til denne serie, men disse behøver ikke overvejes her), hvoraf to kan forekomme i en enkelt heterosygøs individer. Hvert af disse gener bestemmer et antigen, der er i stand til at inducere og kombinere med en til tre (og flere) slags antistoffer.
de involverede antigene specificiteter forekommer i forskellige kombinationer, bestemt af den særlige allel, der er ansvarlig for et givet antigen. (Antistofferne anvendt i denne forskning opnås generelt fra isoimmuniserede mennesker, enten frivillige eller mødre, der har et barn, der lider af hæmolytisk sygdom; De forskellige gener, de antigener, de bestemmer, og reaktionerne af disse antigener på udvalgte antiserum findes i tabel 13.4. Et sådant gen er skrevet som enkelt bogstav efterfulgt af et overskrift, mens antigenet, som hver bestemmer, er skrevet som to bogstaver efterfulgt af et abonnement eller overskrift. De forskellige antigener vil nu blive overvejet.

symbolet Rho aktiveres, fordi det repræsenterer det første Rh-antigen, der blev opdaget, og som stadig er det mest betydningsfulde i hæmolytisk sygdom. Symbolerne rh ‘og rh” står for yderligere antigener, der efterfølgende findes. Symbolerne Rh1og Rh2 står for komplekse antigener bestående af to specificiteter. Rhj består af enhederne Rho og rh’; Rh2 består af enhederne Rho og rh”. De yderligere symboler Rh og rhy står for antigener med flere specificiteter som angivet. Symbolet rh kræver særlig kommentar.
oprindeligt stod dette symbol for fraværet af kendte antigene specificiteter (dvs.Rh0, rh’ og rh”). Opdagelsen af to nye former for antiserum har imidlertid afsløret eksistensen af to yderligere former for antigene specificiteter. Disse forekommer i forskellige kombinationer med de andre, specificiteter, der netop er beskrevet.

den første af disse antiserum, oprindeligt fundet af Levine og hans samarbejdspartnere, identificerer en specificitet, der nu kaldes hr’, som forekommer på alle celler, der mangler rh’ – specificiteten. Den anden af disse identificerer en specificitet betegnet hr” som forekommer på alle celler, der mangler rh” – specificiteten. (Den antigene modstykke til Rh0-antigenet, Hr0, er endnu ikke identificeret med sikkerhed.) Denne Historisk komplicerede situation har ført til anerkendelsen af rh-symbolet som repræsenterer et komplekst antigen med både hr’ og hr” specificiteter.
derudover har de to nye antiserum udvidet beskrivelsen af de andre Rh-symboler. Disse forhold er vist i tabel 13.5. For at forstå disse (og dem, der allerede er præsenteret i tabel 13.4) den studerende skal udarbejde nogle diagrammer, der ligner dem, der er vist tidligere, og erstatte de anvendte tal med de anvendte symboler.
for at summere vener-ordningen tillader de fem antiserum, der betragtes her, påvisning af variable klynger af en række antigene specificiteter (individuelt betegnet blodfaktorer), der sammen fra Rh-blodgruppen af en given person. Disse klynger går fra generation til generation, hvor deres specifikke og strukturelle kontinuitet bestemmes af den særlige allel, som de er produktet af. Yderligere overvejelse af arv af disse faktorer er givet i et senere afsnit.
Fischer-Race-begrebet Rh:
Fischer-Race-konceptet har sin oprindelse i den analytiske indsigt fra den britiske genetiker og matematiker R. A. Fischer. Han foreslog i A-forslag præsenteret af Race i 1944, at de Rh-antigener, der dengang var kendt, kunne betragtes som produkterne af virkningen af en serie på tre par meget tæt forbundne alleler, hvor hvert gen i hvert par producerede et enkelt antigen med evnen til kun at inducere og reagere med en slags antistof.
de foreslåede allelpar af gener blev symboliseret som C, c; D, d; og E, e. hver blev holdt for at producere et særskilt antigen udpeget med samme bogstav. Ingen Dominans antydes af brugen af kapital og små bogstaver, idet disse kun vælges for at vise deres allelisme.
de formaliserede forhold mellem disse adskillige gener på kromosomerne af en individuel heterosygøs for dem alle er:
CDE/cde
andre kombinationer af tre alleler på bestemte kromosomer forekommer naturligvis, f.eks. (nogle myndigheder skriver rækkefølgen af bogstaver involveret som D. C. E som anerkendelse af genetiske overvejelser om kobling og mulig sletning; disse er dog overvejelser, der ikke er relevante her.)
på det tidspunkt, hvor Fisher-Race-konceptet blev etableret, var antiserum kendt for C, c; D; og E antigener. De yderligere antiserum for antigener d og e blev forudsagt, hvoraf anti-e nu er etableret med sikkerhed.
derudover blev eksistensen af det daværende ukendte kromosom c (d) E forudsagt og efterfølgende fundet. Succesen med disse forudsigelser såvel som den relative enkelhed i den involverede terminologi og begreber førte til bred accept af Fisher-Race-ordningen, især blandt klinikere og europæiske forskere.
sammenfattende genkender det britiske koncept en række kromosomer, der bærer forskellige kombinationer af de meget tæt forbundne C, D, E alleller. Disse kombinationer anses for at opstå som et resultat af krydsning, så sjældne, at de ikke er blevet opdaget.
symbolet D svarer til det for Rho, og yderligere paralleller i de to terminologier er vist i tabel 13.6. Tilsvarende kan de to sæt symboler for de fem slags Rh-antistoffer relateres som følger:

arv af Rh – Blodfaktorerne:
det er tydeligt, at i fravær af dominans, mutationskrydsning og epistose (hvoraf ingen endnu har vist sig at forekomme i løbet af genetiske undersøgelser af Rh-antigener), vil Rh-blodfaktorerne dukke op igen fra generation til generation som karakteristiske klynger.
for eksempel kan en krydsning mellem en far til genotype R2r (CDE/cde) og en mor til genotype larr” (Cde/cdE) potentielt producere fire slags børn, som det let vises ved brug af Punnetts firkant:

to, blandt de viste børn, ville have antigenet RhofD), som deres mor mangler. I den klassiske brug af Rh-udtrykkene ville deres mor være” Rh-negativ”, mens de ville være”Rh-positive”. Dette eksempel viser også, at definitionen af Rh-positivitet og negativitet er en relativ, der skal laves med hensyn til de involverede antigener.
i teorien er ethvert barn, der besidder Rh-antigener, som dets mor mangler, positivt med hensyn til disse antigener, mens dets mor er negativ med respekt for dem. I praksis har Rho(D) – antigenet imidlertid vist sig at være det hyppigst involverede i hæmolytisk sygdom, hvor rh'(C) den næste, hvor de andre blodfaktorer er meget mindre hyppigt impliceret.
betydningen af at udvikle det korrekte koncept for Rh-antigenernes genetiske forhold:
de foregående afsnit har vist, at enten væveren eller Fisher-Race-nomenklatursystemerne kan bruges til at beskrive Rh-antigenerne og antistofferne. Dette punkt anerkendes af National Institute of Health, som kræver, at begge systemer anvendes til mærkning af kommercielt producerede antiserum.
dette bør dog ikke forringe opmærksomheden fra behovet for at bestemme gyldigheden af det ene eller det andet koncept, der ligger til grund for denne nomenklatur, selvom dette kan synes at være “akademisk” og ikke direkte bekymrende i klinisk arbejde.
en af grundene alene til behovet for fortsat indsats for at løse dette problem er, at antigener, som ofte nævnt, synes at være de direkte produkter af de gener, der producerer dem. Antistofferne, som de inducerer, bliver derfor på grund af deres fine specificiteter de mest følsomme indikatorer for variationer i genvirkning, der er kendt.
dette gør det nødvendigt, at der opnås en nøjagtig konceptuel ordning, som vil relatere produktionen af antigener til de ordninger, der udvikles vedrørende forholdet mellem gener og nukleinsyrestruktur til den “genetiske kode”, der anvendes i den arvelige transmission af-meddelelser”.
detaljeret overvejelse af disse forhold ligger langt uden for rammerne af denne tekst, idet den interesserede læser henvises til ‘ populære beretninger om Crick, Gamov og Beadle for en introduktion til de involverede historier.
Stomont har opsummeret årsagerne til en voksende tendens hos flere førende genetikere til at favorisere vener-konceptet på trods af dets vanskeligere terminologi. Hans resume, for avanceret til at præsentere her, er baseret på paralleller mellem Rh-antigenernes opførsel hos mennesker og B-og C-serien af alleler, der bestemmer blodtyper hos kvæg.
disse serier af alleler kontrollerer langt det mest komplekse udvalg af blodfaktorer, der vides at eksistere, et array, hvis forhold med rimelighed kun kan forklares i form af flere alleler snarere end i serie af sammenkædede gener. Yderligere oplysninger om kvægblodtyper gives senere i dette kapitel. Race og Sanger og Levine præsenterer diskussioner og yderligere referencer til Fisher-synspunktet.
den studerende skal indse, at de førende fortalere for begge ordninger har udført forskning, der sjældent er blevet udmærket i biologiens annaler, og at eksperimentelle opløsninger af deres forskelle hverken vil være en let eller triviel sag.