syrer, baser og pH
|
|||||||||
syrer og deres konjugerede baser
husk Bronsted–Lavry definitionen af en syre: en syre er en protondonor. Det er klart, at eddikesyre i vores tidligere eksempel donerer sin proton til H2O i den fremadrettede reaktion, hvilket resulterer i dannelsen af acetationen. I den omvendte reaktion accepterer acetationen imidlertid en proton fra H3O+ for at vende tilbage til CH3COOH. Fra Bronsted-Lavry definition, en base er en protonacceptor.
|
således fungerer acetationen som en base i den omvendte reaktion og er kaldet konjugatbasen af eddikesyre. Eddikesyre og acetationen er kendt som et syre–base konjugatpar. Interessant nok er der et andet syre–base konjugatpar i reaktionen ovenfor. Bemærk, hvordan H3O+ donerer en proton i den omvendte reaktion (hvilket gør den til en syre), mens H2O i den fremadrettede reaktion accepterer en proton (hvilket gør den til en base). H2O og H3O+ er et konjugat syre-base par, hvor H3O + er den konjugerede syre og H2O er den konjugerede base.
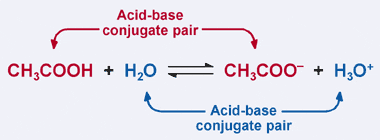
i et konjugeret syre-basepar har konjugatsyren en mere proton end dens tilsvarende konjugatbase.