Una Guía para Tumores conjuntivales
Los tumores conjuntivales incluyen un espectro de neoplasias benignas y malignas.1-5 Los tipos difieren según la edad y la raza, el estado inmunitario sistémico y las exposiciones a largo plazo. Un estudio amplio de 5002 casos de un centro de oncología ocular reveló que 52% eran benignos, 18% premalignos y 30% malignos (Tabla 1).1,2 Aunque este informe fue de un centro de oncología ocular y las neoplasias malignas podrían estar sobrerrepresentadas, es importante que los médicos comprendan la variedad de tumores conjuntivales.
Los cinco tumores más comunes fueron nevo (23%), neoplasia escamosa de superficie ocular (OSSN, 14%), melanosis primaria adquirida (PAM, 12%), melanoma (12%) y tumor linfoide (9%).5 Los tumores malignos se observaron con mayor frecuencia en adultos e incluyeron melanoma (12%), carcinoma de células escamosas (CCE, 9%), linfoma (7%), sarcoma de Kaposi (<1%), metástasis (<1%) y otros.1 Los tumores conjuntivales en niños presentan malignidad solo el 3% de las veces.5
Esta revisión de los tumores conjuntivales más comunes lo preparará para manejarlos adecuadamente, ya sea en su consultorio o a través de una derivación.
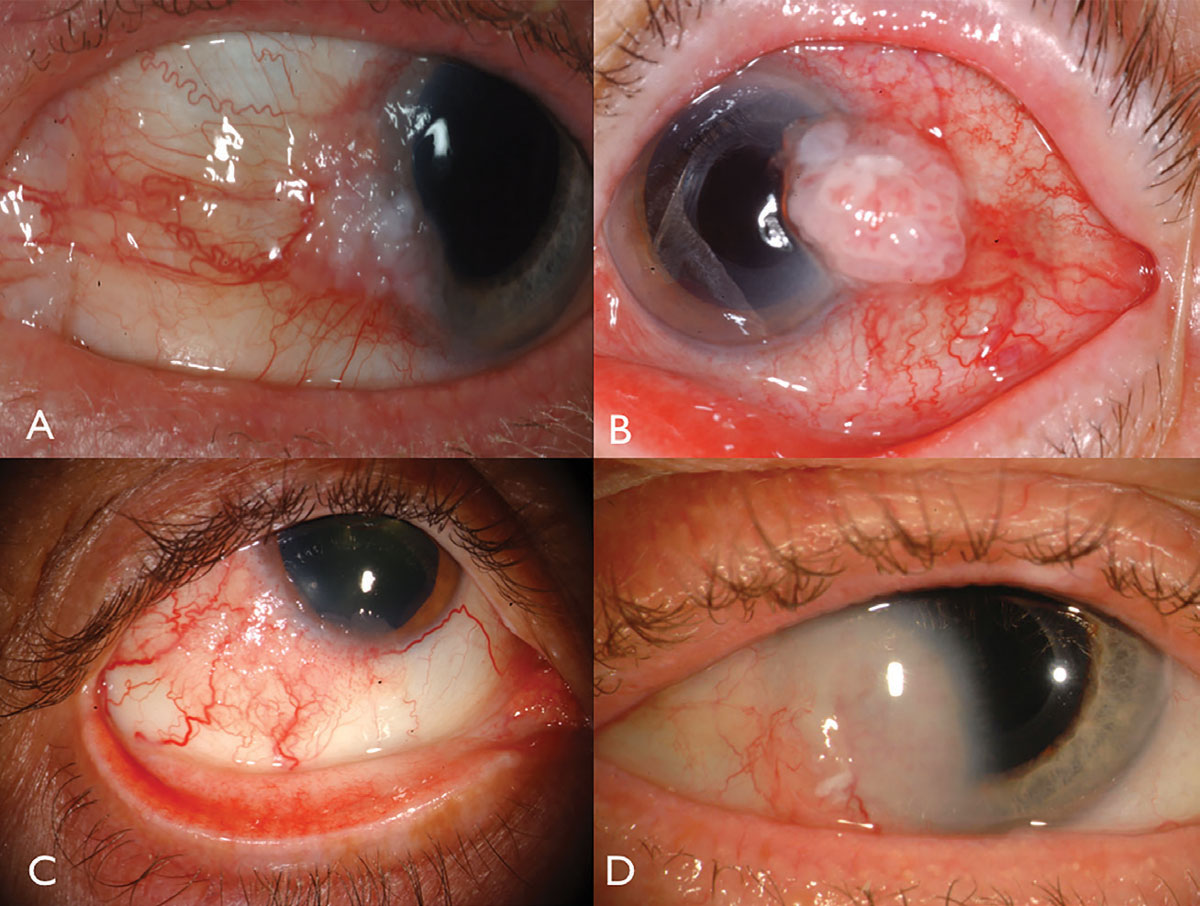
Fig. 1. Limbal OSSN: con leucoplasia y compromiso corneal (A), con vascularización intrínseca prominente y vasos alimentadores (B), en un paciente con VIH (C), y con invasión corneal profunda que requiere resección y radioterapia con placa (D). Haga clic en la imagen para ampliarla.
Neoplasia escamosa de superficie ocular
El término clínico general de OSS incluye un espectro de neoplasias malignas que van desde cambios displásicos epiteliales leves, como neoplasia intraepitelial conjuntival (NIC), hasta carcinoma invasivo más grave que invade la sustancia propia a través de la membrana basal, como el carcinoma de células escamosas.
características Clínicas. El hueso conjuntival ocurre clásicamente en hombres caucásicos mayores, particularmente en aquellos con exposición crónica al sol. En los Estados Unidos, el CCE conjuntival es cinco veces más común en hombres y caucásicos. Sin embargo, en África, el CCE conjuntival es casi igual de común en hombres y mujeres, y se presenta a una edad más temprana que en los Estados Unidos.6
La neoplasia escamosa de superficie ocular se presenta generalmente como una masa gelatinosa vascularizada unilateral, localizada en la conjuntiva expuesta al sol en el limbo nasal o temporal (Figura 1). Leucoplasia suprayacente, vasos alimentadores dilatados e infiltración espumosa del epitelio corneal adyacente pueden ocurrir y rara vez pueden invadir el globo u órbita.
haga Clic en la tabla para agrandar.
factores Predisponentes. Los factores ambientales más importantes para la OSS incluyen la exposición crónica al sol y la exposición al humo del cigarrillo. Dos factores predisponentes clave para el huésped son la tez clara y el virus de inmunodeficiencia humana (VIH) subyacente y el virus del papiloma humano.6 Los pacientes con deficiencia inmunitaria, en particular los que tienen VIH, están en riesgo de presentar NSE y pueden presentar tumores avanzados, bilaterales e invasivos.1 Esto se observa especialmente en África, donde el VIH es prevalente y la OSSN se presenta tanto en hombres como en mujeres y a una edad más temprana.6 Otras desregulaciones inmunitarias pueden predisponer a un paciente a OSSN, incluida la inmunosupresión de trasplante de órganos, eccema / atopia, penfigoide cicatricial ocular, xerodermia pigmentaria y afecciones autoinmunes.7
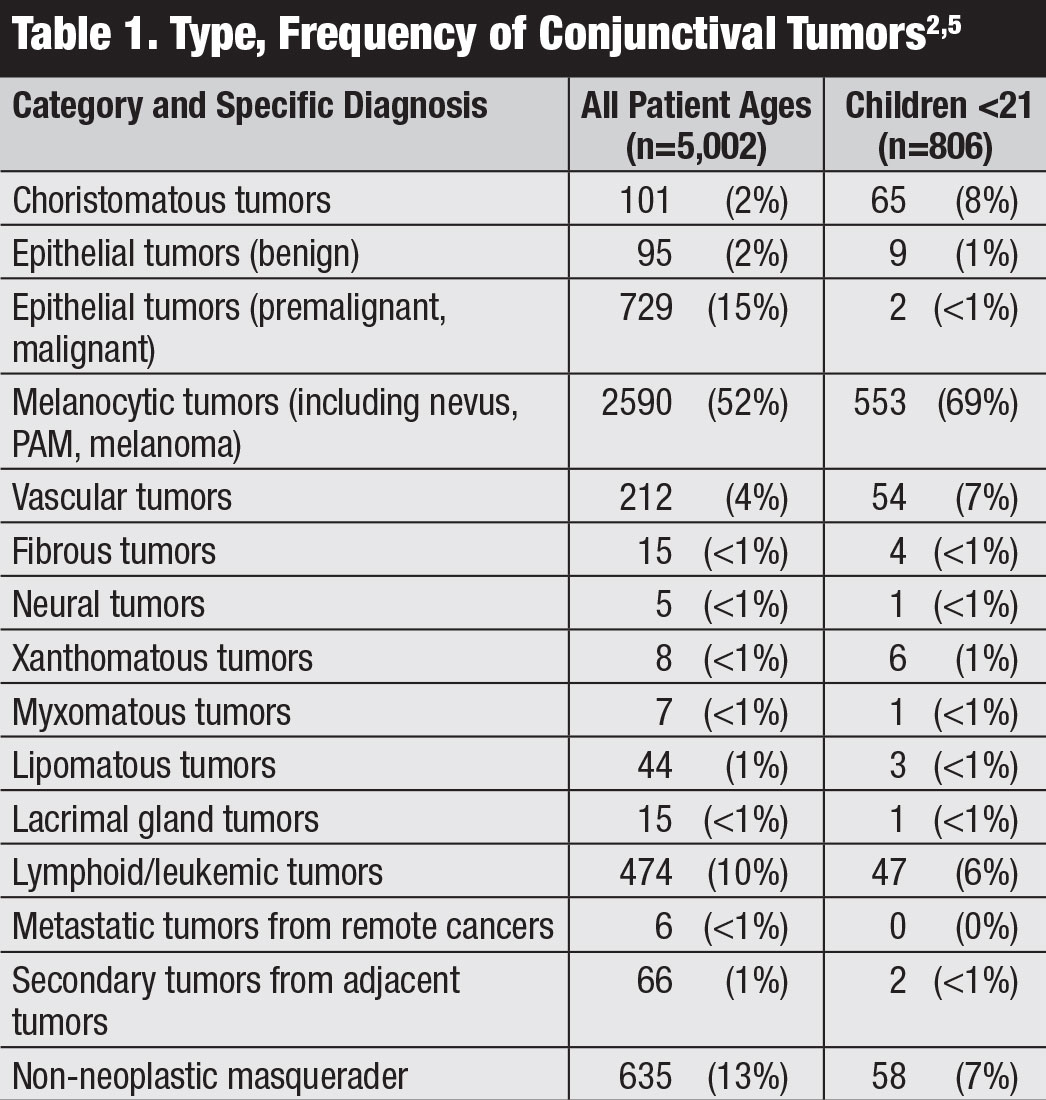
Clasificación. El manual de la 8a edición del American Joint Committee on Cancer (AJCC) proporciona la clasificación más reciente para el carcinoma conjuntival, incluidos el CCE y la NIC (Tabla 2).8
Gestión. Esto implica resección quirúrgica utilizando la técnica “sin contacto” o terapias no quirúrgicas, como quimioterapia tópica con mitomicina C (MMC) o 5-fluorouracilo (5-FU), inmunoterapia tópica o inyectada con interferón alfa-2b (IFN), medicamentos antivirales tópicos (cidofovir) o terapia fotodinámica.7,9-11
La técnica quirúrgica sin contacto implica una evaluación detallada del tumor mediante biomicroscopía con lámpara de hendidura para visualizar todos los márgenes del tumor, incluidos los componentes bulbar, forniceal y tarsal, para comprender toda la extensión del tumor y permitir que el médico dibuje a mano un registro de plantilla.9 Luego, esta plantilla se lleva a la cirugía para asegurarse de que se extirpe todo el tumor.
En el momento de la cirugía, solo el tejido normal circundante se sujeta con fórceps y el tumor nunca se toca para evitar la siembra del tumor. Además, la solución salina equilibrada no se emplea durante la cirugía para evitar la dispersión líquida de las células cancerosas. Después de la extirpación del tumor, el cierre con instrumentos limpios es crucial. Al usar esta técnica para el OSSN, se encuentra persistencia o recidiva tumoral en menos de 5% de los casos.
haga Clic en la tabla para agrandar.
La quimioterapia tópica con 5-FU o MMC es eficaz para resolver el OSS, a menudo dentro de dos a cuatro semanas de tratamiento, aunque existe un riesgo de deficiencia de células madre. Nuestra preferencia de terapia tópica es la inmunoterapia con IFN, ya que es bien tolerada con buen control tumoral, a menudo durante tres meses y con poca complicación y solo conjuntivitis folicular menor.10,11 Estos medicamentos pueden ser localmente tóxicos para el epitelio corneal, pero menos con el interferón, y los pacientes deben ser seguidos de cerca mientras están en ellos. Si el costo es un factor para el paciente, el 5-FU tópico es el menos costoso, seguido de MMC y luego de IFN.
Tumores linfoides conjuntivales
Las neoplasias linfoides varían de tumores de grado bajo a alto y surgen de la proliferación monoclonal de linfocitos. Los tumores linfoides que se presentan en la región periocular a menudo involucran varios tejidos, como la conjuntiva, la órbita y el párpado, y se denominan tumores linfoides “anexos oculares”, que incluyen hiperplasia linfoide reactiva benigna (HLBR) y linfoma.
BRLH y el linfoma están en extremos opuestos del espectro, con BRLH apareciendo clínicamente como un “parche de salmón” localizado e histopatológicamente benigno, mientras que el linfoma también aparece como un” parche de salmón ” pero con características histopatológicas más agresivas, con actividad mitótica y clasificado como maligno.
Los tumores linfoides anexos oculares son típicamente de origen de células B. En un estudio multicéntrico de 268 pacientes de linfoma conjuntival, se encontraron los cuatro tipos más comunes: linfoma extranodal de la zona marginal (ENMZL, anteriormente denominado tejido linfoide relacionado con la mucosa) en 68%, linfoma folicular (LF) en 16%, linfoma de células del manto (LCM) en 7% y linfoma difuso de células B grandes (LBDB) en 5%.12 Otros tipos de linfoma conjuntival incluyen el linfoma linfoplasmacítico y el plasmacitoma.
características Clínicas. El linfoma conjuntival por lo general se presenta en pacientes mayores de entre 60 y 70 años de edad. Este tumor puede manifestarse como linfoma primario, limitado a la región periocular, o como linfoma secundario con enfermedad en otros lugares. La mayoría de los linfomas primarios se presentan con ENMZL y FL y linfoma secundario con DLBCL y MCL. En un análisis de 117 pacientes de linfoma conjuntival, se encontró compromiso sistémico en 31%, con mayor frecuencia en aquellos con linfoma anexo ocular multifocal bilateral.13
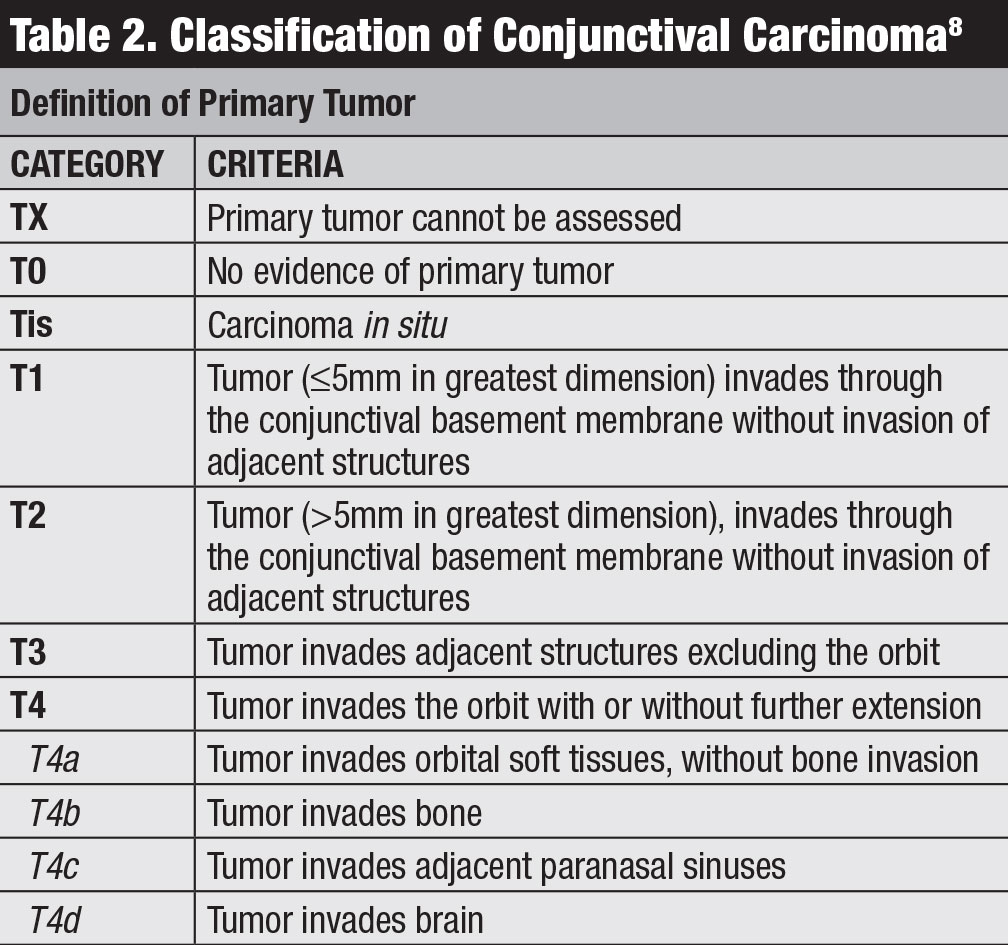
El linfoma conjuntival se manifiesta clásicamente como una masa subconjuntival de superficie lisa y color salmón rosado, a veces con vasos alimentadores (Figura 2). Esta masa lisa y multilobulada puede parecerse a la conjuntivitis folicular o papilar. Este tumor se localiza con mayor frecuencia en la región del fórnix conjuntival (44%) o del bulbo medio (42%) y, en raras ocasiones, en el carúnculo (7%) o el limbo (7%).13 Además de la conjuntiva, se puede encontrar linfoma infiltrando la órbita, el párpado o la úvea.13 La mayoría de los pacientes con linfoma conjuntival no presentan un componente intraocular, pero si está presente, generalmente reside en la úvea y no en la retina o el vítreo.
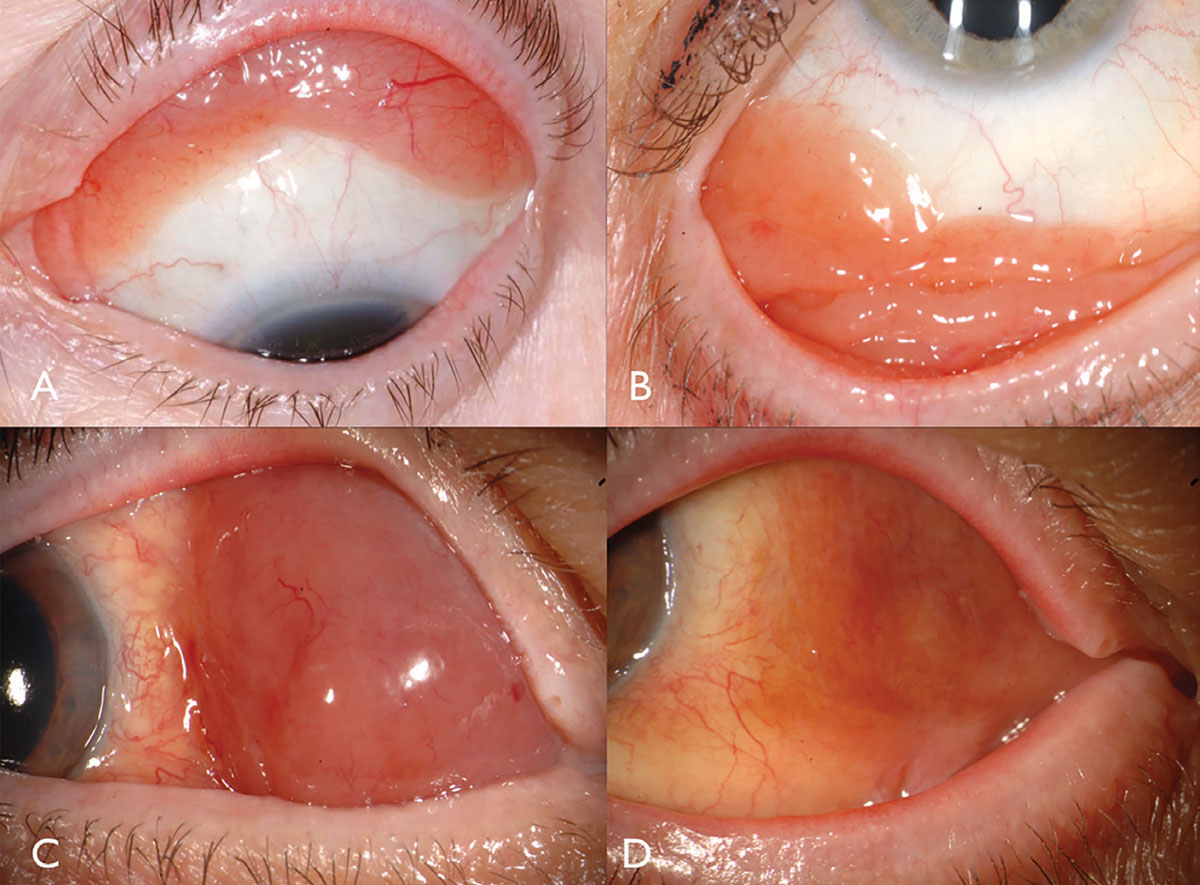
Fig. 2. Conjunctival lymphoma can be salmon-pink (A) or multilobulated forniceal (B). Medial forniceal conjunctival lymphoma before (C) and after (D) ritiximab. Click image to enlarge.
Predisposing factors. Immune dysfunction and autoimmune conditions, as well as infective etiologies such as Helicobacter pylori and Chlamydia psittaci are all predisposing factors for conjunctival lymphoma. La HBRL puede ser un posible precursor del linfoma y, aunque se encuentra predominantemente en adultos, ocasionalmente puede ocurrir en niños.5 De hecho, cuanto más joven es el paciente en el momento del diagnóstico de un tumor linfoide conjuntival, más probable es que sea HLB y no linfoma.Clasificación
. Existen varias clasificaciones para el linfoma conjuntival, como la estadificación Ann Arbor, la Organización Mundial de la Salud y la 8a edición del AJCC (Tabla 3).8 La estadificación clínica del AJCC se basa en la ubicación del tumor, los ganglios linfáticos regionales y el compromiso a distancia.8
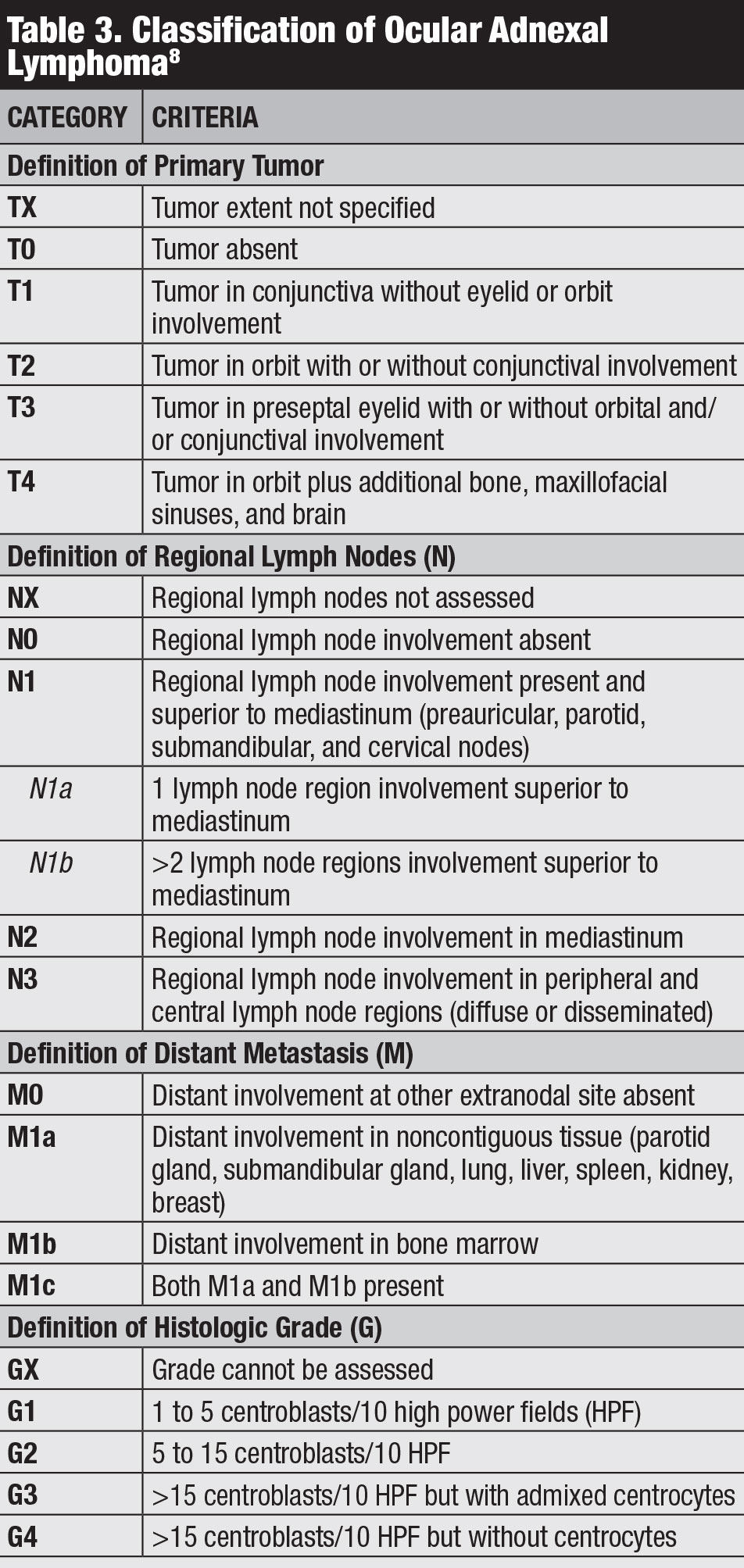
haga Clic en la tabla para agrandar.
Gestión. El cuidado de los pacientes de linfoma conjuntival depende principalmente del grado de compromiso periocular, compromiso sistémico y su estado de salud general. En pacientes con solo linfoma conjuntival y sin compromiso sistémico, el tratamiento se centra en la resección quirúrgica completa. El tratamiento con radioterapia de haz externo o rituximab son opciones si el tumor no es resecable. Para aquellos con linfoma periocular y sistémico, el tratamiento con rituximab sistémico o la adición de quimioterapia son consideraciones.
El pronóstico sistémico con linfoma conjuntival está directamente relacionado con cada subtipo, ya que en un estudio se encontró que la supervivencia a cinco años fue de 97% para el LM-Z, 82% para el LF, 55% para el LBDL y solo 9% para el LCM.12
Melanoma conjuntival
Los tumores melanocíticos conjuntivales son indiscutiblemente comunes, representando más de 50% de los casos en una serie grande de tumores conjuntivales de una unidad de oncología ocular.1,2 Esta clase de tumores melanocíticos incluye muchos tipos, como nevus, melanosis relacionada con la tez, PAM, melanosis adquirida secundaria, melanoma y metástasis.1-5 En algunos continentes donde los pacientes tienen tez oscura, incluso el OSSN puede aparecer melanocítico. De estas lesiones, el nevo conjuntival representa 45% y el melanoma conjuntival primario representa 23% de todos los tumores melanocíticos en una práctica oncológica ocular.2
En los Estados Unidos, la incidencia ajustada por edad de melanoma conjuntival se duplicó entre 1973 y 1999, de 0,27 por millón a 0,54 por millón.14,15 La incidencia aumentó 295% en hombres blancos en los Estados Unidos durante el mismo período de 27 años, especialmente entre hombres de 60 años o más.14 Los investigadores especulan que la tasa de aumento puede estar relacionada con la exposición a la luz ultravioleta.
características Clínicas. El melanoma conjuntival es una neoplasia maligna pigmentada o no pigmentada que puede surgir de PAM, nevus o de novo.16 El melanoma se puede encontrar en la conjuntiva limbal, bulbar, fornicaria o palpebral y, a menudo, muestra un alimentador dilatado y tortuoso y vasos intrínsecos típicamente rodeados de PAM plana (Figura 3). En general, los tumores que miden más de 2 mm de grosor tienen un riesgo significativo de metástasis en los ganglios linfáticos. La invasión tumoral a la órbita es particularmente grave, con un riesgo metastásico considerable.
La recidiva tumoral local o el tumor nuevo se encuentran en 50% de los casos, a menudo relacionados con una nueva transformación de PAM. La metástasis a distancia, a menudo a la cadena de ganglios linfáticos preauriculares, submandibulares o cervicales, se encuentra en el 25% de los pacientes. La biopsia de ganglio linfático centinela puede ayudar a los médicos a evaluar la infiltración subclínica de ganglios linfáticos. Las recurrencias múltiples, especialmente las que involucran la órbita, requieren exenteración orbital.
factores Predisponentes. El factor predisponente más importante para el melanoma conjuntival es la presencia de nevo conjuntival de larga duración o PAM.16-18 Al estudiar el origen del melanoma conjuntival por histopatología, los investigadores encontraron que el origen era PAM en el 74%, de novo en el 19% y nevo en el 7%.16 Estudios clínicos estiman que uno de cada 300 nevos se convierte en melanoma.17,18
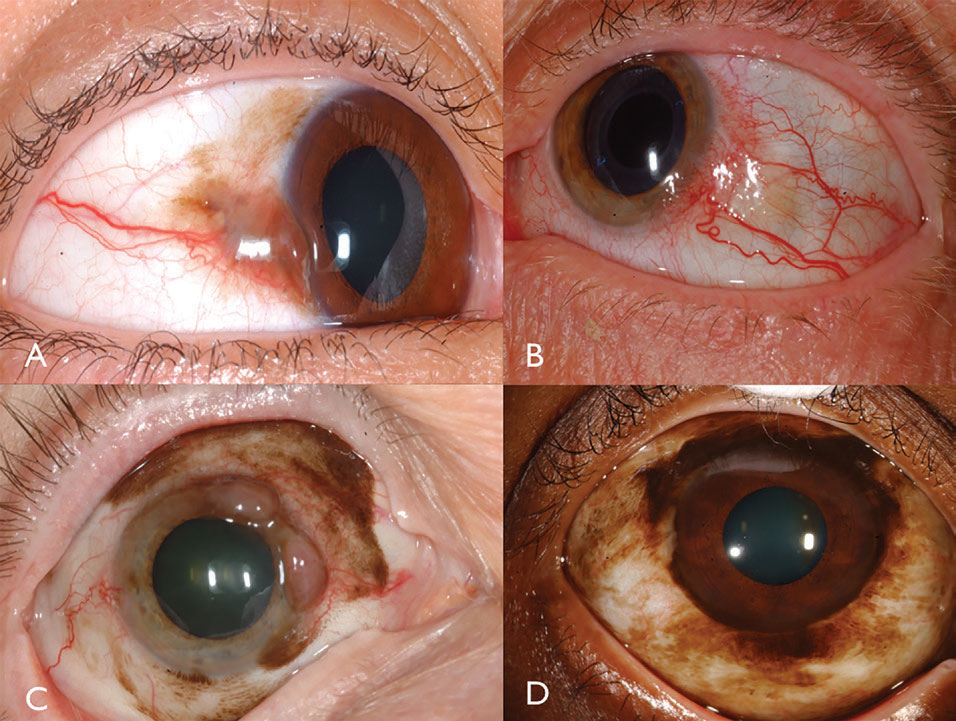
Fig. 3. El melanoma conjuntival pigmentado puede surgir de PAM (A). El melanoma conjuntival no pigmentado puede tener una vascularización intensa (B). La PAM también podría causar melanoma conjuntival mixto pigmentado / no pigmentado (C). La PAM causó melanoma limbal en este paciente afroamericano (D). Haga clic en la imagen para ampliarla.
En un estudio clínico grande, se encontró que el riesgo a 10 años de transformación de la PAM en melanoma era de aproximadamente 9%, y la mayor extensión de la PAM promovió un mayor riesgo de transformación en melanoma.19 Por lo tanto, es importante identificar la PAM y tratar esta afección con escisión quirúrgica, crioterapia e incluso queratectomía superficial (si hay afectación corneal) con la intención de prevenir el melanoma.
La diferenciación del nevo conjuntival del melanoma puede ser un desafío. En un reciente análisis de 510 casos de nevus conjuntival vs melanoma en los niños, el melanoma fue más común en los niños mayores, con un riesgo relativo (RR) de 4,80, mayor grosor tumoral (RR de 1,14), mayor base (RR de 4,92), hemorragia tumoral (RR de 25,30) y ausencia de quistes intrínsecos (RR de 5,06).5 Los investigadores asignaron estas características, predictivas del melanoma conjuntival en niños, a un melanoma mnemotécnico: CATCH, que representa: Niños de mayor edad, Mayor Grosor/base, ausencia de quistes, Hemorragia para Melanoma.5
La diferenciación de la PAM del melanoma también puede ser desafiante; sin embargo, el melanoma tiene grosor y la PAM es completamente plana. En un análisis de 1.224 casos de PAM vs.melanoma en todas las edades, melanoma con significativamente mayor según la mediana de edad del paciente (54 vs. 61 años); sexo masculino (35% vs. 49%); ubicación en el fórnix (2% vs. 6%) y tarso (1% vs. 4%); diámetro basal mediano más grande (6 mm vs. 8 mm), grosor (<1 mm vs. 1 mm), vasos alimentadores (10% vs. 48%) y vasos intrínsecos (4% 33%); y hemorragia (<1% vs. 3%).2
Los biomarcadores tisulares son importantes para la evaluación del melanoma conjuntival e incluyen la mutación BRAF, la mutación promotora de TERT y la mutación PTEN.1 La identificación de estos biomarcadores es fundamental al planificar la terapia sistémica para el tratamiento o la prevención de la metástasis, ya que existen terapias dirigidas contra ciertos biomarcadores, como el vemurafenib para tumores malignos con mutación BRAF.
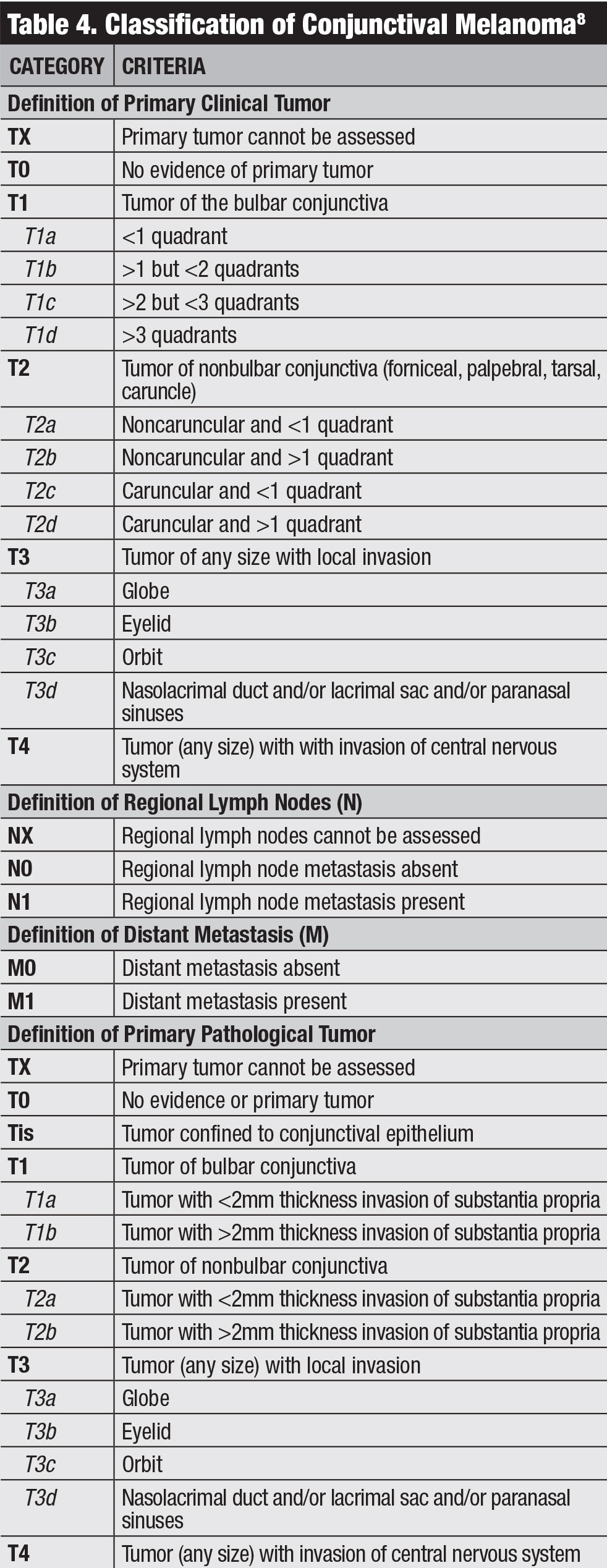
haga Clic en la tabla para agrandar.Clasificación
. La clasificación clínica del AJCC para el melanoma conjuntival se basa en la extensión del tumor por cuadrantes, la ubicación del tumor y las características invasivas (Tabla 4).8 Nuestro equipo estudió los desenlaces del melanoma conjuntival con base en la 7a edición del AJCC y encontró que esta estadificación era altamente predictiva del pronóstico.20 El melanoma clasificado como T2 y T3 (en comparación con T1) mostró tasas significativamente más altas de recidiva local, metástasis en ganglios linfáticos regionales, metástasis a distancia y muerte.
Gestión. El cuidado del melanoma conjuntival consiste básicamente en una resección quirúrgica completa utilizando la técnica sin contacto para evitar la siembra del tumor. La primera cirugía es la más importante, ya que la extracción delicada de todo el tumor sin sembrar el tumor es clave para prevenir futuras recurrencias y metástasis.16
El melanoma en el limbo córneo-cleral se extirpa bajo el microscopio quirúrgico también mediante la técnica sin contacto. El componente plano de la córnea se elimina con alcohol absoluto, epitelectomía superficial sin interrupción de la membrana de Bowman. La porción conjuntival se extrae con márgenes de 2 a 3 mm y se libera en el limbo mediante disección episcleral plana. Si hay invasión escleral, se aplica radioterapia con placa. Todos los márgenes conjuntivales se tratan con crioterapia de doble congelación y descongelación.
La reconstrucción implica técnicas de cierre primario, colgajo rotatorio o trasplante de membrana amniótica, a menudo con anillo simblefaron con revestimiento de membrana amniótica. El melanoma que se extiende a la órbita requiere exenteración orbital o, más recientemente, inmunoterapia con inhibición de puntos de control.21
Los pacientes con melanoma conjuntival deben ser monitorizados por un oncólogo ocular para detectar recidiva local y por un oncólogo sistémico para detectar enfermedad metastásica, en particular con palpación de ganglios linfáticos regionales y biopsia de ganglio linfático centinela. Las metástasis aparecen inicialmente en los ganglios linfáticos preauriculares o submandibulares, y más tarde en los pulmones y el cerebro. Nuevas pruebas indican que la metástasis del melanoma podría ser sensible a los inhibidores de BRAF o a los inhibidores de puntos de control inmunitario.21,22
Los tumores conjuntivales abarcan un amplio espectro de tumores. Las neoplasias malignas más comunes incluyen OSN, linfoma y melanoma. El reconocimiento de las características clínicas clásicas, la comprensión de los precursores y el tratamiento oportuno y adecuado de estas neoplasias malignas son importantes para obtener los mejores resultados para los pacientes.
Los doctores Shields, Lally y Shields trabajan en el Servicio de Oncología Ocular del Hospital de Ojos Wills, Universidad Thomas Jefferson, en Filadelfia. Apoyo proporcionado por la Fundación para la Investigación de Tumores Oculares, Filadelfia.
1. Shields CL, Chien JL, Surakiatchanukul T, et al. Tumores conjuntivales: revisión de características clínicas, riesgos, biomarcadores y resultados. La Conferencia de J. Donald M. Gass de 2017. Asia Pac J Ophthalmol. 2017;6:109-20.
2. Shields CL, Alset AE, Boal NS, et al. Tumores conjuntivales en 5002 casos. Análisis comparativo de contrapartes benignas versus malignas. La Conferencia James D. Allen de 2016. Am J Ophthalmol. 2017;173:106-33.
3. Escudos CL, Escudos JA. Tumores de la conjuntiva y la córnea. Surv Ophthalmol. 2004;49:3-24.
4. Grossniklaus HE, Green WR, Luckenbach M, et al. Lesiones conjuntivales en adultos. Una revisión clínica e histopatológica. Córnea. 1987;6:78-116.
5. Shields CL, Sioufi K, Alset AE, et al. Tumores conjuntivales en niños. Características que diferencian los tumores benignos de los malignos. JAMA Ophthalmol. 2017;135:215-24.
6. Gichuhi S, Sagoo MS, Weiss HA, et al. Epidemiology of ocular surface squamous neoplasia in Africa. Trop Med Int Health. 2013;18:1424-43.
7. Escudos CL, Ramasubramanian A, Mellen P, Escudos JA. Carcinoma de células escamosas conjuntival que surge en pacientes inmunodeprimidos (trasplante de órganos, infección por el virus de inmunodeficiencia humana). Oftalmología. 2011;118:2133-7.
8. Amin MB, Edge S, Greene F, et al., eréctil. AJCC Cancer Staging Manual. 8th ed. Chicago; Springer International Publishing: 2017.
9. Escudos JA, Escudos CL, De Potter PV. Abordaje quirúrgico de tumores conjuntivales. 1994 Lynn B. McMahan Conferencia. Arch Ophthalmol. 1997;115:808-15.
10. Shields CL, Kaliki S, Kim HJ, et al. Interferón para neoplasia escamosa de superficie ocular en 81 casos: desenlaces basados en la clasificación del American Joint Committee on Cancer. Córnea. 2013;32(3):248-56.
11. Karp CL, Galor A, Chhabra S, et al. Interferón recombinante subconjuntival/peligroso a2b para neoplasia escamosa de superficie ocular: revisión a 10 años. Oftalmología. 2010;117(12):2241-6.
12. Kirkegaard MM, Rasmussen PK, Coupland SE, et al. Linfoma conjuntival: estudio retrospectivo multicéntrico internacional. JAMA Ophthalmol. 2016;134:406-14.
13. Escudos CL, Escudos JA, Carvalho C, et al. Tumores linfoides conjuntivales: análisis clínico de 117 casos y relación con linfoma sistémico. Oftalmología. 2001;108:979-84.
14. Yu GP, Hu DN, McCormick S, Finger PT. Melanoma conjuntival: Está aumentando en los Estados unidos? Am J Ophthalmol. 2003;135:800-6.
15. Tuomaala S, Kivela T. Correspondence regarding conjunctival melanoma: Is it increasing in the United States? Am J Ophthalmol. 2003;136:1189-90.
16. Shields CL, Markowitz JS, Belinsky I, et al. Melanoma conjuntival. Desenlaces basados en el origen tumoral en 382 casos consecutivos. Oftalmología. 2011;118:389-95.
17. Shields CL, Fasiuddin AF, Mashayekhi A, et al. Nevos conjuntivales: características clínicas y evolución natural en 410 pacientes consecutivos. Arch Ophthalmol. 2004;122:167-75.
18. Gerner N, Norregaard JC, Jensen OA, Prause JU. Conjuntival naevi in Denmark 1960-1980. Un estudio de seguimiento de 21 años. Acta Oftalmol Scand. 1996;74:334-7.
19. Shields JA, Shields CL, Mashayekhi A, et al. Melanosis primaria adquirida de la conjuntiva: riesgos de progresión a melanoma en 311 ojos. El 2006 Lorenz E. Zimmerman conferencia. Oftalmología. 2008;115:511-9.
20. Escudos CL, Kaliki S, Al-Dahmash S, et al. La clasificación clínica del American Joint Committee on Cancer (AJCC) predice los desenlaces del melanoma conjuntival. Cirugía Plástica de Reconstrucción de Ophthalm 2012; 5:313-23.
21. Sagiv O, Thakar SD, Kandl TJ, et al. Inmunoterapia con inhibidores de muerte celular programada 1 para 5 pacientes con melanoma conjuntival. JAMA Ophthalmol. 2018 Nov 1; 136 (11): 1236-41.
22. Dalvin LA, Shields CL, Orloff M, et al. Terapia inmunitaria con inhibidores de puntos de control. Indicaciones sistémicas y efectos secundarios oftálmicos. Retina. 2018;6:1063-78.