17.3: La Formation d’Ions Complexes
L’Effet de la Formation d’Ions Complexes sur la Solubilité
Qu’advient-il de la solubilité d’un sel peu soluble si un ligand qui forme un ion complexe stable est ajouté à la solution? Un tel exemple se produit dans la photographie conventionnelle en noir et blanc. Rappelons que le film photographique noir et blanc contient des microcristaux sensibles à la lumière d’AgBr, ou des mélanges d’AgBr et d’autres halogénures d’argent. AgBr est un sel peu soluble, avec un Ksp de 5,35 × 10-13 à 25°C. Lorsque l’obturateur de la caméra s’ouvre, la lumière de l’objet photographié frappe certains des cristaux sur le film et déclenche une réaction photochimique qui convertit l’AgBr en métal Ag noir. Des images négatives bien formées et stables apparaissent dans des tons de gris, correspondant au nombre de grains d’AgBr convertis, les zones les plus exposées à la lumière étant les plus sombres. Pour fixer l’image et empêcher la conversion de plus de cristaux d’AgBr en métal Ag pendant le traitement du film, l’AgBr n’ayant pas réagi sur le film est éliminé à l’aide d’une réaction de complexation pour dissoudre le sel peu soluble.
La réaction de dissolution du bromure d’argent est la suivante:
\
avec
\
L’équilibre se trouve loin à gauche et les concentrations d’équilibre des ions Ag+ et Br- sont très faibles (7,31 × 10-7 M). En conséquence, l’élimination de l’AgBr n’ayant pas réagi d’un seul rouleau de film à l’aide d’eau pure nécessiterait des dizaines de milliers de litres d’eau et beaucoup de temps. Le principe de Le Chatelier nous dit cependant que nous pouvons conduire la réaction vers la droite en retirant l’un des produits, ce qui provoquera la dissolution de plus d’AgBr. L’ion bromure est difficile à éliminer chimiquement, mais l’ion argent forme une variété de complexes stables à deux coordonnées avec des ligands neutres, tels que l’ammoniac, ou avec des ligands anioniques, tels que le cyanure ou le thiosulfate (S2O32−). Dans le traitement photographique, l’excès d’AgBr est dissous à l’aide d’une solution concentrée de thiosulfate de sodium.
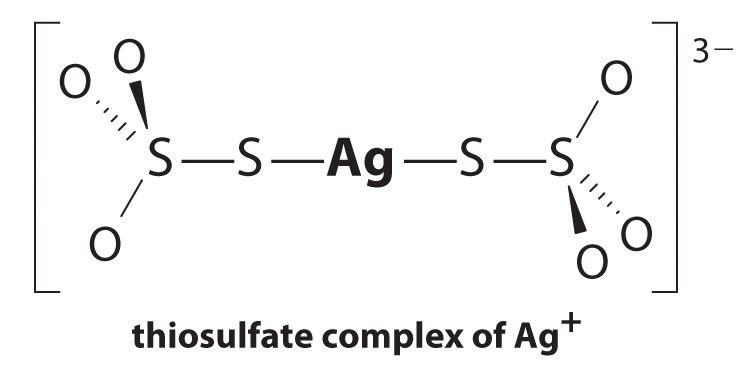
La réaction d’Ag+ avec le thiosulfate est la suivante:
\^{3−}_{( aq) }\étiquette {17.3.5a }\]
avec
\
L’amplitude de la constante d’équilibre indique que presque tous les ions Ag+ en solution seront immédiatement complexés par le thiosulfate pour former 3−. Nous pouvons voir l’effet du thiosulfate sur la solubilité de l’AgBr en écrivant les réactions appropriées et en les additionnant:
\\ \ j’ai besoin de l’aide de l’utilisateur pour savoir si vous avez besoin de l’aide de l’utilisateur.9\ fois10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\ textrm f} = 15\end {align}\label{17.3.6}\)
La comparaison de K avec Ksp montre que la formation de l’ion complexe augmente la solubilité de l’AgBr d’environ 3 × 1013. L’augmentation spectaculaire de la solubilité combinée au faible coût et à la faible toxicité explique pourquoi le thiosulfate de sodium est presque universellement utilisé pour le développement de films en noir et blanc. Si désiré, l’argent peut être récupéré de la solution de thiosulfate en utilisant l’une des méthodes suivantes et recyclé.
Si un ion complexe a un Kf important, la formation d’un ion complexe peut augmenter considérablement la solubilité de sels peu solubles.
Exemple \(\PageIndex{2}\)
En raison de l’effet ionique commun, on peut s’attendre à ce qu’un sel tel que AgCl soit beaucoup moins soluble dans une solution concentrée de KCl que dans l’eau. Une telle hypothèse serait cependant incorrecte, car elle ignore le fait que l’ion argent tend à former un complexe à deux coordonnées avec les ions chlorure (AgCl2-). Calculer la solubilité de l’AgCl dans chaque situation:
- dans de l’eau pure
- dans une solution de KCl 1,0 M, en ignorant la formation d’ions complexes
- la même solution que dans la partie (b), sauf en tenant compte de la formation d’ions complexes, en supposant que AgCl2− est le seul complexe Ag+ qui se forme en concentrations significatives
à 25 ° C, Ksp = 1,77 ×10-10 pour AgCl et Kf = 1 .1 × 105 pour AgCl2−.
Donné: Ksp d’AgCl, Kf d’AgCl2−, et Concentration de KCl
Demandé : solubilité d’AgCl dans l’eau et dans une solution de KCl avec et sans formation d’ions complexes
Stratégie:
- Écrivez l’expression du produit de solubilité pour AgCl et calculez la concentration d’Ag+ et de Cl- dans l’eau.
- Calculez la concentration d’Ag+ dans la solution de KCl.
- Écrivez des équations chimiques équilibrées pour la dissolution d’AgCl et pour la formation du complexe AgCl2. Ajoutez les deux équations et calculez la constante d’équilibre pour l’équilibre global.
- Écrivez l’expression de la constante d’équilibre pour la réaction globale. Résoudre pour la concentration de l’ion complexe.
Solution
- A Si l’on laisse x égale la solubilité d’AgCl, alors à l’équilibre == x M. En substituant cette valeur à l’expression du produit de solubilité,
Ainsi la solubilité d’AgCl dans l’eau pure à 25°C est de 1,33 × 10-5 M.
- B Si x est égal à la solubilité d’AgCl dans la solution de KCl, alors à l’équilibre = x M et = (1,0 + x) M. En substituant ces valeurs à l’expression du produit de solubilité et en supposant que x << 1.0,
Si l’effet ionique commun était le seul facteur important, nous prédirions que AgCl est environ cinq ordres de grandeur moins soluble dans une solution de KCl de 1,0 M que dans l’eau.
- C Pour tenir compte des effets de la formation d’ions complexes, nous devons d’abord écrire les équations d’équilibre pour la dissolution et la formation d’ions complexes. L’addition des équations correspondant à Ksp et Kf nous donne une équation qui décrit la dissolution d’AgCl dans une solution de KCl. La constante d’équilibre de la réaction est donc le produit de Ksp et Kf:
\\ \ mathrm{Ag^+(aq)} +\mathrm{2Cl^{-}} \rightleftharpoons\mathrm{^{-}}\hspace {3mm} K_\textrm f& = 1.1\times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\ textrm f} = 1,9\times10^{-5}\end{align}\)
D Si l’on laisse x égale la solubilité d’AgCl dans la solution de KCl, alors à l’équilibre = x et = 1,0−x. En substituant ces quantités à l’expression constante d’équilibre pour la réaction nette et en supposant que x << 1.0,
C’est−à-dire que AgCl se dissout dans 1,0 M de KCl pour produire une solution de 1,9 × 10-5 M de l’ion complexe AgCl2. Ainsi, nous prédisons que AgCl a approximativement la même solubilité dans une solution de 1,0 M de KCl que dans l’eau pure, ce qui est 105 fois plus élevé que celui prédit sur la base de l’effet ionique commun. (En fait, la solubilité mesurée d’AgCl dans 1,0 M de KCl est presque un facteur 10 supérieur à celle de l’eau pure, en grande partie due à la formation d’autres complexes contenant des chlorures.)
Exercice \(\PageIndex{2}\)
Calculer la solubilité de l’iodure de mercure (II) (HgI2) dans chaque situation:
- eau pure
- une solution de 3,0 M de NaI, en supposant que le 2- est la seule espèce contenant du Hg présente en quantités significatives
Ksp = 2,9 × 10-29 pour le HgI2 et Kf = 6,8 × 1029 pour le 2−.
Réponse
- 1.9 × 10-10 M
- 1.4 L
Les agents complexants, molécules ou ions qui augmentent la solubilité des sels métalliques en formant des complexes métalliques solubles, sont des composants courants des détergents à lessive. Les acides carboxyliques à longue chaîne, les principaux composants des savons, forment des sels insolubles avec le Ca2+ et le Mg2+, qui sont présents à des concentrations élevées dans l’eau “dure”. La précipitation de ces sels produit un anneau de baignoire et donne une teinte grise aux vêtements. L’ajout d’un agent complexant tel que le pyrophosphate (O3POPO34−, ou P2O74−) ou le triphosphate (P3O105−) aux détergents empêche les sels de magnésium et de calcium de précipiter car la constante d’équilibre pour la formation d’ions complexes est grande:
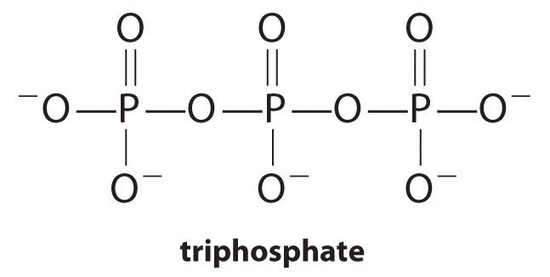
avec
Cependant, les phosphates peuvent causer des dommages à l’environnement en favorisant l’eutrophisation, la croissance de quantités excessives d’algues dans un plan d’eau, ce qui peut éventuellement entraîner une forte diminution des niveaux d’oxygène dissous qui tue les poissons et autres organismes aquatiques. Par conséquent, de nombreux États américains ont interdit l’utilisation de détergents contenant du phosphate, et la France a interdit leur utilisation à partir de 2007. Les détergents “sans phosphate” contiennent différents types d’agents complexants, tels que des dérivés de l’acide acétique ou d’autres acides carboxyliques. Le développement de substituts de phosphate est un domaine de recherche intense.
Les adoucisseurs d’eau commerciaux utilisent également un agent complexant pour traiter l’eau dure en faisant passer l’eau sur des résines échangeuses d’ions, qui sont des sels de sodium complexes. Lorsque de l’eau s’écoule sur la résine, l’ion sodium est dissous et les sels insolubles précipitent sur la surface de la résine. L’eau ainsi traitée a un goût plus salé en raison de la présence de Na +, mais elle contient moins de minéraux dissous.
Une autre application d’agents complexants se trouve en médecine. Contrairement aux rayons X, l’imagerie par résonance magnétique (IRM) peut donner des images relativement bonnes des tissus mous tels que les organes internes. L’IRM est basée sur les propriétés magnétiques du noyau 1H des atomes d’hydrogène dans l’eau, qui est un composant majeur des tissus mous. Parce que les propriétés de l’eau ne dépendent pas beaucoup du fait qu’elle se trouve à l’intérieur d’une cellule ou dans le sang, il est difficile d’obtenir des images détaillées de ces tissus qui ont un bon contraste. Pour résoudre ce problème, les scientifiques ont développé une classe de complexes métalliques appelés “agents de contraste IRM.”L’injection d’un agent de contraste IRM chez un patient affecte sélectivement les propriétés magnétiques de l’eau dans les cellules des tissus normaux, dans les tumeurs ou dans les vaisseaux sanguins et permet aux médecins de “voir” chacun d’eux séparément (Figure \ (\PageIndex{2}\)). L’un des ions métalliques les plus importants pour cette application est Gd3+, qui, avec sept électrons non appariés, est hautement paramagnétique. Parce que le Gd3 + (aq) est assez toxique, il doit être administré sous la forme d’un complexe très stable qui ne se dissocie pas dans le corps et peut être excrété intact par les reins. Les agents complexants utilisés pour le gadolinium sont des ligands tels que le DTPA5- (acide diéthylène triamine pentaacétique), dont la forme entièrement protonée est représentée ici.
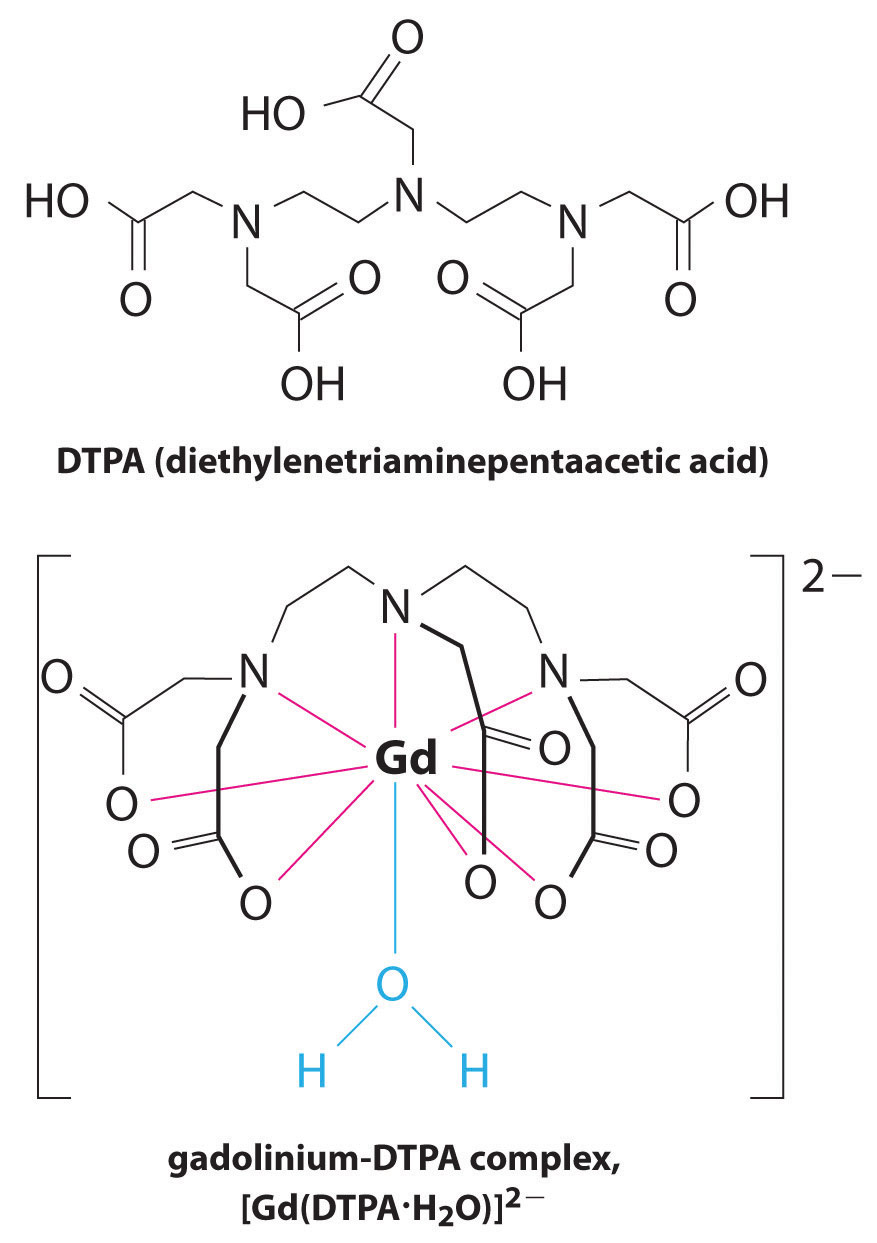
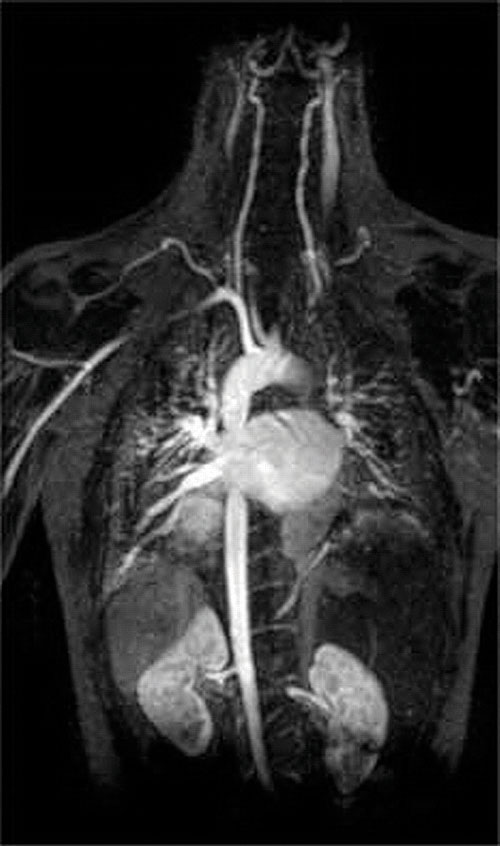
Figure \(\PageIndex{2}\): Une image IRM du Cœur, des Artères et des Veines. Lorsqu’un patient reçoit une injection d’un cation métallique paramagnétique sous la forme d’un complexe stable appelé agent de contraste IRM, les propriétés magnétiques de l’eau dans les cellules sont altérées. Parce que les différents environnements de différents types de cellules réagissent différemment, un médecin peut obtenir des images détaillées des tissus mous.