2.3: Monoxyde de carbone et reliure
Propriétés générales
Le CO est un ligand datif de type L qui n’affecte pas l’état d’oxydation du centre métallique lors de la liaison, mais augmente le nombre total d’électrons de deux unités. Nous avons récemment vu qu’il y a vraiment deux interactions de liaison en jeu dans le ligand carbonyle: une interaction ligand-métal n → dσ et une interaction métal-ligand dn → π *. Cette dernière interaction est appelée liaison arrière, car le métal redonne de la densité électronique au ligand. Pour me rappeler l’existence de la liaison arrière, j’aime utiliser la structure de résonance de droite dans la mesure du possible; cependant, il est important de se rappeler de traiter le CO comme un ligand de type L, quelle que soit la forme de résonance dessinée.

Interactions orbitales dans M = C = O.
Le CO est un donneur σ fort (ou σ-base) et un bon accepteur π (ou π-acide). Les propriétés du CO ligoté dépendent profondément de l’identité du centre métallique. Plus précisément, les propriétés électroniques du centre métallique dictent l’importance de la liaison arrière dans les complexes carbonyles métalliques. Plus franchement, les centres métalliques plus riches en électrons sont meilleurs pour se lier au CO. Pourquoi est-il important de vérifier la force du lien arrière?
La spectroscopie infrarouge a été utilisée de manière célèbre pour soutenir empiriquement l’idée de liaison arrière. Le tableau ci-dessous organise certains complexes carbonyles métalliques dans l’ordre “périodique” et fournit la fréquence correspondent au mode d’étirement C=O. Notez que sans exception, chaque CO complexé a une fréquence d’étirement inférieure à celle du CO libre. Le lien arrière est à blâmer! L’ordre de liaison C–O dans le monoxyde de carbone complexé est (presque toujours) inférieur à celui du CO libre.

C = O fréquences d’étirement dans les complexes métal-carbonyle. Il y a quelque chose ici ?
La figure ci-dessus représente une nette augmentation de la fréquence (une augmentation de l’ordre des liaisons C–O) lorsque nous nous déplaçons de gauche à droite dans le tableau périodique. Cette découverte peut sembler étrange si l’on considère que le nombre d’électrons d dans le métal neutre augmente à mesure que nous nous déplaçons de gauche à droite. Les centres métalliques avec plus d’électrons d ne devraient-ils pas être meilleurs à la liaison arrière (et plus “riches en électrons”)? Que se passe-t-il ici ? Rappelez-vous la tendance périodique de l’énergie orbitale. Lorsque nous nous déplaçons de gauche à droite, les énergies orbitales d diminuent et les énergies des orbitales dn et π * se séparent. En conséquence, l’interaction orbitale de liaison arrière s’aggrave (rappelez-vous que les interactions orbitales fortes nécessitent des énergies orbitales bien appariées) à mesure que nous nous dirigeons vers les métaux de transition tardive plus électronégatifs! Nous pouvons faire une analogie avec les enamines et les éthers énol de la chimie organique. L’atome d’oxygène plus électronégatif dans les éthers d’énol est un plus mauvais donneur d’électrons que l’atome d’azote de l’énamine.

L’importance de la liaison arrière dépend de l’électronégativité du métal et de sa densité électronique.
Bien sûr, la contribution d’autres ligands sur le centre métallique à la liaison arrière ne peut pas non plus être oubliée. Logiquement, les ligands donnant des électrons auront tendance à renforcer la liaison arrière (ils font du métal un meilleur donneur d’électrons), tandis que les ligands retirant des électrons aggraveront la liaison arrière. L’ajout de ligands phosphines riches en électrons à un centre métallique, par exemple, diminue la fréquence d’étirement du CO en raison de l’amélioration de la liaison arrière.
Les ligands carbonyles sont réputés capables de relier plusieurs centres métalliques. La liaison dans les complexes carbonyles pontés peut être soit ” traditionnelle “, soit délocalisée, selon la structure du complexe et le mode de pontage. La variété des modes de pontage provient des différents donneurs et accepteurs d’électrons présents sur le ligand CO (et de la possibilité de liaison délocalisée). Les modes de pontage connus sont représentés sur la figure ci-dessous.
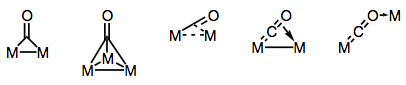
Construire des ponts avec des ligands carbonyles!