3.3 Conformation du Cyclohexane
Conformations du Cyclohexane
Une structure plane du cyclohexane est clairement improbable. Les angles de liaison seraient nécessairement 120º, 10,5º plus grands que l’angle tétraédrique idéal. En outre, chaque liaison carbone-carbone dans une telle structure serait éclipsée. L’angle et les contraintes d’éclipses qui en résulteraient déstabiliseraient gravement cette structure. Si deux atomes de carbone des côtés opposés du cycle à six chaînons sont soulevés hors du plan du cycle, une grande partie de la déformation angulaire peut être éliminée.
Cette structure de bateau a encore deux liaisons éclipsées et un empilement stérique sévère de deux atomes d’hydrogène sur la “proue” et la “poupe” du bateau. Cet encombrement stérique est souvent appelé obstacle stérique. En tordant la conformation du bateau, l’obstacle stérique peut être partiellement soulagé, mais le conformateur twist-boat conserve encore certaines des contraintes qui caractérisent le conformateur du bateau. Enfin, en soulevant un carbone au-dessus du plan de l’anneau et l’autre au-dessous du plan, on forme un conformeur de “chaise” relativement sans contrainte. C’est la structure prédominante adoptée par les molécules de cyclohexane.
Des recherches sur les conformations du cyclohexane ont été initiées par H. Sachse (1890) et E. Mohr (1918), mais ce n’est qu’en 1950 qu’un traitement complet des conséquences multiples des conformères de chaise interconvertissantes et des différentes orientations des liaisons pendantes a été élucidé par D. H. R. Barton (Prix Nobel 1969 avec O. Hassel). La discussion suivante présente certaines des caractéristiques essentielles de cette analyse conformationnelle.
Après un examen attentif d’une conformation de chaise de cyclohexane, nous constatons que les douze hydrogènes ne sont pas structurellement équivalents. Six d’entre eux sont situés à la périphérie de l’anneau de carbone et sont appelés équatoriaux. Les six autres sont orientées au-dessus et au-dessous du plan approximatif de l’anneau (trois à chaque emplacement), et sont dites axiales car elles sont alignées parallèlement à l’axe de symétrie de l’anneau.
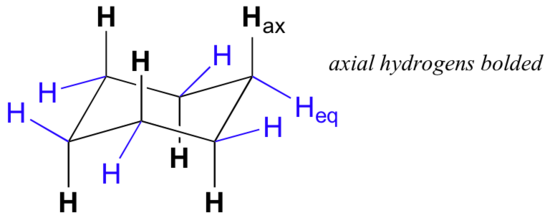
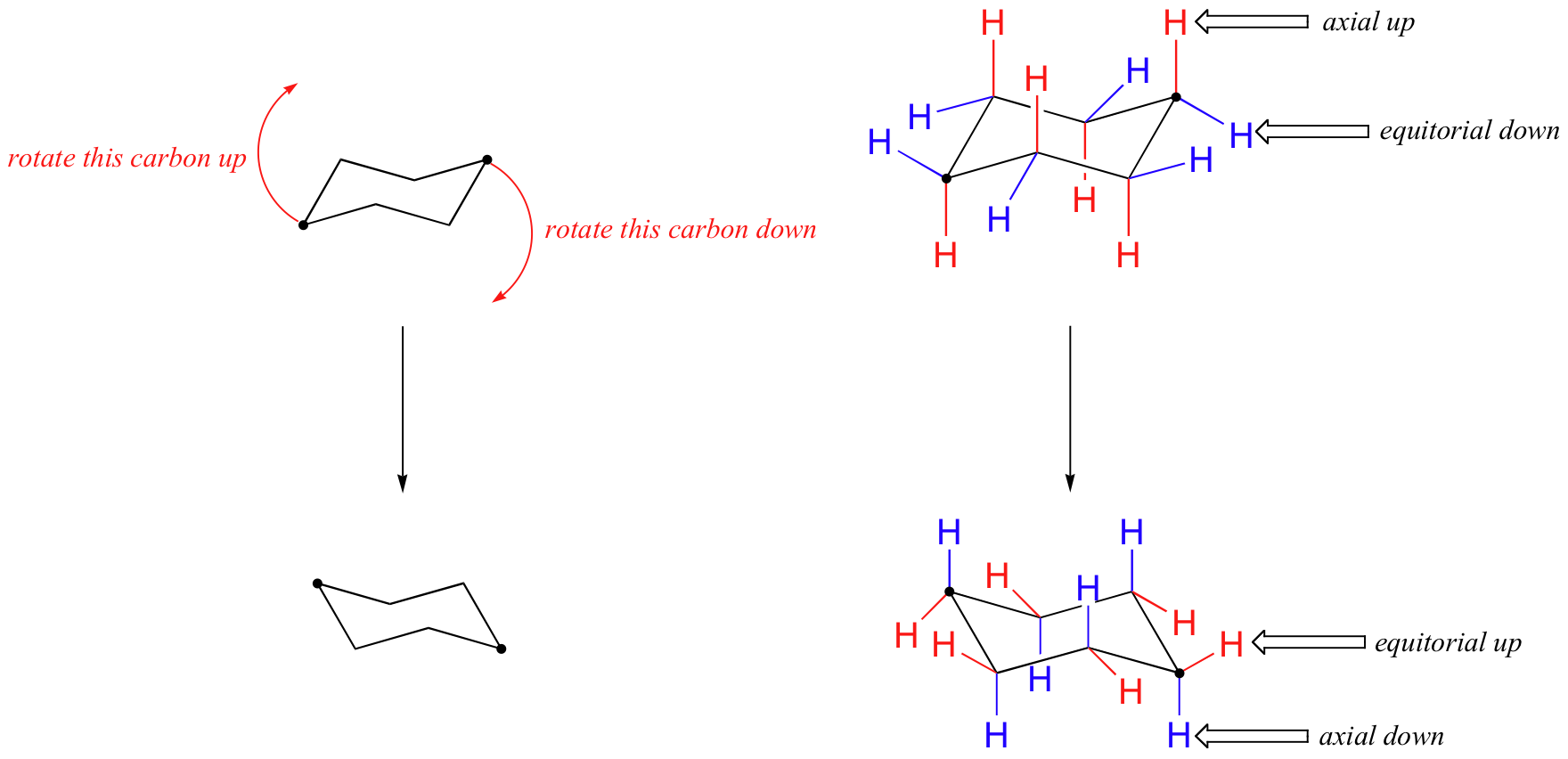
Sur la figure ci-dessus, les hydrogènes équatoriaux sont colorés en bleu et les hydrogènes axiaux sont en gras. Comme il existe deux conformations de chaise équivalentes du cyclohexane en équilibre rapide, les douze hydrogènes ont 50% de caractère équatorial et 50% de caractère axial. La figure ci-dessous illustre comment convertir un modèle moléculaire de cyclohexane entre deux conformations de chaise différentes – c’est quelque chose que vous devriez pratiquer avec des modèles. Notez qu’un “retournement d’anneau” fait que les hydrogènes équatoriaux deviennent axiaux, et vice-versa.
Les liaisons axiales étant parallèles les unes aux autres, les substituants plus grands que l’hydrogène souffrent généralement d’un encombrement stérique plus important lorsqu’ils sont orientés axialement plutôt qu’équatorial. Par conséquent, les cyclohexanes substitués adopteront préférentiellement des conformations dans lesquelles les substituants les plus grands prennent une orientation équatoriale.
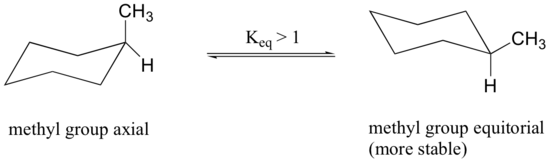
Lorsque le groupe méthyle dans la structure ci-dessus occupe une position axiale, il subit un encombrement stérique par les deux hydrogènes axiaux situés du même côté du cycle.

La conformation dans laquelle le groupe méthyle est équatorial est plus stable, et donc l’équilibre se situe dans cette direction.
L’entrave stérique relative subie par différents groupes substituants orientés en position axiale versus équatoriale sur le cyclohexane peut être déterminée par l’équilibre conformationnel du composé. La constante d’équilibre correspondante est liée à la différence d’énergie entre les conformères, et la collecte de telles données nous permet d’évaluer la tendance relative des substituants à exister dans un emplacement équatorial ou axial.Un tableau de ces valeurs d’énergie libre (parfois appelées valeurs A) peut être examiné en cliquant ici.
En regardant les valeurs d’énergie de ce tableau, il est clair que la “taille” apparente d’un substituant (en termes de préférence pour l’orientation équatoriale par rapport à l’orientation axiale) est influencée par sa largeur et sa longueur de liaison au cyclohexane, comme en témoigne le fait qu’un groupe vinyle axial est moins gêné que l’éthyle et l’iode légèrement moins que le chlore.
Nous avons noté précédemment que les cycloalcanes ayant deux substituants ou plus sur différents atomes de carbone du cycle existent sous la forme d’une paire (parfois plus) de stéréoisomères de configuration. Nous devons maintenant examiner la manière dont les conformations de cycles favorables influencent les propriétés des isomères de configuration. Rappelez-vous que les stéréoisomères configurationnels sont stables et ne s’interconvertissent pas facilement, alors que les isomères conformationnels s’interconvertissent normalement rapidement. Pour examiner les structures possibles des cyclohexanes substitués, il est utile de suivre deux principes:
( i) Les conformations de chaise sont généralement plus stables que les autres possibilités.
(ii) Les substituants sur les conformateurs de chaise préfèrent occuper des positions équatoriales en raison de l’obstacle stérique accru des emplacements axiaux.
Les équations et formules suivantes illustrent comment la présence de deux substituants ou plus sur un cycle cyclohexane perturbe l’interconversion des deux conformères de chaise d’une manière qui peut être prédite.
Dans le cas des cyclohexanes 1,1-disubstitués, l’un des substituants doit nécessairement être axial et l’autre équatorial, quel que soit le conformère de chaise considéré. Les substituants étant les mêmes dans le 1,1-diméthylcyclohexane, les deux conformères sont identiques et présents à concentration égale. Dans le 1-t-butyl-1-méthylcyclohexane, le groupe t-butyle est beaucoup plus grand que le méthyle, et le conformère de chaise dans lequel le plus grand groupe est équatorial sera favorisé à l’équilibre (> 99%). Par conséquent, le groupe méthyle de ce composé est presque exclusivement axial dans son orientation.
Dans le cas des composés 1,2-, 1,3- et 1,4-disubstitués, l’analyse est un peu plus complexe. Il est toujours possible d’avoir les deux groupes équatorial, mais que cela nécessite une relation cis ou une relation trans dépend de l’emplacement relatif des substituants. Comme nous comptons autour de l’anneau du carbone #1 à #6, la liaison la plus haute sur chaque carbone change d’orientation de l’équatorial (ou axial) à l’axial (ou équatorial) et en arrière. Il est important de se rappeler que les liaisons d’un côté donné d’une conformation d’anneau de chaise alternent toujours de cette manière. Par conséquent, il doit être clair que pour la disubstitution cis-1,2, l’un des substituants doit être équatorial et l’autre axial; dans l’isomère trans, les deux peuvent être équatoriaux. En raison de la nature alternée des liaisons équatoriales et axiales, la relation inverse est vraie pour la 1,3-disubstitution (cis est tout équatorial, trans est équatorial /axial).
Enfin, la restitution 1,4 revient au modèle 1,2:
L’analyse ci-dessus n’est pas quelque chose que vous devriez essayer de mémoriser: au contraire, soyez à l’aise avec le dessin du cyclohexane dans la conformation de la chaise, avec des liaisons pointant dans les bonnes directions pour les substituants axiaux et équatoriaux. Si vous pouvez dessiner une structure correctement dans la conformation de la chaise, vous devriez toujours être en mesure de déterminer quelles positions sont axiales et lesquelles sont équatoriales.