7.4: Complexes III
Le Complexe III accepte les électrons du Complexe I et du Complexe II. Les électrons arrivent sous forme d’ubiquinol, UQH2, qui délivre deux électrons et deux protons et est reconverti en ubiquinone, UQ. L’ubiquinone retourne ensuite au Complexe I ou au Complexe II pour collecter plus d’électrons.
- Le Complexe III est la destination des électrons arrivant à la fois du Complexe I et du Complexe II.
- Le complexe III utilise l’énergie libérée lors des transferts d’électrons en descente pour pomper plus de protons à travers la membrane mitochondriale interne.
- Le gradient de protons à travers la membrane est utilisé pour entraîner la formation d’ATP au Complexe V.
- Le Complexe III envoie ensuite ses électrons au Complexe IV.
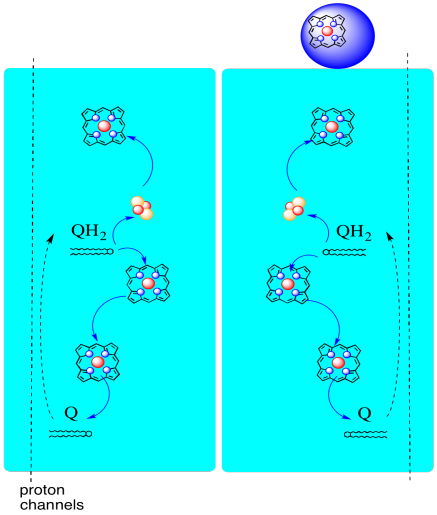
Le chemin des électrons à travers le complexe III est illustré ci-dessous. Notez que le complexe est une structure dimérique, avec deux chemins équivalents: l’un montré à gauche et l’autre à droite. Les électrons sont délivrés de l’UQH2, l’ubiquinol, au milieu de l’image, se déplaçant vers le haut jusqu’au cytochrome c mobile en haut. Une deuxième voie électronique permet de descendre dans l’image, vers une autre molécule d’ubiquinone, qui recycle les électrons en boucle.
- Le complexe III présente une voie d’électrons inhabituelle et divergente.
- Un électron se dirige vers le cytochrome c.
- Le deuxième électron est finalement recyclé en un autre ubiquinol.
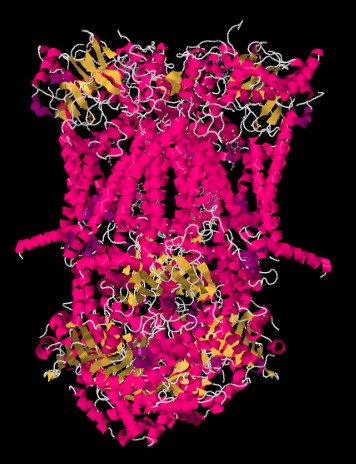
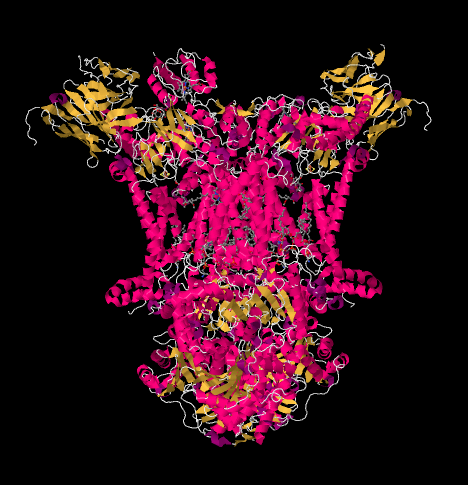
La structure des rayons X du complexe III est illustrée ci-dessous sous forme de dessin animé. La membrane mitochondriale interne couperait la partie moyenne supérieure du complexe. La majorité des projets complexes ci-dessous, dans la matrice (le bas de l’image, dans cette orientation) bien qu’une quantité importante dépasse également dans l’espace intermembranaire.
Le complexe III poursuit la chaîne de transport des électrons, envoyant les électrons vers un potentiel de réduction plus élevé (et une énergie libre plus faible) et vers une rencontre avec l’oxygène moléculaire dans le Complexe IV. Les protons sont également pompés à partir de la matrice mitochondriale, à travers la membrane mitochondriale interne et dans l’espace intermembranaire. En même temps, une deuxième voie électronique entraîne un recyclage efficace de la moitié des électrons qui entrent dans le complexe, augmentant le nombre de protons pompés par électron arrivant au Complexe III.
- Il a été suggéré que la boucle de recyclage des électrons fournit un mécanisme pour tirer plus de protons de la matrice.
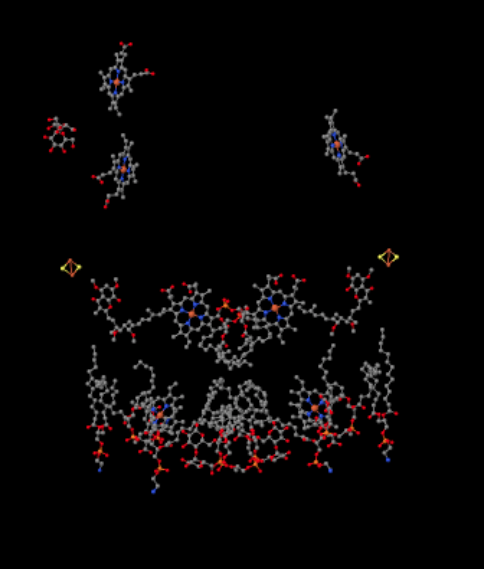
Nous pouvons voir cet arrangement inhabituel si nous ignorons les protéines pour révéler les ligands, ci-dessous. Le complexe peut plus clairement être vu comme un dimère; la moitié gauche de l’image est exactement la même que la droite, bien que reflétée dans le sens inverse. Les électrons entrent dans le complexe via le support mobile, l’ubiquinol, visible à droite et à gauche de l’image à mi-chemin; vous pouvez voir l’anneau et une chaîne qui y est suspendue.
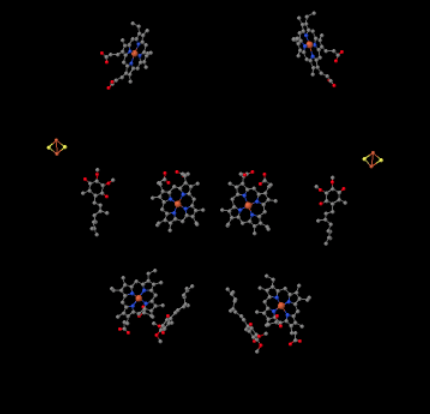
Lorsque UQH2 se lie au Complexe III, un électron est envoyé à un amas de FeS, tandis que le second est envoyé à un centre d’hème de fer, appelé hème BL. L’amas de FeS est visible juste au-dessus de l’ubiquinol et jusqu’au bord de l’image. L’hème BL est vers le centre de l’image.
Bien que cela ne soit pas apparent sur l’image radiographique montrée, ce groupe de FeS est différent de ceux que vous avez vus précédemment. Celui-ci est maintenu en place avec différentes chaînes latérales d’acides aminés. Vous ne pouvez pas voir cela sur l’image parce que la protéine entière a été laissée de côté, ainsi que les acides aminés qui se lient au cluster. Alors que la plupart des amas de FeS sont maintenus en place exclusivement par des cystéines, cet amas est maintenu en place par deux cystéiens d’un côté mais par deux histidines de l’autre. Ce cluster Fes particulier s’appelle un cluster Rieske.
Les grappes de Rieske sont importantes car ce sont des “grappes de FeS à fort potentiel”. Cela signifie qu’ils ont des potentiels de réduction exceptionnellement positifs par rapport aux autres clusters FeS. Le potentiel de réduction de tout ligand d’une protéine dépend fortement de son environnement, et il existe donc un large éventail de valeurs dans la plupart des cas. C’est vrai pour les amas de soufre de fer; les amas normaux ont des potentiels de réduction allant de -1,0 V à environ + 0,05 V. Les amas de Rieske ont des potentiels allant d’environ 0V à environ 0,4 V.
À partir de l’amas de FeS, l’électron est envoyé vers un autre centre hémique de fer dans une unité liée à la membrane appelée cytochrome c1. Le cytochrome c1 peut être vu en haut de l’image. Parce que cette image est orientée de la même manière que les autres structures de rayons X du complexe respiratoire, nous pouvons voir que cet électron est transporté vers l’espace intermembranaire. Enfin, cet électron est transféré à un autre hème, mais cet hème est lié à une petite protéine mobile, appelée cytochrome c. Le cytochrome c est un autre porteur d’électrons mobile. Il transporte l’électron sur le complexe IV. Nous reviendrons au cytochrome c un peu plus tard.
Avant d’en arriver là, où va l’autre électron? De l’hème BL, le deuxième électron est transmis à un autre complexe de porphyrine de fer, l’hème BH. C’est vers le bas de l’image, donc cet électron est en fait renvoyé vers la matrice. En attendant l’hème BL, cependant, il existe une autre ubiquinone, UQ. Il attend l’électron. Il en attendra en fait deux, puis quittera son quai et retournera au site de liaison de l’ubiquinol (UQH2) pour délivrer à nouveau les électrons.
Pourquoi s’embêter? Pourquoi ne pas simplement envoyer les électrons sur leur chemin correctement la première fois? Il semble qu’ils soient recyclés pour une raison quelconque. On pense que cette déviation permet de pomper des protons supplémentaires à travers la membrane mitochondriale. Lorsque la deuxième ubiquinone est réduite en ubiquinol par l’acceptation de deux électrons, elle capte également deux autres protons de la matrice ci-dessous. Ces protons finiront par être transmis vers l’espace intermembranaire lorsque l’ubiquinol sera à nouveau oxydé. Ce recyclage, et la compression de quelques protons supplémentaires pour augmenter le gradient de protons, s’appelle la boucle Q.
L’avantage de la boucle Q est expliqué dans le diagramme suivant. Dans le diagramme, les entrées du complexe III sont indiquées en rouge, les sorties en bleu et les éléments recyclés en vert. Si un ubiquinol livrait simplement ses électrons et ses protons et était fait, il y aurait deux protons délivrés par ubiquinol. C’est une sortie de proton par électron qui a été entrée.
Un deuxième ubiquinol ferait exactement la même chose. Il y aurait quatre protons en sortie pour quatre électrons initialement entrés. C’est toujours une sortie de proton par électron qui a été entrée.
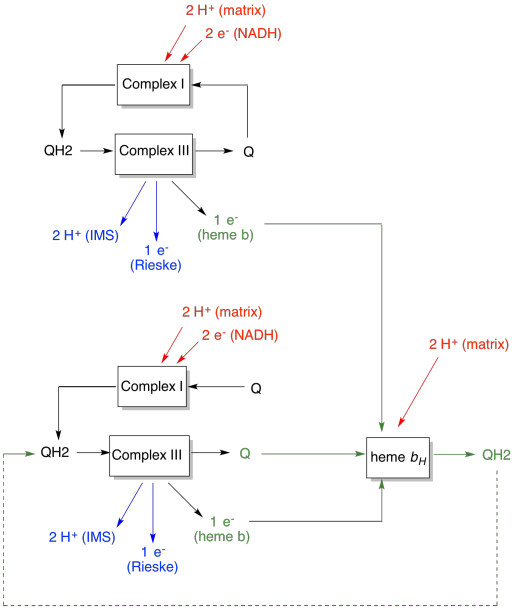
Si, au lieu de cela, un électron est recyclé à chaque fois, chaque seconde d’ubiquinol entraîne la délivrance d’une paire supplémentaire de protons. En effet, en récupérant les électrons recyclés, une ubiquinone a dû retourner du côté de la matrice de la membrane et ramasser deux autres protons. Dans l’ensemble, cela signifie que six protons sont délivrés pour une entrée de quatre électrons, soit une sortie de 1,5 protons par entrée d’électrons. Puisque le gradient de protons est ce qui génère l’ATP, alors en augmentant le nombre de protons pompés par électron entrant, l’efficacité est augmentée.
- La boucle Q augmente le nombre de protons pompés par électron entrant dans le système.
Revenons maintenant au porteur d’électrons sortant, le cytochrome c, qui transportera les électrons sur le Complexe IV. Dans l’image ci-dessous, à partir d’une structure cristalline à rayons X différente, le Complexe a été trouvé avec un amarrage cyctochrome c au site de liaison. Le cytochrome c est une protéine globulaire rose attachée en haut de l’image, sur la moitié gauche du dimère tel que nous le regardons ici. Il est assis au bord de l’espace intermembranaire, qui est un milieu aqueux. Contrairement à l’ubiquinone, qui glisse à travers la bicouche lipidique de la membrane, le cytochrome c roule ou glisse ou nage sur le dessus jusqu’à sa destination.
La même vue est montrée ci-dessous sans la protéine. La partie inférieure de l’image est assez encombrée de lipides, et il y a un sucre qui traîne en haut à gauche, mais tout en haut, vous pouvez voir la porphyrine de fer qui est nichée à l’intérieur du cytochrome c.
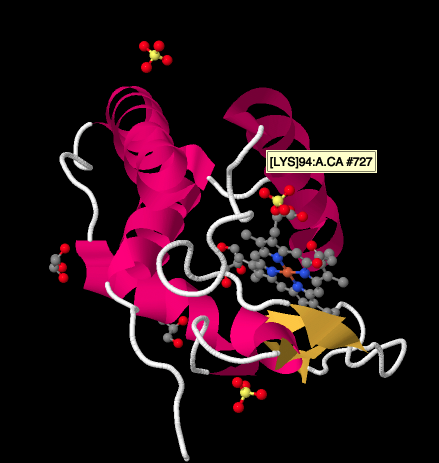
Un examen plus approfondi de la structure radiologique d’un cyctochrome c, ci-dessous, montre une image relativement simple par rapport aux complexes que nous avons examinés. Il y a quelques hélices, quelques feuilles, quelques boucles, et cette porphyrine ou hème de fer à nouveau. Quelques ions sulfate flottent à proximité, ainsi que quelques molécules de glycérol, probablement introduites lors de la purification ou de la cristallisation de la protéine. Notez que l’hème se trouve au bord de la protéine. Cet emplacement peut faciliter le transfert d’électrons du Complexe III ou du Complexe IV.
- Le cytochrome c est la destination finale des électrons se déplaçant à travers le complexe III.
- Le cytochrome c est un porteur mobile à un électron.
- Le cytochrome c est en fait une petite protéine hydrophile.
- Le cytochrome c se trouve au-dessus de la membrane mitochondriale, au bord de l’espace intermembranaire.
Qu’est-ce qui empêche le cyctochrome c d’errer dans l’espace intermembranaire? S’il le faisait, il interromprait le flux efficace des électrons. Il est possible que le cytochrome c se déplace d’avant en arrière entre le Complexe III et le Complexe IV via un mécanisme appelé “pilotage”. En direction, le porteur est guidé le long d’une voie par l’intermédiaire de charges complémentaires. Par exemple, si la membrane est chargée négativement en raison de groupes polaires à la surface de la membrane, des charges positives à la surface du cytochrome c peuvent restreindre son mouvement à la surface de la membrane. Cela seul réduirait sa mobilité de trois dimensions (n’importe où dans l’espace intermembranaire) à deux dimensions (n’importe où sur la surface de la membrane). Il est possible que des interactions supplémentaires réduisent encore sa mobilité jusqu’à une piste unidimensionnelle entre les deux complexes.
- La direction, basée sur des charges complémentaires, empêche le cytochrome c d’être perdu dans l’espace intermembranaire.
Exercice \(\PageIndex{1}\)
Suggérez d’éventuels résidus d’acides aminés à la surface du cytochrome c qui pourraient l’aider à rester sur une surface membranaire chargée négativement.
Réponse
L’arginine et la lysine sont chargées positivement à pH neutre.
Exercice \(\PageIndex{2}\)
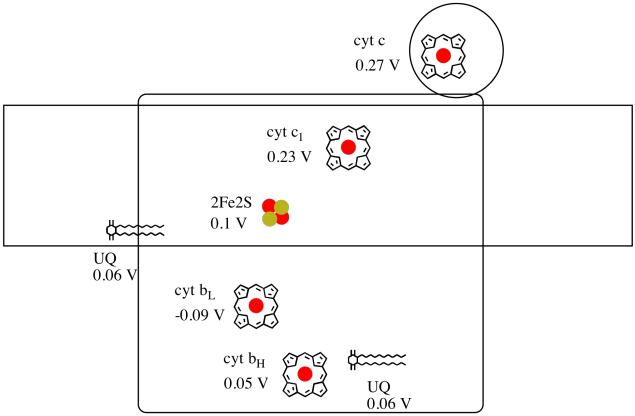
Il est difficile de mesurer le potentiel de réduction d’un site individuel au sein d’une protéine. Cependant, les chercheurs ont pu estimer ces valeurs en mesurant les spectres EPR dans diverses conditions. En supposant les potentiels de réduction ci-dessous, dessinez un diagramme de progression de la réaction pour le transport d’un électron depuis le donneur d’ubiquinone initial jusqu’au cytochrome c.
 Réponse
Réponse
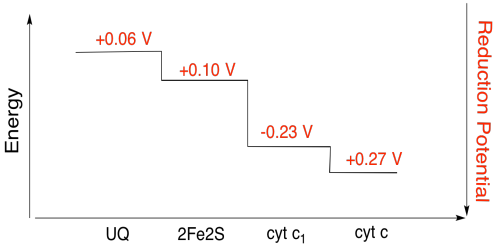
Exercice \(\PageIndex{3}\)
En utilisant les valeurs de la figure ci-dessus, calculez le changement d’énergie lorsqu’un électron est transféré du cluster 2Fe2S au cytochrome c1.
Réponse
En supposant que les potentiels de réduction sont:
2Fe2S (ox) + e- → 2Fe2S (rouge) Eored = 0,10 V
cyt c1 (ox) + e- → cyt c1 (rouge) Eored = 0,230 V
Alors la différence de potentiel pour la réaction, ΔEo = 0,23 – (0,10) V = 0,13 V.
La relation de Faraday ΔG = – n F ΔEo donne
ΔG = – 1 x 96 485 J V – 1 mol – 1 x 0,13 V = 12 543 J mol-1 = 12.5 kJ mol-1
Exercice \(\PageIndex{4}\)
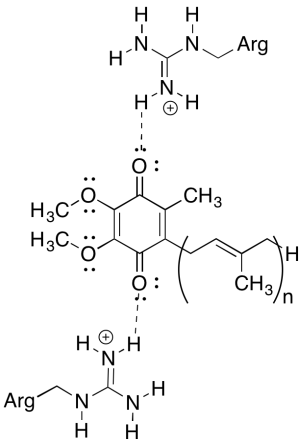
Une des choses déroutantes à propos de ce complexe est que, dans la boucle de recyclage des électrons, le transfert d’électrons semble passer d’une ubiquinone initiale à une ubiquinone finale, sans force motrice globale. Cependant, les potentiels de réduction sont très sensibles à l’environnement. Montrez comment les résidus d’arginine à proximité pourraient rendre le potentiel de réduction d’une ubiquinone plus positif.
Réponse
Les résidus d’arginine positifs conféreraient une charge positive partielle à l’ubiquinone par liaison hydrogène; l’ubiquinone aurait un potentiel de réduction plus positif en conséquence.
Voir la page focus sur la structure du complexe III sur Biochemistry Online.
Structure cristalline aux rayons X du Complexe III de: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. Base structurelle de la réduction de la quinone dans le complexe bc1: analyse comparative des structures cristallines du cytochrome mitochondrial bc1 avec substrat lié et inhibiteurs au site Qi. Biochimie 2003, 4, 9067-9080. (1NTZ)
Structure cristalline à rayons X du Complexe III avec cytochrome c lié de: Solmaz, S.R., Hunte, C. Structure du complexe III avec cytochrome c lié à l’état réduit et définition d’une interface de noyau minimale pour le transfert électronique. J. Biol. Chem. 2008, 283, 17542-17549. (3CXH)
Structure cristalline aux rayons X du cytochrome c de: Enguita, F.J., Pohl, E., Turner, D.L., Santos, H., Carrondo, M.A. Preuve structurelle d’une voie de transfert de protons couplée à une réduction du cytochrome c par hème ” de Methylophilus methylotrophus. J. Biol. Inorg. Chem. 2006 11, 189. (1 OAE)
Attribution
Chris P Schaller, Ph.D., (Collège Saint-Benoît / Université Saint-Jean)