7.5: Complexe IV
Le complexe IV est la destination finale dans la chaîne de transport d’électrons. Ici, les électrons qui ont traversé les autres membres du supercomplexe respiratoire sont finalement délivrés à O2, le réduisant en eau. C’est un exploit impressionnant, car un certain nombre d’espèces réactives de l’oxygène doivent être formées entre l’ajout initial d’un électron et la libération finale d’eau, mais la réaction est contrôlée de manière à minimiser les risques de dommages cellulaires. En même temps, plus de protons sont pompés à travers la membrane mitochondriale interne.
- Dans le Complexe IV, les électrons sont livrés à leur destination finale, une molécule d’O2.
- L’O2 est réduit en eau.
Exercice \(\PageIndex{1}\)
Écrivez une demi-réaction redox équilibrée pour montrer combien d’électrons sont nécessaires pour réduire une molécule d’oxygène en eau.
Réponse
O2 → H2O
O2 → 2 H2O (O équilibré)
O2 + 4H + → 2 H2O (H équilibré)
O2 + 4e – + 4H + → 2 H2O (charge équilibrée)
La structure des rayons X du complexe IV est illustrée ci-dessous. Encore une fois, la matrice est à l’extrémité inférieure de l’image et l’espace intermembranaire est en haut. C’est là que le cytochrome c se fixe, en haut.
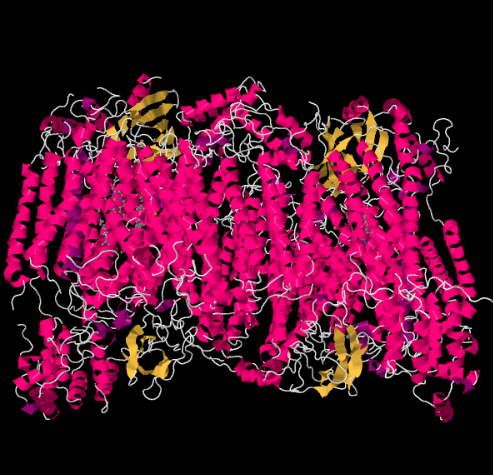
Le porteur d’électrons mobile, le cytochrome c, se lie au Complexe IV et délivre un électron à un site de cuivre binucléaire appelé CuA. Nous pouvons voir ce site de cuivre binucléaire lorsque nous regardons à l’intérieur de la protéine, ci-dessous. Il est lié uniquement à la protéine et à rien d’autre, nous voyons donc les deux ions cuivre seuls en haut de l’image. Cette paire d’atomes de cuivre envoie l’électron à un hème, le cytochrome a, que vous pouvez voir ci-dessous et à gauche. De là, l’électron se dirige vers un autre amas binucléaire, composé cette fois d’un fer lié à l’hème (cytochrome a3) et d’un cuivre voisin (CuB). Ce site binucléaire réalise la réduction du dioxygène en eau. Dans la structure, il y a une molécule de monoxyde de carbone liée au site actif entre le cytochrome a3 et le CuB. Les atomes de carbone sont attachés au fer et l’oxygène est attaché au cuivre. C’est là que la molécule d’oxygène se lierait, en attendant d’être réduite en eau.
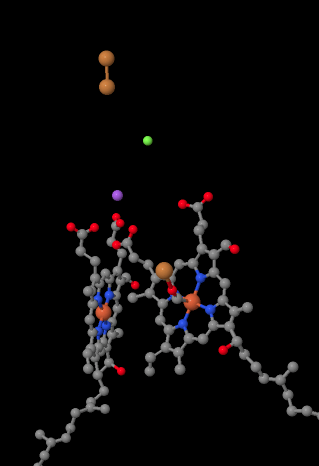
Si vous y réfléchissez, cela signifie que les électrons se déplacent dans la direction opposée à ce que nous avons vu dans les trois premiers complexes. Dans les complexes I et II, les électrons ont été délivrés de la matrice mitochondriale et ont voyagé vers l’espace intermembranaire, s’arrêtant à une ubiquinone dans la membrane mitochondriale. Dans le complexe III, les électrons ont continué dans cette direction “ascendante”, de la membrane mitochondriale au cytochrome c dans l’espace intermembranaire. Dans le complexe IV, les électrons s’inversent et remontent vers la matrice mitochondriale. Rappelez-vous que la matrice mitochondriale est dopée au n à cause du pompage des protons, de sorte que ces électrons se déplacent du côté positif de la membrane vers le côté négatif. Cela doit être difficile.
- Dans le complexe IV, le transport des électrons est dans la direction opposée aux autres complexes.
- Les électrons voyagent du côté de l’espace intermembranaire vers le côté de la matrice mitochondriale, contre le gradient de charge.
Jetons un autre coup d’œil aux ligands importants pour le complexe. Un dessin animé est illustré ci-dessous. Dans le dessin animé, la molécule d’O2 est montrée se liant dans cette position entre l’hème a3 et l’ourson. Ce site métallique dinucléaire est l’endroit où la molécule d’oxygène est réduite en eau.
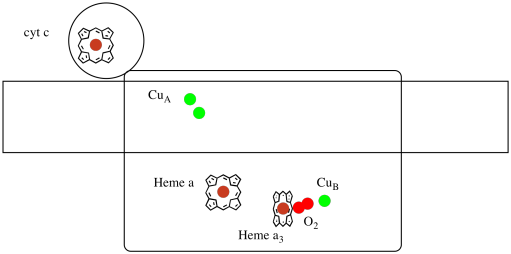
Étant donné que quatre électrons sont nécessaires pour réduire O2 en H2O, quatre molécules du cytochrome c doivent se lier au Complexe IV avant que cette réduction puisse se poursuivre. Il est probable que l’environnement de coordination de la molécule d’oxygène – entre deux métaux, plutôt que juste lié à un – permet de la réduire plus rapidement jusqu’à l’eau plutôt que de former des espèces réactives de l’oxygène qui persistent dans la cellule, telles que les peroxydes.
Exercice \(\PageIndex{2}\)
Supposons que le fer dans l’hème a3 commence dans un état réduit de Fe (II) et que le petit commence dans un état réduit de Cu (I). Fournir un mécanisme de réduction de l’oxygène en eau, avec l’ajout de quatre électrons et de quatre protons. Utilisez Fe(II) comme donneur d’électrons et la lysine comme donneur de protons.
Réponse
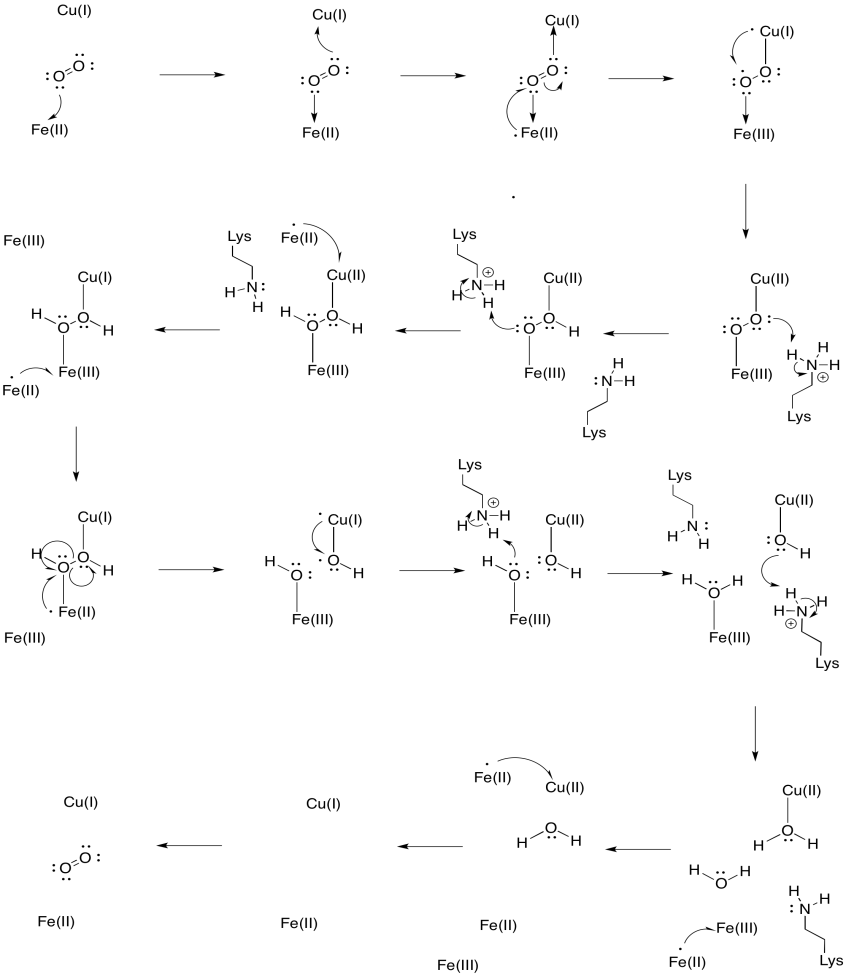
En plus de ces deux métaux, il existe également un conjugué histidine-tyrosine modifié lié à CuB. Il a été suggéré que cette tyrosine fournit une autre source d’électrons immédiats pouvant être utilisés en réduction.
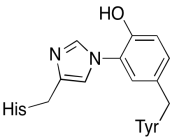
Exercice \(\PageIndex{3}\)
Montrez pourquoi une tyrosine peut être une source à la fois d’un proton et d’un électron dans les processus biochimiques.
Réponse
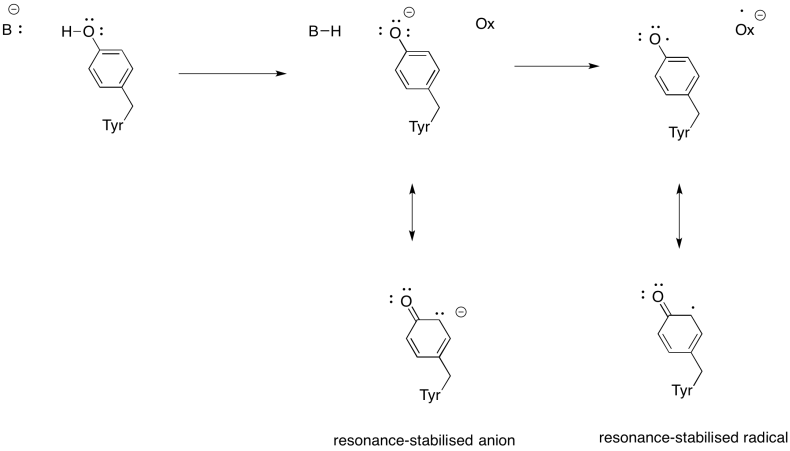
En plus de la nécessité de réduire l’oxygène en eau, le complexe IV contribue également au gradient de protons, pompant des protons supplémentaires à travers la membrane mitochondriale. Cette tâche présente des défis supplémentaires. Un mécanisme de couplage simple n’est pas possible, car les électrons se déplacent dans la direction opposée. C’est cependant que le mécanisme implique des changements conformationnels dans la protéine qui se produisent lorsque les métaux changent d’états d’oxydation. Des changements subtils dans l’environnement de coordination peuvent entraîner le déplacement des résidus d’acides aminés à proximité. Il est facile d’imaginer que si un acide aminé particulier se déplace vers le haut vers l’espace intermembranaire, il peut entraîner un proton avec lui.
- Le pompage de protons et le transport d’électrons se déroulent dans des directions opposées dans le complexe IV et doivent être découplés.
- Le pompage de protons dans le complexe IV doit reposer sur des changements conformationnels.
Exercice \(\PageIndex{4}\)
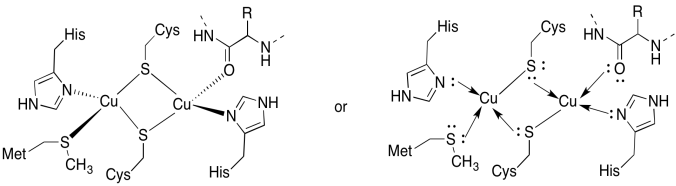
Le site CuA contient deux cuivres, entourés de deux cystéines pontantes. Les deux sont liés par des histidines terminales. De plus, un cuivre est lié par une méthionine supplémentaire, tandis que l’autre est lié par un carbonyle du squelette protéique.
- Dessinez les cuivres dans leurs sites de liaison.
- Décrire la géométrie de chaque cuivre.
- Si chaque cuivre est Cu(I), quel est le nombre d’électrons coordonné sur chaque cuivre du complexe?
- Si chaque cuivre est Cu(I), quelle est la charge globale sur le complexe?
Réponse a)
a)
Réponse b)
b) tétraédrique
Réponse c)
c) Cu(I) = d10
4 donneurs = 8 e –
total = 18e –
Réponse d)
d) 2 x Cu(I) = 2+
2 x Cys-S- = 2-
Tous les autres neutres
Total = 0
Exercice \(\PageIndex{5}\)
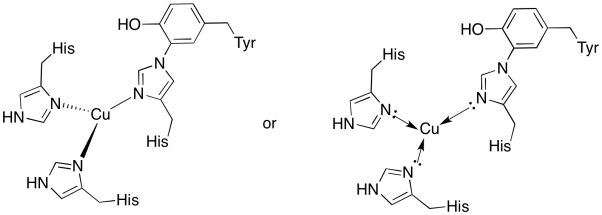
Le cuivre dans le site de l’ourson est lié par deux histidines et le conjugué histidine-tyrosine.
- Dessinez le cuivre dans le site de liaison.
- Décrire la géométrie du cuivre.
- Si le cuivre est Cu(I), quel est le nombre d’électrons coordonné dans le complexe?
- Si le cuivre est Cu(I), quelle est la charge globale sur le complexe?
Réponse a)
a)
Réponse b)
b) plan trigonal
Réponse c)
c) Cu(I) = d10
3 donneurs = 6 e –
total = 16 e –
Réponse d)
d) Cu(I) = 1+
histidines neutres
Total = 1+
Exercice \(\PageIndex{6}\)
Il est difficile de mesurer le potentiel de réduction d’un site individuel au sein d’une protéine. Cependant, les chercheurs ont pu estimer ces valeurs en mesurant les spectres EPR dans diverses conditions. En supposant les potentiels de réduction ci-dessous, dessinez un diagramme de progression de la réaction pour le transport d’un électron du cytochrome c à l’oxygène moléculaire.
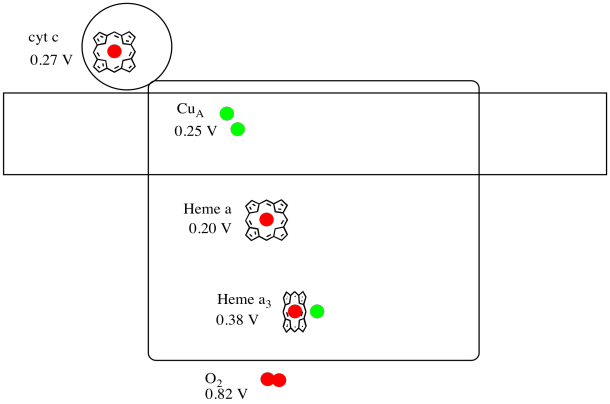 Réponse
Réponse
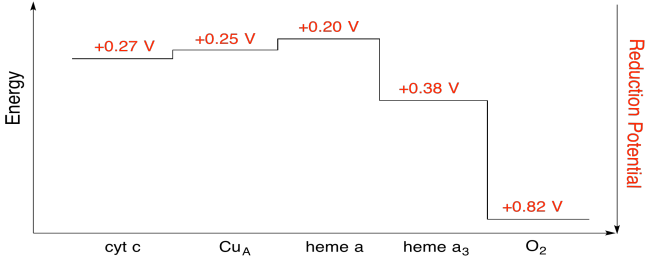
Exercice \(\PageIndex{7}\)
En utilisant les valeurs de la figure ci-dessus, calculez le changement d’énergie lorsqu’un électron est transféré de l’hème a à l’hème a3.
Réponse
En supposant que les potentiels de réduction sont:
hème a (ox) + e- → hème a (rouge) Eored = 0.20 V
hème a3 (ox) + e- → hème a3 (rouge) Eored = 0.38 V
Alors la différence de potentiel pour la réaction, ΔEo = 0,38- (0,20) V = 0,18 V.
La relation de Faraday ΔG = -n F ΔEo donne
ΔG = – 1 x 96 485 J V – 1 mol-1 x 0,13 V = 17 367 J mol-1 = 17,4 kJ mol-1
Attribution
Chris P Schaller, Ph.D., (Collège Saint-Benoît / Université Saint-Jean)