Acides, Bases et pH
|
|||||||||
LES ACIDES ET LEURS BASES CONJUGUÉES
Rappelez-vous la définition de Bronsted–Lowry d’un acide: un acide est un donneur de protons. De toute évidence, dans notre exemple précédent, l’acide acétique donne son proton à H2O dans la réaction directe, ce qui entraîne la formation de l’ion acétate. Cependant, dans la réaction inverse, l’ion acétate accepte un proton de H3O+ pour revenir à CH3COOH. D’après la définition de Bronsted–Lowry, une base est un accepteur de protons.
|
Ainsi, l’ion acétate agit comme une base dans la réaction inverse, et est appelé la base conjuguée de l’acide acétique. L’acide acétique et l’ion acétate sont connus sous le nom de paire conjuguée acide–base. Fait intéressant, il existe une deuxième paire de conjugués acide-base dans la réaction ci-dessus. Remarquez comment dans la réaction inverse, H3O + donne un proton (ce qui en fait un acide), tandis que dans la réaction directe, H2O accepte un proton (ce qui en fait une base). H2O et H3O+ sont une paire acide-base conjuguée, H3O+ étant l’acide conjugué et H2O étant la base conjuguée.
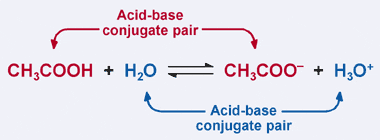
Dans une paire acide-base conjuguée, l’acide conjugué a un proton de plus que sa base conjuguée correspondante.