Anticoagulation au citrate pendant la TRCR pour les lésions rénales aiguës
- Lésions rénales aiguës
- Prise en charge des thérapies de remplacement rénal de l’AKI
- Hémodialyse, hémofiltration et hémodiafiltration
- Initiation et synchronisation de la TRR pour l’AKI – TRR intermittente par rapport à la TRR continue
- Anticoagulation pendant la thérapie de remplacement rénal continue (TRCR)
- Citrate – le mécanisme de son action anticoagulante et son application dans la TRCR
- Perturbations métaboliques potentielles pendant la TRCR anticoagulée au citrate
- Surveillance biochimique des patients recevant une TRCR anticoagulée au citrate
Lésions rénales aiguës
Les lésions rénales aiguës (ICA), un syndrome clinique ayant de nombreuses causes possibles, sont simplement définies comme une diminution brutale de la fonction rénale sur une période de plusieurs heures ou jours, mise en évidence par une augmentation récente de la concentration sérique de créatinine et / ou une réduction de la production urinaire.
Elle est distincte de l’insuffisance rénale chronique (IRC) dans laquelle la diminution de la fonction rénale est progressive lentement mais irréversiblement, se produisant sur une période de mois et d’années. Une IRA peut bien sûr survenir chez les personnes présentant une IRC sous-jacente, et un diagnostic d’IRA est associé à un risque plus élevé que la normale d’un diagnostic éventuel d’IRC.
Les directives convenues au niveau international indiquent qu’un diagnostic d’ICA peut être posé si:
• la créatinine sérique augmente de ≥ 0,3 mg / dL (26,5 µmol / L) dans les 48 heures; ou
• il y a eu une augmentation de 50% ou plus de la créatinine sérique au cours des 7 derniers jours; ou
• le volume d’urine est
L’ICA englobe tout le spectre de gravité d’une légère diminution de la fonction rénale (stade 1 AKI) à l’insuffisance rénale (stade 3 AKI). La stadification dépend de la mesure de la créatinine sérique, avec ou sans données de sortie d’urine (tableau I)
|
Étape |
Créatinine Sérique |
Sortie d’urine |
|
1 |
1.5-1.9 fois la valeur initiale |
pendant 6 à 12 heures |
|
2 |
2.0-2.9 fois la ligne de base |
⩾ 12 heures |
|
3 |
3.0 fois la valeur initiale |
pourAn24 heures |
TABLEAU I: Les trois étapes de la sévérité de l’ICA (à partir de la référence 1)
Les causes de l’IRA sont classiquement classées sous trois rubriques: prérénal; rénal (intrinsèque); et postrénal, soulignant le fait que l’AKI peut avoir une étiologie rénale spécifique mais peut également résulter d’un problème primaire en dehors du rein.
Toute affection ayant pour effet de réduire le flux sanguin vers le rein (perfusion rénale) est une cause potentielle d’ICA prérénale; ces affections comprennent: une hypovolémie due à des vomissements, une diarrhée, une hémorragie, des brûlures ou un choc septique; et une réduction du débit cardiaque due, par exemple, à une insuffisance cardiaque et une insuffisance hépatique (cirrhose). La principale cause d’ICA intrinsèque est la nécrose tubulaire rénale, résultant d’une ischémie rénale ou de l’ingestion de médicaments / toxines néphrotoxiques.
La septicémie, la cause la plus fréquente d’ICA chez les personnes gravement malades, est due en partie à une lésion rénale intrinsèque mal définie, semblable à une nécrose tubulaire rénale. Enfin, l’AKI postrénale résulte de toute condition qui obstrue le flux urinaire distal vers le rein; ceux-ci incluent: calculs rénaux (calculs); maladie de la prostate (tumeur / hypertrophie); dysfonctionnement de la vessie; et sténose urétrale.
Prise en charge des thérapies de remplacement rénal de l’AKI
Il n’existe pas de traitement spécifique de l’AKI et la prise en charge est largement favorable au traitement visant la cause sous–jacente. Le retrait des médicaments néphrotoxiques, la réanimation des liquides et la correction des troubles électrolytiques et acido-basiques font tous partie de cette prise en charge générale. L’administration de vasopresseur ou de médicaments inotropes pour rétablir une pression artérielle et un débit cardiaque normaux peut être nécessaire.
La thérapie de remplacement rénal (TRR), au centre de cet article, représente le traitement de dernier recours pour les patients atteints d’ICA sévère qui ne répondent pas à une prise en charge conservatrice. Environ 23% des patients en USI atteints d’ICA (soit environ 13% de tous les patients en USI) reçoivent une TRR.
La thérapie de remplacement rénal (TRR) est le terme générique pour tous les traitements visant à remplacer la fonction rénale. La transplantation d’un rein de donneur à des personnes atteintes d’une insuffisance rénale terminale peut être considérée comme la TRR ultime, mais le terme est plus souvent réservé aux thérapies qui remplacent la filtration sanguine et les fonctions homéostatiques du rein par la dialyse, un processus qui utilise une membrane semi-perméable comme filtre sanguin. Deux grands types de TRR dialytiques sont disponibles pour le traitement de l’IRA (et d’ailleurs, de l’IRC au stade terminal): la dialyse péritonéale et l’hémodialyse.
En revanche, l’hémodialyse consiste à filtrer le sang dans une machine à l’extérieur du corps (extracorporelle). Le sang est pompé vers le filtre / dialyseur, où les déchets et l’excès de liquide sont éliminés, puis renvoyés dans le corps. Ce circuit extracorporel (la machine de dialyse et ses tubes de liaison depuis et vers le patient) est un environnement procoagulant.
Hémodialyse, hémofiltration et hémodiafiltration
Les machines de dialyse modernes ont l’option d’hémofiltration (HF) ainsi que d’hémodialyse (HD), permettant la possibilité de trois modalités dialytiques différentes pour le traitement de l’IRA: hémodialyse (HD); hémofiltration (HF); et hémodiafiltration (HDF).
Au cœur des trois modalités se trouve la membrane semi-perméable qui constitue un filtre sanguin. Lorsque le sang pompé du patient s’écoule d’un côté de cette membrane, l’excès d’eau et les solutés résiduels traversent la membrane. Le filtrat ou l’effluent est pompé vers les déchets lorsque le sang filtré est renvoyé au patient.
Le processus d’hémodialyse (MH) implique l’utilisation d’un liquide de dialyse qui s’écoule en continu et à contre-courant du sang de l’autre côté de la membrane. La composition et le débit du liquide de dialyse assurent un gradient de concentration constant à travers la membrane semi-perméable par rapport aux solutés sanguins. Ces gradients de concentration facilitent à leur tour la diffusion contrôlée des molécules de soluté à travers la membrane.
Pour les solutés comme l’urée et la créatinine, qui doivent être retirés du sang, le gradient de concentration est tel que la direction de diffusion est du sang au liquide de dialyse, alors que pour les solutés comme le bicarbonate, qui doivent souvent être ajoutés au sang pour corriger l’acidose associée à une ICA sévère, le liquide de dialyse à forte concentration de bicarbonate par rapport au sang assure une diffusion dans le sens inverse, du liquide de dialyse au sang. L’ajustement de la composition du liquide de dialyse et du débit permet ainsi une correction métabolique spécifique au patient.
L’excès de liquide est souvent une caractéristique de l’ICA qui est corrigée lors de l’hémodialyse. Ceci est réalisé par ultrafiltration, qui dépend du gradient de pression hydrostatique qui existe à travers la membrane semi-perméable. La pression hydrostatique positive relative du côté sanguin de la membrane “pousse” efficacement l’eau du sang au liquide de dialyse.
Cette ultrafiltration facilite également le passage des molécules de soluté, qui sont entraînées avec l’eau lors de l’ultrafiltration par un mécanisme appelé convection de soluté (ou traînée de solvant). L’effet combiné de la diffusion du soluté, de la convection du soluté et de l’ultrafiltration lors de l’hémodialyse vise à garantir que le volume et la composition du liquide à l’intérieur du compartiment extracellulaire et intracellulaire soient restaurés, aussi près que possible, de ceux qui ont des reins fonctionnant normalement.
L’hémodiafiltration (HDF) est la combinaison de l’HF et de la HD. Il permet une clairance optimale des solutés de faible poids moléculaire par diffusion dans le fluide de dialyse, combinée à une clairance optimale des solutés de haut poids moléculaire par convection et ultrafiltration. Comme pour le HF, le HDF nécessite un liquide de remplacement continu; et comme pour le HD, le HDF nécessite un liquide de dialyse.
Initiation et synchronisation de la TRR pour l’AKI – TRR intermittente par rapport à la TRR continue
Tous les traitements de remplacement rénal (PD, HD, HF et HDF) peuvent être administrés par intermittence (c’est-à-dire généralement en 3 à 4 séances horaires) ou en continu jusqu’à ce que la fonction rénale soit rétablie. Pour les patients atteints d’insuffisance rénale terminale, qui ont besoin d’une TRR à vie (chronique), le traitement est exclusivement une hémodialyse intermittente (IHD), presque invariablement administrée en quatre séances horaires, trois fois par semaine.
Les patients atteints d’ICA n’ont qu’un besoin temporaire de RRT pour soutenir la fonction rénale pendant la résolution de la maladie critique / aiguë qui a précipité l’ICA. La durée moyenne de la TRR chez les patients atteints d’IRA est d’environ 13 jours, bien que dans des cas particuliers, elle puisse ne durer que quelques jours ou s’étendre sur plusieurs semaines.
Les indicateurs traditionnels (absolus) d’initiation de la TRR dans l’ICA comprennent:
• hyperkaliémie (potassium plasmatique > 6,0-6,5 mmol / L)
• urémie sévère (urée plasmatique > 30 mmol / L)
• signes d’encéphalopathie urémique
• acidose (pH • œdème pulmonaire aigu
Il peut être bénéfique de commencer le traitement avant ces effets extrêmes des AKI sont évidentes, mais le moment optimal pour initier (et arrêter) la RRT n’est actuellement pas clair et fait l’objet de recherches en cours. Il n’existe actuellement aucune donnée fiable à l’appui d’un type particulier de RRT pour l’AKI et, par conséquent, tous les types de RRT ont été utilisés.
Les lignes directrices actuelles reflètent cependant un consensus selon lequel, quelle que soit la modalité, la TRR devrait être administrée de manière continue plutôt que intermittente aux patients les plus gravement malades (hémodynamiquement instables). Des études récentes indiquent que de nos jours, les thérapies de remplacement rénal continu (CRRT) sont utilisées beaucoup plus fréquemment que les thérapies intermittentes pour l’IRA, et que la CRRT la plus couramment utilisée est l’hémofiltration veineuse continue (CVVHF), suivie de l’hémodiafiltration veineuse continue (CVVHDF).
Anticoagulation pendant la thérapie de remplacement rénal continue (TRCR)
La TRCR, comme toutes les autres thérapies de remplacement rénal à l’exception de la dialyse péritonéale, consiste à pomper le sang à travers un circuit extracorporel non physiologique. La propriété inhérente du sang à coaguler (caillot) au contact de surfaces non physiologiques détermine que pour maintenir un circuit extracorporel du patient “sans caillots”, le sang doit être anticoagulé.
La CRRT a un besoin particulier d’anticoagulation, par rapport aux modalités intermittentes, en raison des séances de traitement prolongées et de la vitesse relativement lente à laquelle le sang est pompé à travers le circuit. De plus, le sang des patients nécessitant une TRCR est souvent déjà dans un état procoagulant relatif en raison d’une maladie grave sous-jacente (par exemple, une septicémie) ou d’un traumatisme.
Pendant de nombreuses années, l’héparine, soit l’héparine non fractionnée (UF), soit l’héparine de bas poids moléculaire (LMWH), a été le seul anticoagulant utilisé dans les procédures dialytiques, y compris la TRCR. L’héparine continue d’être utilisée; c’est un moyen d’anticoagulation bon marché et généralement sûr pour la majorité des patients nécessitant une TRR.
Cependant, l’anticoagulation systémique à l’héparine, qui ne peut être évitée, entraîne inévitablement un risque accru de saignement, de sorte que l’anticoagulation à l’héparine pendant les procédures dialytiques est absolument contre-indiquée pour ceux qui saignent actuellement ou à un risque de saignement supérieur à la normale.
De plus, l’héparine peut, dans une petite minorité (
Les risques potentiels de saignement et de HIT-II associés à l’utilisation de l’héparine ont mis en évidence la nécessité d’un anticoagulant alternatif pour certains patients nécessitant une TRR. Le citrate a fourni une telle alternative. L’anticoagulation régionale au citrate du circuit de dialyse, utilisée pour la première fois avec succès au début des années 1980, était à l’origine réservée à cette petite minorité de patients pour lesquels l’héparine est contre-indiquée. Cela a changé avec les résultats d’essais contrôlés randomisés comparant la TRCR anticoagulée à l’héparine avec la TRCR anticoagulée au citrate; ceux-ci ont démontré que le citrate est à la fois un anticoagulant plus efficace et plus sûr que l’héparine.
Le citrate est donc apparu ces dernières années comme l’anticoagulant de choix pour tous les patients atteints d’ICA nécessitant une TRCR. Les unités de soins intensifs du monde entier signalent maintenant le passage de l’héparine à l’anticoagulation régionale au citrate pour la TRCR. Certaines autorités recommandent même l’utilisation du citrate plutôt que de l’anticoagulation à l’héparine pour l’hémodialyse intermittente (chronique) (IHD).
Citrate – le mécanisme de son action anticoagulante et son application dans la TRCR
Le citrate, qui est utilisé pour anticoaguler / conserver le sang donné pour la transfusion depuis plus d’un siècle, empêche la coagulation du sang grâce à sa capacité à lier (chélater) le calcium ionisé (iCa) qui circule dans le plasma sanguin. Cette iCa est un cofacteur nécessaire à la fois à l’agrégation plaquettaire et à plusieurs étapes clés des voies de coagulation intrinsèque et extrinsèque responsables de la production de fibrine et, par conséquent, de la formation de caillots de fibrine.
La coagulation sanguine est empêchée par une réduction de la concentration plasmatique d’iCa à environ 0,35 mmol / L (plage de référence normale de 1,15 à 1,30 mmol / L). Cet état non physiologique, sévèrement hypocalcémique, est obtenu en élevant la concentration plasmatique de citrate à environ 3 mmol /L (concentration plasmatique normale de citrate ~ 0,1 mmol/L).
Bien qu’il existe des différences dans les détails décrites par Morabito et al, tous les protocoles d’anticoagulation au citrate pendant la TRCR impliquent la perfusion continue d’une solution contenant du citrate (généralement soit du citrate trisodique, soit une solution acide-citrate-dextrose (ACD)) dans la ligne de préfiltre / dialyse, près de l’endroit où elle quitte le patient, soit en tant que solution séparée, soit en combinaison avec un liquide de remplacement de prédilection. Le débit de cette perfusion est ajusté pour atteindre une concentration de citrate sanguin de ~ 3 mmol/L, et donc un iCa plasmatique de l’ordre de 0,35 mmol/L.
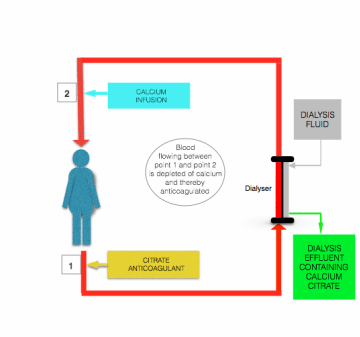
L’hypocalcémie induite par perfusion de citrate est corrigée avant le retour du sang chez le patient, par perfusion d’une solution contenant du calcium (chlorure de calcium ou gluconate de calcium) dans la ligne postfiltre proche de l’endroit où il pénètre chez le patient (voir figure ci-dessus).
Le principal avantage de sécurité de l’anticoagulation au citrate par rapport à l’anticoagulation à l’héparine est que l’anticoagulation est confinée au circuit extracorporel. Cette soi-disant “anticoagulation régionale” est obtenue parce que la majeure partie du citrate infusé est éliminée (sous forme d’anions de citrate ou de chélate de citrate de calcium) du sang lors du passage à travers le filtre / dialyseur.
Tout citrate restant dans le sang post-filtre est dilué dans la circulation systémique et rapidement métabolisé en dioxyde de carbone et en eau par le cycle de Krebs dépendant de l’oxygène dans la mitochondrie des cellules tissulaires (principalement des cellules hépatiques).
Le métabolisme du citrate est associé à la production de bicarbonate: pour chaque citrate de 1 mmol métabolisé, 3 mmol de bicarbonate sont générés. La clairance rapide du citrate (la demi-vie du citrate dans le sang est normalement d’environ 5 minutes) par cette voie principalement hépatique garantit normalement l’absence d’anticoagulation systémique pendant la CRRT, et donc aucun risque supplémentaire de saignement.
Perturbations métaboliques potentielles pendant la TRCR anticoagulée au citrate
La réticence apparente à adopter pleinement la TRCR anticoagulée au citrate pour tous les patients atteints d’ICA jusqu’à récemment a été attribuée à des préoccupations concernant les perturbations acido-basiques et électrolytiques pouvant survenir chez les patients recevant le traitement.
Les troubles électrolytiques et acido-basiques suivants ont été rapportés chez des patients recevant une TRCR anticoagulée au citrate :
• hypocalcémie / hypercalcémie
• hypomagnésie / hypermagnésie
• hyponatrémie / hypernatrémie
• alcalose métabolique
• acidose métabolique
Ces perturbations peuvent survenir pour un certain nombre de raisons, mais l’accumulation de citrate dans la circulation périphérique (toxicité du citrate) peut être au cœur de la plupart de ces perturbations. Les raisons pour lesquelles le citrate peut s’accumuler pendant la TRCR comprennent:
• Réduction progressive de la perméabilité membranaire pendant la dialyse avec réduction conséquente de la filtration du citrate et augmentation concomitante de l’administration de citrate à la circulation systémique
• Erreur opérationnelle – augmentation accidentelle du taux de perfusion de citrate dans le circuit extracorporel et augmentation concomitante de l’administration de citrate à la circulation systémique
• Transfusion de produits sanguins – Le conservateur de citrate présent dans les produits sanguins ajoute à la charge de citrate dans la circulation systémique résultant de CRRT
Quelle que soit la cause, l’accumulation de citrate dans la circulation périphérique peut entraîner une chélation par citrate du calcium ionisé circulant, avec pour conséquence une réduction de la concentration plasmatique en calcium ionisé (hypocalcémie). Si une hypocalcémie suffisamment sévère peut provoquer une arythmie cardiaque et, finalement, un arrêt cardiaque.
Bien que le calcium ionisé par plasma soit réduit lors de l’accumulation de citrate (toxicité), le calcium total est augmenté (indiquant une hypercalcémie) car le calcium lié au citrate est inclus dans le calcium total mesuré. Une augmentation du rapport calcium total/ ionisé (normalement 2,0) à > 2.1 s’est avéré être le signal le plus fiable de toxicité du citrate en l’absence d’estimation du citrate plasmatique couramment disponible.
Le risque d’augmentation du sodium plasmatique (hypernatrémie) associé à l’anticoagulation au citrate est dû à la teneur élevée en sodium (hypertonie) de certaines solutions de citrate utilisées dans la TRCR. Par exemple, la solution à 4% de citrate trisodique utilisée dans certains protocoles contient du sodium à une concentration de 420 mmol / L. En pratique, l’utilisation de liquides de dialyse / remplacement hypotoniques peut atténuer ce risque et l’hypernatrémie est de toute évidence une complication rare de l’anticoagulation au citrate.
Le risque d’hypomagnésie (magnésium sérique réduit) lors de l’anticoagulation au citrate reflète le fait que, comme le calcium, le magnésium est un ion divalent qui peut également se lier au citrate (chélate). Si les pertes de magnésium dues à l’action de chélation du citrate ne sont pas entièrement compensées par le magnésium dans les liquides de dialyse / remplacement, une hypomagnésie peut survenir.
Surveillance biochimique des patients recevant une TRCR anticoagulée au citrate
Les tests au point de service à l’aide d’un analyseur de gaz sanguins situé dans l’unité de soins intensifs permettent de mesurer rapidement et facilement la plupart des paramètres (calcium ionisé, pH, bicarbonate, excès de base, sodium et lactate), mais les estimations du calcium et du magnésium totaux sériques ne sont généralement pas disponibles sur ces plates-formes et les échantillons doivent être envoyés au laboratoire pour ces mesures.
Deux études récentes montrent que certains analyseurs de gaz sanguins peuvent ne pas être fiables pour mesurer le calcium ionisé aux concentrations extrêmement faibles et non physiologiques (~ 0.3 mmol / L) présents dans le sang post-filtre, bien que leur capacité à mesurer avec précision le calcium ionisé par plasma dans la circulation systémique (où la concentration est beaucoup plus élevée) ne fasse aucun doute.
|
Paramètre mesuré |
Intervalle de surveillance |
Valeurs cibles ou env. plages de référence |
Objet de la mesure |
Mesures correctives si la cible n’est pas visée |
|
Concentration de calcium ionisé post-filtre (iCa), c’est-à-dire du sang prélevé à partir du port post-filtre. |
Dans l’heure suivant le début et après tout changement de dose de citrate, puis toutes les 4 à 6 heures |
0.25-0.35 mmol / L |
|
Ajustement de la dose de citrate: augmentation si iCa > 0,35, diminution si iCa |
|
Calcium ionisé systémique (iCa), c.-à-d. échantillon sanguin du patient |
Ligne de base (avant le démarrage), puis 1 heure après le démarrage, puis au moins toutes les 4 à 6 heures |
1.15-1.30 mmol / L |
|
Ajustement de la vitesse de perfusion de calcium; augmentation si iCa 1.30 |
|
Calcium total systémique (TotCa), c.-à-d. sang prélevé chez le patient (TotCa = iCa + calcium lié à l’albumine + calcium lié au citrate) |
Au moins toutes les 12-24 heures (doit être simultanée à l’estimation systémique du calcium ionisé) |
Seulement requis pour la détermination du rapport totCa:iCa (voir ci-dessous) |
||
|
Rapport du total au calcium ionisé (TotCa:iCa) |
Au moins toutes les 12-24 heures |
Pour détecter l’accumulation / toxicité de citrate parfois appelée “serrure de citrate” |
Les options incluent:
|
|
|
Analyse des gaz du sang artériel
|
Ligne de base (avant de commencer). Dans l’heure suivant le démarrage, puis au moins toutes les 4 à 6 heures. |
pH 7,35-7,45 bicarbe 23-28 mmol /L BE –2-+3 mmol / L |
Pour détecter les perturbations acido-basiques : alcalose métabolique acidose métabolique |
Les options en cas d’alcalose métabolique comprennent:
|
|
Sodium sérique |
Une fois par jour |
135-145 mmol / L |
Pour détecter l’hypernatrémie / hyponatrémie |
Cas rare – vérifier le liquide de dialyse/ de remplacement correct |
|
Lactate sérique |
Ligne de base (avant le début), puis selon les besoins cliniques |
Pour aider à identifier les personnes à risque de toxicité du citrate |
Considérer, avec le rapport TotCa: iCa, le risque de toxicité du citrate |
|
|
Magnésium sérique |
Au moins une fois par jour |
Pour détecter l’hypomagnésie |
Correction avec infusion de magnésium |
TABLEAU II : Surveillance biochimique pendant la TRCR anticoagulée au citrate (Réf 24)