Canaux et transporteurs d’ions chlorure: des curiosités de la nature et de la source des maladies humaines aux cibles médicamenteuses
Publié: 20 Août 2013 | |
Au début de ses études de premier cycle, l’étudiant est initié à différents types de protéines membranaires intégrales: récepteurs, protéines d’adhésion, canaux ioniques, pompes ioniques et transporteurs ioniques. Au fur et à mesure de leurs études, ils découvrent que des familles de gènes et des structures protéiques discrètes sont responsables de ces différentes classes de protéines et qu’il n’y a jamais de raison de considérer qu’il pourrait y avoir une ambiguïté dans l’attribution d’une protéine particulière à sa classe de protéines appropriée.
Cela satisfait pratiquement tous les cas, de la salle de classe au laboratoire de recherche, jusqu’à ce que nous considérions les canaux chlorés. Nous savons qu’ils existent, qu’ils sont importants et qu’ils pourraient constituer de bonnes cibles médicamenteuses dans plusieurs domaines de la maladie, mais jusqu’à récemment, ils sont restés quelque peu stigmatisés et démodés dans le monde de la thérapeutique. Le manque de ligands sélectifs n’a pas aidé du tout. La seule exception à cela a été le récepteur GABA – Un qui est couplé à un canal de chlorure intrinsèque qui s’ouvre lors de la liaison du neurotransmetteur inhibiteur GABA. Les benzodiazépines potentialisent ce récepteur depuis que le valium est devenu disponible dans les années 1960, fournissant des effets sédatifs et anticonvulsivants. Cela introduit un concept important: il existe plusieurs familles de gènes et différents types de protéines qui peuvent être décrits comme étant des canaux chlorurés.
Ceci contraste avec ce que nous comprenons des canaux ioniques sélectifs aux cations où il y a peu de flexibilité dans la structure protéique pouvant former un pore sélectif pour le potassium, le sodium ou le calcium; la diversité de ces canaux ioniques est provoquée par les variations des domaines protéiques distincts du pore qui influencent le comportement d’ouverture-fermeture. Pour être juste, il ne semble pas y avoir beaucoup de raisons physiologiques pour lesquelles un canal anionique devrait présenter une sélectivité en chlorure car il y a peu de rôle physiologique dans le transport membranaire d’autres halogénures ou de petits anions; tout canal anionique sera par défaut un canal chlorure d’un point de vue physiologique. D’autre part, les courants membranaires de potassium, de sodium et de calcium jouent chacun des rôles fondamentaux différents et la perméabilité membranaire sélective à ces cations est cruciale pour la fonction cellulaire et même la vie elle-même.
Les récepteurs GABA-A sont des membres des familles de canaux ioniques à ligand pentamérique à boucle cys, qui comprennent plusieurs types de canaux à déclenchement par neurotransmetteur excitateur et inhibiteur. La protéine régulateur transmembranaire de la fibrose kystique (CFTR) est un canal chlorure régulé par les nucléotides. C’est un membre de la famille de transporteurs ABC (ATP-binding cassette) et c’est le seul qui ne semble transporter aucun substrat à travers une membrane, mais fonctionne plutôt comme un canal de chlorure. La famille CLC de canaux chlorés à chaîne voltaire provient d’une autre famille de gènes distincte et possède une structure générale unique parmi les protéines membranaires. Cette famille de protéines a provoqué de nombreuses surprises au cours des 30 dernières années et les membres de cette famille seront présentés ici et aussi comment ils pourraient être considérés comme des cibles de médicaments.
D’autres développements intéressants dans le domaine des canaux chlorhydriques sont apparus suite à l’identification moléculaire des protéines sous-jacentes aux canaux chlorhydriques activés par le calcium (ClCa). Fonctionnellement, nous connaissons leurs rôles physiologiques depuis un certain temps, mais l’identification moléculaire récente des protéines du canal a permis le développement d’outils moléculaires et pharmacologiques pour sonder et modifier leur activité. Cette revue se concentre sur le potentiel pharmacologique du ciblage des canaux ClCa et des protéines CLC; leur fonction et leur localisation sous-cellulaire sont résumées à la figure 1.
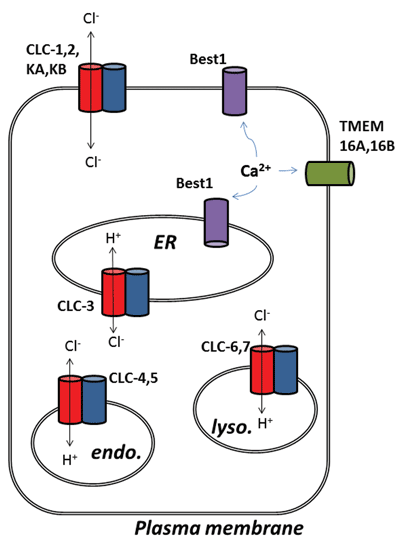
Figure 1
Une introduction aux protéines CLC
Les neuf membres de cette famille de protéines sont CLC-1 à 7, CLC-KA et KB. Le membre fondateur, CLC-1, est le canal chlorure à tension fermée du muscle squelettique et sera discuté ci-dessous. De nombreuses études fonctionnelles ont été réalisées sur un homologue au titre honorifique de CLC-0, isolé de l’organe électrique Électroplax, qui permet au rayon d’étourdir ses victimes aquatiques. La reconstitution de la CLC-0 en bicouches lipidiques et l’enregistrement électrophysiologique des courants circulant à travers des canaux ioniques simples ont révélé une propriété intrigante. Habituellement, lors de l’enregistrement du courant à partir d’un petit morceau de membrane contenant un seul canal ionique, on observe des fluctuations entre deux amplitudes de courant: l’une représentant le canal fermé et l’autre représentant le courant traversant le canal ouvert. Les fluctuations reflètent les transitions entre les états cinétiques ouverts et fermés. Avec CLC-0, cependant, il était évident que la protéine à canal ionique unique était constituée de deux pores équivalents pouvant s’ouvrir indépendamment1. Ce canal a donc été décrit comme étant à double canon (Figure 2). Il n’est donc pas surprenant que les structures cristallines d’homologues de bactéries entériques révèlent que le complexe protéique est un dimère, chaque sous-unité possédant une voie conductrice d’ions2 (Figure 2).
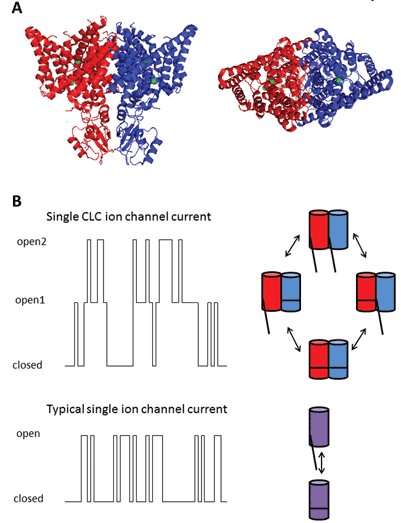
Figure 2
La deuxième surprise est survenue lorsque des expériences fonctionnelles détaillées ont été effectuées sur CLC-ec1 à partir d’E. coli. Plutôt que de fonctionner comme un canal chlorure, comme son parent perdu depuis longtemps dans le muscle squelettique des vertébrés, le CLC-ec1 est un transporteur d’échange 2Cl-/ H+, ou anti–transporteur, avec une stoechiométrie d’échange stricte 2:13. Cette protéine est importante pour la survie des bactéries entériques à faible pH4 et est susceptible d’exploiter un gradient de chlorure pour maintenir le pH cellulaire à un niveau tolérable. Les CLC procaryotes pourraient donc être des cibles pour les inhibiteurs du traitement de l’infection pathogène à E. coli ou à Salmonella4. La découverte du comportement d’échange d’ions a naturellement stimulé d’autres efforts pour déterminer si cet échange chlorure-proton existait chez les CLC de mammifères, en supposant que l’échange Cl–/ H+ pourrait être la véritable fonction des CLC archétypaux et que ceux identifiés comme canaux chlorés pourraient simplement être des exceptions à la règle. Cela semble être le cas car il existe des preuves solides que la CLC-3 jusqu’à la CLC-7 fonctionnent comme des transporteurs d’échange 2Cl–/ H+, résidant principalement dans les organites intracellulaires, tandis que la CLC-1, la CLC-2, la KA et la KB sont de véritables canaux ioniques conducteurs de chlorure de la membrane plasmique5-9. Parce que la propriété archétypale de la CLC est le transport d’échange, qui se retrouve dans toutes les formes de vie cellulaire, cette dernière sous-classe de protéines, les canaux de chlorure de bonne foi, peut donc être considérée comme des transporteurs de chlorure “cassés”, qui ont perdu le couplage du transport de chlorure au mouvement d’un deuxième ion substrat.
CLC-1
Ce fondateur de la famille CLC est le canal chlorure à chaîne de tension du muscle squelettique et sert à réguler le potentiel membranaire et à repolariser la membrane en suivant les potentiels d’action pour détendre le muscle. Dans la plupart des tissus, nous nous attendons à ce que les canaux potassiques jouent ce rôle, ce qu’ils font dans le muscle cardiaque et le muscle lisse, ainsi que dans la régulation de l’excitabilité membranaire dans d’autres types de cellules. Le système tubulaire transversal est une extension de la membrane plasmique (sarcolemme) et pénètre dans le tissu contractile. Il est essentiel à la propagation rapide de l’activité électrique dans tout le muscle et orchestre une contraction rapide et contrôlée. L’efflux de potassium des cellules musculaires dans l’espace confiné du tubule en t augmenterait la concentration extracellulaire de potassium et effondrerait ce gradient d’ions, ce qui conduirait à une dépolarisation prolongée de la membrane. Les canaux chlorures jouant le rôle de repolarisation prédominant, cela est évité. La perte de mutations fonctionnelles de la CLC-1 entraîne une myotonie chez l’homme, la chèvre et la souris (pour une revue récente, voir 10) et se caractérise par une relaxation musculaire altérée, compatible avec la perte d’un courant membranaire repolarisant.
Avec une expression limitée au muscle squelettique, la CLC-1 pourrait être une cible attrayante pour les médicaments qui contrôlent la contraction musculaire en augmentant ou en diminuant la fonction de la CLC-1 et, par conséquent, en réduisant ou en augmentant l’excitabilité musculaire, respectivement. Les composés qui augmentent la fonction CLC-1 pourraient être capables de traiter la myotonie, en particulier dans les cas où ils pourraient compenser la perte partielle de l’activité des canaux chlorures. L’inhibition de la CLC-1 pourrait réduire le seuil de contraction musculaire et peut être utile en cas de faiblesse musculaire ou de maladies dégénératives telles que la dystrophie musculaire.
CLC-2
Le canal de chlorure rectifiant vers l’intérieur, CLC-2, a une distribution tissulaire quelque peu répandue. On le trouve dans les neurones centraux où il régule l’activité neuronale11-13. Chez les astrocytes, son ciblage subcellulaire aux jonctions cellulaires est régulé par une interaction avec GlialCAM (MLC1), des mutations qui perturbent ce ciblage et provoquent une leucoencéphalopathie mégalencéphalique14. Les intérêts thérapeutiques récents impliquent l’expression de la CLC-2 dans la muqueuse intestinale et les bronchioles pulmonaires où elle joue un rôle dans les sécrétions intestinales et pulmonaires, respectivement. La Lubiprostone, un médicament utilisé cliniquement pour soulager la constipation, a été proposée pour exercer son effet en activant la CLC-2, mais cet effet est controversé. Alors que ce composé active les canaux CLC-2 dans certaines études, dans d’autres, il régule le trafic de CLC-2 et augmente la fonction CFTR via l’activation des récepteurs des prostaglandines15,16. Cependant, il reste suffisamment de preuves que l’augmentation de la fonction CLC-2 des voies respiratoires pourrait fournir une voie alternative du chlorure dans la fibrose kystique17.
CLC-KA/KB
Ces canaux chlorurés sont notamment exprimés dans les épithéliums rénaux et contribuent à la perméabilité des membranes cellulaires au flux de chlorure passif. Ils jouent un rôle clé dans le membre ascendant et les tubules distaux du néphron, fournissant une voie basolatérale pour la réabsorption du chlorure, après le transport de l’urine primaire via la membrane apicale. Le gène CLCKB, qui code CLC-KB, est l’un des cinq gènes qui sous-tendent le syndrome de Bartter. Les mutations de perte de fonction dans la CLC-KB entraînent une réabsorption défectueuse du chlorure et conduisent donc à un trouble du gaspillage de sel, associé à une polyurie. L’une des principales caractéristiques des individus affectés par des mutations CLC-KB (type III de Bartter) est l’hypotension artérielle. Une forme plus grave de la maladie est causée par des mutations du gène BSND (type IV de Bartter), qui code pour la Barttine, une protéine accessoire importante pour le trafic de CLC-KA et de KB vers la membrane plasmique18. Cette forme de trouble comprend également la surdité sensorielle, qui serait provoquée par la perte du trafic de CLC-KA et de KB vers les membranes épithéliales de l’oreille interne. Vraisemblablement, la perte de l’activité CLC-KA ou KB, mais pas les deux, peut être tolérée par le système auditif. Cela suggère que les inhibiteurs sélectifs de la CLC-KA ou de la CLC-KB, ou l’inhibition partielle des deux, peuvent agir comme un nouveau diurétique de l’anse avec le potentiel d’abaisser la pression artérielle et avec peu d’effets secondaires. Cela a conduit à l’étude de leur pharmacologie et au développement de nouveaux dérivés inhibiteurs à faible affinité micromolaire19, qui avaient des effets diurétiques lorsqu’ils étaient administrés à des rats20. D’autre part, les médicaments qui activent les canaux CLC-KB peuvent améliorer l’activité résiduelle des canaux défectueux chez les patients de type III de Bartter.
CLC-7
De la sous-classe des transporteurs d’échange 2Cl-/ H+, la CLC-7 est une cible prometteuse pour l’action du médicament et son inhibition peut être bénéfique dans l’ostéoporose. Une fois de plus, cette indication tire son origine des observations de maladies humaines causées par des mutations de perte de fonction de la CLC-7, qui provoquent une ostéropétrose21. Dans ce trouble, le remodelage osseux par les ostéoclastes est déficient, ce qui serait dû à une sécrétion défectueuse d’acide et d’enzymes. Cela conduit à un os dense qui, s’il est reproduit par un inhibiteur de la CLC-7, pourrait réduire la dissolution de l’os et donc renforcer le squelette des patients atteints d’ostéoporose.22,23. Dans les études de preuve de concept, l’inhibition pharmacologique de l’acidification24 ou la perturbation de la fonction CLC-7 par des antibodies25 ont réduit la résorption osseuse. Cependant, l’inhibition de la CLC-7 peut ne pas être sans complications car des études sur l’homme et la souris suggèrent que l’absence de fonction de la CLC-7 peut également être associée à des troubles du stockage neuronal et de la dégénérescence en raison d’une fonction lysosomale réduite.26.
Mutations humaines à perte de fonction – leçons du CFTR
Il convient de faire une brève pause à ce stade pour considérer que certaines des indications thérapeutiques de nouveaux médicaments ciblés par la CLC visent à traiter des troubles distincts et à l’extrémité opposée du spectre à ceux causés par une fonction CLC défectueuse. En plus de celles décrites ci-dessus, la maladie de Dent I est une maladie rénale liée à l’X qui est causée par la perte de la fonction CLC-5 (voir 27 pour une revue récente). Tous sont des troubles héréditaires rares et un défaut protéique majeur implique une activité protéique réduite ou un trafic vers la membrane cible. En fait, de nombreuses mutations individuelles provoquent une rétention d’ER et un manque de maturation des protéines. Un parallèle pourrait être fait avec la fibrose kystique, la plupart des personnes atteintes possédant la mutation ΔF508 retenue par ER. Des approches récentes et stratifiées du traitement de la mucoviscidose ont été le résultat d’une attaque à deux volets visant à corriger le repliement des protéines mutantes (correcteurs de CF) et /ou à augmenter l’activité des canaux chlorhydriques CFTR de la membrane plasmique (potentialisateurs de CF). Le succès est au rendez-vous avec la classe des potentiateurs28, qui sont efficaces chez les patients présentant des mutations qui réduisent l’activité des CFTR sans perte de biosynthèse ou de trafic de protéines (par exemple G551D), mais l’efficacité des correcteurs de repliement (qui est nécessaire dans la majorité des cas) reste à établir29. Bien que les maladies associées à la perte de la fonction CLC soient toutes des troubles génétiques rares, nous pourrons peut-être un jour traiter des personnes atteintes de myotonie, du syndrome de Bartter, de la maladie de Dent et de l’ostéopétrose, ainsi que de la fibrose kystique avec des médicaments qui corrigent la cause réelle de leur trouble.
Canaux de chlorure activé par le calcium
Enfin, on mentionnera les canaux de chlorure activé par le calcium (ClCa), qui ont des rôles physiologiques clairement définis dans un certain nombre de types cellulaires, mais leur identification moléculaire a subi quelques démarrages faux et bégaiés. L’histoire implique quatre types de protéines: les membres des familles de gènes CLCA, Bestrophine, Tweety et TMEM16. Dans tous les cas, leur surexpression recombinante a entraîné la génération de courants de chlorure membranaire qui sont stimulés par une augmentation de la concentration intracellulaire en calcium et, à des degrés divers, une dépolarisation membranaire. Le voyage pour le CLCA a pris fin lorsqu’il a été constaté qu’il s’agissait d’une protéine sécrétée, mais qui a probablement également régulé à la hausse l’expression membranaire des canaux du ClCa endogènes au système d’exprimation30. Les protéines Tweety et Bestrophine ne présentent pas toutes les propriétés des canaux ClCa étudiés dans les principaux tissus, bien que Best1 semble responsable d’un composant de ClCa dans les neurones sensoriels31 et puisse également être un régulateur important de la libération de calcium par le réticulum endoplasmique32,33. Trois études indépendantes ont proposé le TMEM16A (également appelé Ano1) comme candidat pour un composant majeur, sinon dans son intégralité, pour un canal de chlorure activé par le calcium34-36. De nombreuses études ultérieures, facilitées par la génération d’outils moléculaires, l’ont étayé. Le TMEM16A est important pour réguler l’excitabilité membranaire dans le muscle lisse vasculaire, est régulé à la hausse dans un modèle animal d’hypertension pulmonaire et le tonus peut être réduit par l’inhibition des canaux37,38. Dans les neurones sensoriels, TMEM16A couple la présence de médiateurs inflammatoires à l’hyperexcitabilité membranaire et l’inhibition de TMEM16A a des effets antinociceptifs 39. Dans les modèles animaux d’asthme, l’expression de ce canal chlorure particulier est augmentée et son inhibition peut avoir des effets bénéfiques 40. On le trouve également dans les cellules interstitielles du Cajal de l’intestin et la fonction de canal est requise pour la contraction rythmique du muscle lisse de la paroi intestinale41. De plus, l’activation de TMEM16A peut fournir une voie alternative pour la sécrétion de chlorure épithélial dans la fibrose kystique42. Bien qu’il y ait encore un débat sur la fonction précise du reste de la famille TMEM16, la fonction ClCa a également été attribuée à TMEM16B (Ano2), qui serait à la base du canal ClCa dans les cellules ciliées olfactives 43,44. Cette classe de canaux ioniques peut également jouer un rôle dans la biologie des cellules cancéreuses et son inhibition peut empêcher la prolifération cellulaire 45-48.
Remarques finales
Cette revue a mis en évidence les divers rôles des protéines conductrices ou transporteuses de chlorure et la façon dont leur dysfonctionnement est couplé à des troubles humains ou à des symptômes semblables à des maladies chez les modèles animaux. Il y a un manque grave de réactifs pharmacologiques qui inhibent, activent ou améliorent le trafic membranaire des canaux et des transporteurs de chlorure. Des progrès sont réalisés avec des médicaments qui inversent la fonction défectueuse du CFTR dans la fibrose kystique, ce qui, espérons-le, aboutira à des médicaments spécifiques aux différents types de mutations héréditaires. Les inhibiteurs et les activateurs des canaux de chlorure activés par le calcium TMEM16A42,49 s’avèrent des outils de laboratoire utiles et de nouveaux composés pourraient devenir des médicaments efficaces, en particulier s’ils peuvent produire des effets spécifiques aux tissus. Les molécules spécifiques à des CLC particulières sont probablement les plus insaisissables. La compréhension de la base structurelle de l’activation50 de la CLC à circuit fermé pourrait identifier des domaines protéiques qui peuvent être ciblés par une conception rationnelle de médicaments basée sur la structure. De tels outils nous permettront de mettre à l’épreuve certaines des nouvelles idées thérapeutiques qui ont été examinées et présentées ici.
Biographie de l’auteur

Le Dr Jon Lippiat a terminé son doctorat sur la structure, la fonction et la pharmacologie des canaux potassiques à l’Université de Leicester. Il a étudié la fonction des cellules bêta pancréatiques et le diabète à l’Université d’Oxford avant d’être nommé maître de conférences en pharmacologie à l’Université de Leeds. Ses recherches consistent à élucider les propriétés structurelles et physiologiques de plusieurs types différents de canaux et de transporteurs ioniques et leur ciblage potentiel par de nouveaux réactifs pharmacologiques.
Numéro
Numéro 4 2013
Sujets connexes
Canaux chlorures, Cibles médicamenteuses, Canaux ioniques