Centrosema virginianum
| Centrosema virginianum | |
|---|---|
 |
|
| Photo de Gil Nelson | |
| Classification scientifique | |
| Royaume : | Plantae |
| Division: | Magnoliophyta – Plantes à fleurs |
| Classe: | Magnoliopsida–Dicotylédones |
| Commande : | Fabales |
| Famille: | Fabacées ⁄ Légumineuses |
| Genre : | Centrosema |
| Espèce : | C. virginianum |
| Nom binomial | |
| Centrosema virginianum (L.) Benth. |
|
 |
|
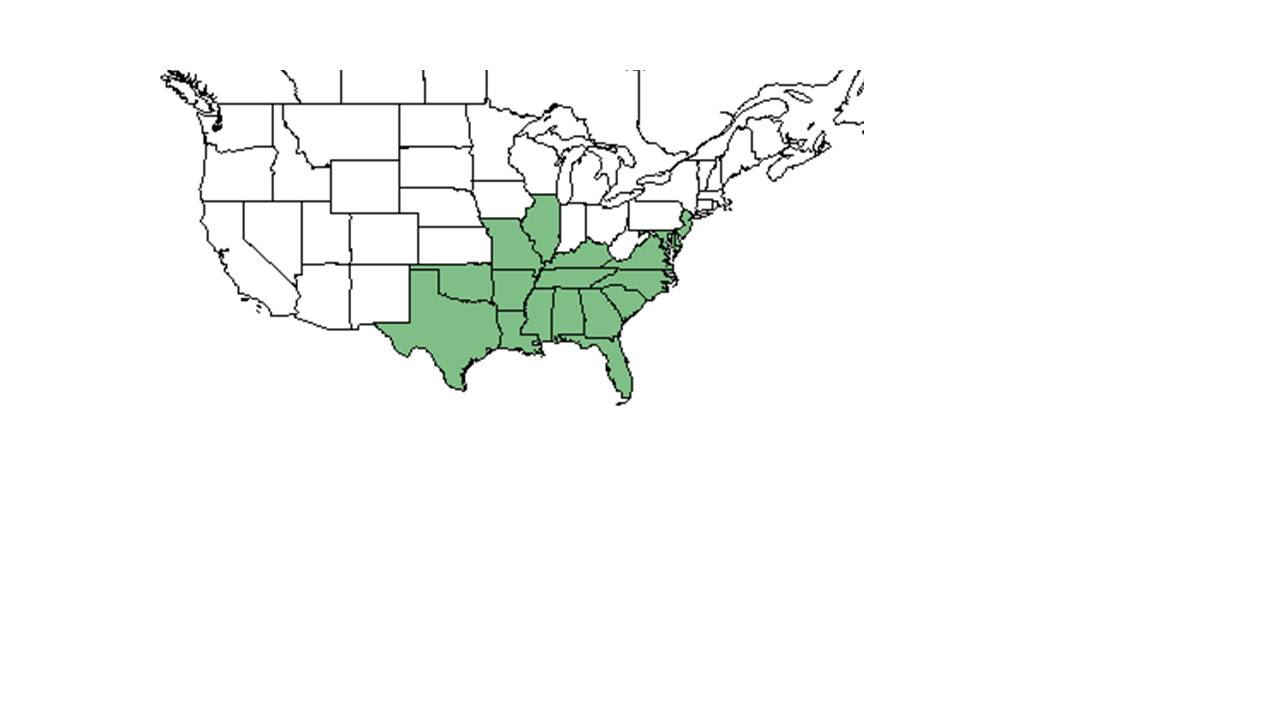
| Aire de répartition naturelle de Centrosema virginianum d’après la base de données des plantes NRCS de l’USDA. | |
Nom commun: Pois papillon aigu
Notes taxonomiques
Synonymes: Bradburya virginiana (Linnaeus) Kuntze.
Variétés: aucun.
Description
Centrosema virginianum est une vigne herbacée vivace. Il pousse comme une vigne tordue, grimpant sur une autre végétation. Le rapport langth/largeur de la foliole est très variable.
Centrosema virginianum pousse de manière à s’enrouler, à grimper et à s’enrouler. La plante est une vigne herbacée vivace qui pousse de 0,5 à 1,5 m de long et qui est plus ou moins minutieusement pubescente. Les feuilles sont 3-foliolées; les folioles sont largement à étroitement ovées, ovales-lancéolées ou oblongues à elliptiques, sont remarquablement réticulées, atteignant la plupart du temps de 2 à 7 cm de long et sont stipellées. Les stipules sont ovales-lancéolées à lancéolées, striées, persistantes, de 1,5 à 4 mm de long. Les racèmes sont à pédoncules atteignant généralement 1 à 5 cm de long, le rachis en zigzag porte 1 à 4 nœuds chacun avec une bractée ovée atteignant 1,5 à 3 cm de long sous-tendant un pédicelle (de 2 à 10 cm de long) surmonté de 2 bractelettes ovées atteignant 0,8 à 1,2 cm de long. Le calice est quelque peu caché par les braclets, le tube est largement hémisphérique, de 4 à 5 mm de long, les lobes sont linéaires-subulés, de 0,6 à 1,4 cm de long, le plus bas le plus long. Les pétales sont de couleur bleu-violet pâle à lavande, de 2,5 à 3,5 cm de long, sont poussés près de la base, les perruques et la quille sont de taille presque égale, env. 2 cm de long. Les étamines sont diadelphes, 9 et 1. La légumineuse est linéaire, aplatie et pousse de 7 à 14 cm de long et environ. large de 4 mm, il est subsessile, beaucoup sont ensemencés avec un style allongé, persistant, en forme de bec, les valves se tordant longitudinalement après la déhiscence.
Répartition
C. virginianum est originaire du sud-est des États-Unis, au nord jusqu’à l’Illinois et au New Jersey, le long de la côte est et au sud jusqu’à la Floride, et à l’ouest jusqu’au Texas et à l’Oklahoma. Il est également originaire de Porto Rico ainsi que des îles Vierges.
Écologie
C’est une légumineuse qui possède l’un des potentiels de fixation de l’azote les plus élevés. Pour cette raison, il peut être en mesure d’aider à restaurer N perdu par le feu. À la mi-saison, en juin et juillet, un taux maximal de fixation de l’azote a été observé.
Habitat
On le trouve dans un large éventail de conditions naturelles et perturbées, y compris les sandhills fréquemment brûlés, l’agropyre à feuilles longues des hautes terres et les pinèdes et bois plats des anciens champs, les dunes et les rivages des îles côtières, les zones ouvertes dans les mangroves, les plaines inondables boisées et les lisières des forêts de feuillus, et les tourbières. On le trouve dans les communautés de pins loblolly. On peut également le trouver dans les communautés de pin à feuilles longues et de graminées grillagées. De plus, C. virginianum est une espèce caractéristique de la communauté pin-chêne-caryer à feuilles courtes. Il tolère les auvents sur étages qui diminuent le niveau de lumière à environ la moitié de celui ambiant (c’est-à-dire qu’il peut vivre dans des zones partiellement ombragées et que sa capacité de fixation de l’azote ne sera pas significativement affectée). Il pousse dans des zones très perturbées, mais il est également omniprésent dans les hautes terres de pins à longues feuilles indigènes de haute qualité et les sandhills. Il se rencontre dans des sols allant des sables profonds (Entisols) aux loams sableux (Ultisols). C. virginianum réagit positivement à la perturbation du sol dans les plaines côtières de Caroline du Sud, y compris les perturbations liées à l’agriculture, ce qui le classe comme une espèce indicatrice des forêts post-agricoles. Il ne réagit pas à la perturbation du sol en coupant à blanc et en coupant dans les forêts de feuillus plats du nord de la Floride.
Les espèces associées comprennent la Ronce de mûre, le chêne de dinde, le pin à feuilles longues, Galactia, Strophostyles, Smilax, Penstemon, Lechea, Chrysopsis, Brumelia, Centrosema, Euphorbia, Cassia, Serenoa repens, Quercus incana, Quercus chapmanii, Diospyros, Aristida, Andropogon, herbe de bahia, Rubus, trèfle, Pinus taeda, Liquidambar styraciflua, et d’autres.
Phénologie
C. virginianum a été observé fleurissant entre avril et octobre, avec une inflorescence maximale en juin et juillet, et des fruits principalement en juin et septembre.
Dispersion des graines
On pense que cette espèce est dispersée par les fourmis et/ou la déhiscence explosive.
Banque de graines et germination
Elle se propage par clonage par production de rhizomes. Les téguments sont durs et les graines et restent viables dans la banque de semences pendant au moins deux ans. Pour une germination optimale, C. virginianum a besoin d’environ 2 secondes de temps de scarification. Il a également été constaté qu’il avait la plus grande germination à la chaleur sèche à un indice de chaleur compris entre 128,76 et 191,83 et une durée de vapeur de 10 secondes. Grâce à une étude sur les effets de la variation des charges de combustible fin sur la germination après la combustion, il a été constaté qu’il avait une plus grande germination dans un combustible faible que dans un combustible élevé, avec un taux de mortalité également plus faible, bien que le taux de germination le plus élevé et la mortalité la plus faible aient été contrôlés par aucun régiment de brûlage.
Écologie du feu
Il prospère sous le feu. Hendricks a observé que les parcelles du Piedmont National Wildlife Refuge, qui étaient sous un régime de brûlage de 4 ans depuis 1966, contenaient chacune plus de 10 fois plus de C. individus de virginianum par ha que les parcelles de la forêt nationale d’Oconee, qui n’avaient pas d’histoire de combustion. La combustion saisonnière ne semble pas affecter négativement la fixation de l’azote. C. virginianum a montré une synchronie de floraison accrue en réponse aux brûlures de la saison de la foudre. Il répond le mieux aux brûlures de mars en ce qui concerne les apports tissulaires annuels ainsi que la contribution à l’azote. C. virginianum a montré une réponse florifère robuste aux brûlures de la fin de l’hiver et du début du printemps, ce qui confirme la réponse aux brûlures de mars notée précédemment. Il a un pic de floraison au milieu de l’été. En outre, une étude n’a trouvé aucune preuve que la floraison accrue affecte la capacité de fixation de l’azote.
Pollinisation
Sa fleur est hautement spécialisée pour la pollinisation par les grands hyménoptères. Il faut que les abeilles pour la pollinisation “déclenchent” le mécanisme de livraison du pollen. Les relations pollinisateurs-plantes semblent robustes à l’altération de la phénologie de la floraison résultant de la variation de la saison de combustion.Bombus pennsylvanicus a été observé se nourrissant et collectant du pollen.
Utilisation par les animaux
Parce que C. le virginianum est une légumineuse, et les légumineuses sont riches en protéines et en minéraux, un certain nombre d’herbivores, notamment le Gopherus polyphemus, le cerf de Virginie et la caille blanche, le consomment. Une étude a révélé qu’il s’agit d’une plante significativement importante en 1 an et 2 ans pour le régime de caille blanche. Il représente en moyenne environ 10 à 25% du régime alimentaire des grands mammifères et des oiseaux terrestres.
Maladies et parasites
C. virginianum peut être infecté par les espèces de nématodes à nœud racinaire Meloidogyne arenaria, M. incognita et M. javanica, mais il est modérément résistant.
Conservation et gestion
Il est classé en danger par le département de la Protection de l’Environnement et de l’Énergie du New Jersey. C. virginianum est tolérant à l’herbicide imazapyr. Également pour la gestion, il bénéficie de l’éclaircissement de la verrière de l’étage supérieur.
Culture et restauration
Références et notes
- 1.0 1.1 Weakley, A.S. 2015. Flore des États du sud et du centre de l’Atlantique. Projet de travail du 21 mai 2015. Université de Caroline du Nord à Chapel Hill, Chapel Hill, Caroline du Nord.
- 2.0 2.1 2.2 Base de données de l’herbier Robert K. Godfrey de l’Université d’État de Floride. URL : http://herbarium.bio.fsu.edu. Dernière consultation : juin 2014. Les collectionneurs: Loran C. Anderson, John C. Ogden, Gwynn W. Ramsey, R.K. Godfrey, R. S. Mitchell; R. C. Phillips, K. Craddock Burks, Gary R. Knight, D. W. Mather, C. Jackson, D. B. Ward, Mary Margaret Williams, O. Lakela, Brenda Herring, Jame Amoroso, Gwynn W. Ramsey, Richard Mitchell, Gail A. Steverson, Grady W. Reinert, George R. Cooley, R. J. Eaton, R. Kral, Cecil R. Slaughter, Andre F. Clewell, R. Komarek, R. F. Il S’agit d’un projet de recherche sur l’utilisation de la technologie de l’information dans le domaine de la recherche et de l’Innovation, qui vise à améliorer la qualité de l’information et À améliorer la qualité de l’information et De la Communication. Correll, Lloyd H. Shinners, Geo M. Merrill et H J Hamby. États et comtés: Alabama: Baldwin. Arkansas : Petit Rocher. Floride: Baie, Agrumes, Collier, Duval, Escambia, Franklin, Gadsden, Golfe, Hillsborough, Jackson, Jefferson, Leon, Liberté, Lamantin, Marion, Okaloosa, Polk, St Johns, St. Lucie, Suwannee, Wakulla et Washington. Georgia : Bartow, Grady, Madison et Thomas. Mississippi : Forrest, Harrison, Jackson, Pearl River et Pike. Caroline du Nord : Alamance, Orange et Wilkes. Il s’agit d’Angelina, Bastrop, Freestone, Harris, Morris, Tarrant et Van Zandt.
- Weakley, A.S. (2015). Flore des États du Sud et du Centre de l’Atlantique. Chapel Hill, Caroline du Nord, Herbier de l’Université de Caroline du Nord.
- Radford, Albert E., Harry E. Ahles et C. Ritchie Bell. Manuel de la Flore vasculaire des Carolines. 1964, 1968. La presse de l’Université de Caroline du Nord. 635-6. Imprimer
- 5,0 5,1 USDA, NRCS. (2016). La base de données des PLANTES (http://plants.usda.gov, 4 avril 2019). Équipe nationale de données sur les plantes, Greensboro, NC 27401-4901 États-Unis.
- 6,0 6,1 6,2 Cathey, S. E., L. R. Boring, et al. (2010). “Assessment of N2 fixation capability of native legumes from the longleaf pine-wiregrass ecosystem.”Environmental and Experimental Botany 67:444-450.
- 7.0 7.1 7.2 7.3 Les résultats de l’étude sont les suivants : (1999). “Distribution of native legumes (Leguminoseae) in frequently burned longleaf pine (Pinaceae)-wiregrass (Poaceae) ecosystems.”American Journal of Botany 86: 1606-1614.
- 8,0 8,1 8,2 Cushwa, C.T. (1966). La réponse de la végétation herbacée au brûlage dirigé. Asheville, Service forestier de l’USDA.
- Clewell, A. F. (2013). “Prévalence antérieure des forêts de pins, de chênes et de caryer à feuilles courtes dans les collines rouges de Tallahassee.” Castanée 78(4): 266-276.
- Brudvig, L.A. et E.I. Damchen. (2011). L’histoire de l’utilisation des terres, la connectivité historique et la gestion des terres interagissent pour déterminer la richesse et la composition du sous-étage forestier de pins à longues feuilles. Ecography 34:257-266.
- Brudvig, L.A., E Grman, C.Il s’agit de la première édition de la série. (2013). Fort héritage de l’utilisation des terres agricoles sur les sols et les communautés végétales du sous-étage dans les forêts de pins à longues feuilles. Forest Ecology and Management 310: 944-955.
- Moore, W.H., B.F. Swindel et W.S. Terry. (1982). Réponse végétative à la coupe à blanc et à la coupe dans une forêt de bois plats du Nord de la Floride. Journal de gestion des aires de répartition 35 (2): 214-218.
- Nelson, G. PanFlora: Données sur les plantes de l’est des États-Unis, en mettant l’accent sur les plaines côtières du Sud-Est, la Floride et le Panhandle de Floride. www.gilnelson.com/PanFlora / Consulté: 7 DÉC 2016
- Kirkman, L. Katherine. Base de données non publiée sur le mode de dispersion des graines des plantes trouvées dans les prairies de pins à longues feuilles des plaines côtières du Jones Ecological Research Center, en Géorgie.
- Hiers, J. K. et R. J. Mitchell (2007). “The influence of burning and light availability on N-2-fixation of native legumes in longleaf pine woodlands.”Journal de la Société botanique de Torrey 134:398-409.
- Coffey, K. L. et L. K. Kirkman (2006). “Stratégies de germination des graines d’espèces à potentiel de restauration dans une savane de pins entretenue par le feu.”Natural Areas Journal 26:289-299.
- Wiggers, M. S., et al. (2017). “Tolérance à la chaleur des graines et germination de six espèces de légumineuses originaires d’une forêt de pins à feuilles longues sujettes au feu.”Plant Ecology 218:151-171.
- Wiggers, M. S., et al. (2013). “Fine-scale variation in surface fire environment and legume germination in the longleaf pine ecosystem.”Forest Ecology and Management 310:54-63.
- Hendricks, J. J. et L. R. Boring (1999). “N2-fixation by native herbaceous legumes in burned pine ecosystems of the southeastern United States.”Forest Ecology and Management 113:167-177.
- 20.0 20.1 20.2 20.3 20.4 20.5 Hiers, J. K., R. J. Mitchell et coll. (2003). “Les légumineuses indigènes des savanes de pins à feuilles longues présentent une capacité de fixation élevée du N2 et des impacts négligeables en raison du moment de l’incendie.”New Phytologist 157:327-338
- Spears, Jr. E. E. 1987. Écologie de la pollinisation insulaire et continentale de Centrosema virginianum et Opuntia stricta. J. Ecol. 75: 351-362.
- Godts J.E. 1990 Le Palmier à Fleurs à l’envers 10(4):3
- M. Sweeney, J. M., et coll. (1981). Nourriture de caille blanche dans de jeunes plantations de pins loblolly de l’Arkansas. Bulletin de la Station expérimentale de l’Arkansas 852. Fayetteville, AR, Université de l’Arkansas, Division de l’Agriculture, Station d’expérimentation agricole.
- Miller, J.H. et K.V. Miller. 1999. Plantes forestières du sud-est et leurs utilisations fauniques. Société scientifique des mauvaises herbes du Sud.
- Quesenberry, K. H., et al. (2008). “Response of native southeastern U.S. legumes to root-knot nematodes.”Crop Science 48: 2274-2278.
- (2000). Le rôle du feu dans la gestion de la faune sauvage et la restauration des communautés: Utilisations traditionnelles et nouvelles directions, Nashville, TN, Service forestier de l’USDA, Station de recherche du Nord-Est.
- Brockway, D. G. et C. E. Lewis (2003). “Influence du cerf, du pâturage du bétail et de la récolte du bois sur la diversité des espèces végétales dans un écosystème de pin à longues feuilles.”Forest Ecology and Management 175:49-69.