Contrôle cognitif
Évaluation | Biopsychologie | Comparatif | Cognitif | Développemental | Langage / Différences individuelles / Personnalité / Philosophie / Social /
Méthodes / Statistiques | Articles cliniques | Éducatifs | Industriels / Professionnels / Psychologie du Monde /
Psychologie Cognitive:Attention * Prise de décision · Apprentissage · Jugement · Mémoire · Motivation · Perception · Raisonnement · Pensée – Processus cognitifsCognition – OutlineIndex
Le contrôle cognitif est un terme synonyme de Fonction exécutive, voir Système exécutif, et utilisé par les psychologues et les neuroscientifiques pour décrire une collection vaguement définie de processus cérébraux dont le rôle est de guider la pensée et le comportement conformément aux objectifs ou plans générés en interne. Souvent, le contrôle cognitif est invoqué lorsqu’il est nécessaire de remplacer les réponses qui pourraient autrement être automatiquement déclenchées par des stimuli dans l’environnement externe. Par exemple, lorsqu’on lui présente un stimulus potentiellement gratifiant, tel qu’un délicieux morceau de gâteau au chocolat, la réponse automatique pourrait être de prendre une bouchée. Cependant, lorsque ce comportement entre en conflit avec des plans internes (comme le fait d’avoir décidé de ne pas manger de gâteau au chocolat pendant un régime), le contrôle cognitif peut être engagé pour inhiber cette réponse. Les mécanismes neuronaux par lesquels le contrôle cognitif est mis en œuvre sont un sujet de débat en cours dans le domaine des neurosciences cognitives.
- Perspective historique
- Miller & Le modèle de Cohen (2001)
- Preuves expérimentales
- Sensibilité au contexte des neurones PFC
- Preuves d’un biais attentionnel dans les régions sensorielles
- Connectivité entre le PFC et les régions sensorielles pendant le contrôle cognitif
- Contrôle inhibiteur descendant
- Contributions plus récentes
Perspective historique
Bien que la recherche sur le contrôle cognitif et sa base neuronale ait considérablement augmenté au cours des 5 dernières années (l’indice de citations médicales Pubmed révèle un nombre croissant de citations pour le terme de recherche “contrôle cognitif” de 1995 à 2006), le cadre théorique dans lequel il se situe n’est pas nouveau. Dans les années 1950, le psychologue britannique Donald Broadbent établit une distinction entre les processus “automatiques” et “contrôlés”, et introduit la notion d’attention sélective, à laquelle le contrôle cognitif est étroitement allié. Le terme lui-même n’est pas non plus de provenance récente: en 1975, le psychologue américain Michael Posner a publié un chapitre de livre intitulé “Attention et contrôle cognitif”. Les travaux de chercheurs influents tels que Michael Posner, Joaquin Fuster, Tim Shallice et leurs collègues dans les années 1980 ont jeté une grande partie des bases des recherches récentes sur le contrôle cognitif. Par exemple, Posner a proposé qu’il existe une branche “exécutive” distincte du système attentionnel, chargée de concentrer l’attention sur certains aspects de l’environnement. Le neuropsychologue britannique Tim Shallice a également suggéré que l’attention est régulée par un “système de supervision”, qui peut remplacer les réponses automatiques en faveur d’un comportement de planification sur la base de plans ou d’intentions. Tout au long de cette période, un consensus s’est dégagé sur le fait que ce système de contrôle est logé dans la partie la plus antérieure du cerveau, le cortex préfrontal (PFC).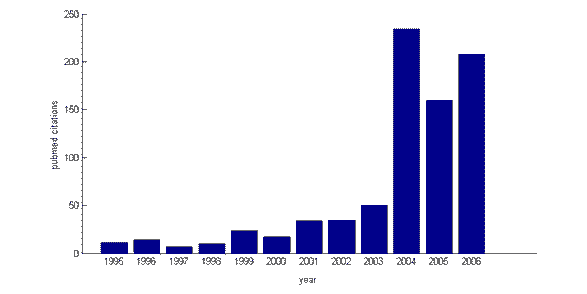
Miller & Le modèle de Cohen (2001)
Plus récemment, en 2001, Earl Miller et Jonathan Cohen ont publié un article influent intitulé “An integrative theory of prefrontal cortex function” dans lequel ils soutiennent que le contrôle cognitif est la fonction principale du PFC, et que le contrôle est mis en œuvre en augmentant le gain de neurones sensoriels ou moteurs engagés par des éléments pertinents de l’environnement externe. Dans un paragraphe clé, ils soutiennent:
“Nous supposons que le PFC remplit une fonction spécifique dans le contrôle cognitif: le maintien actif des schémas d’activité qui représentent les objectifs et les moyens de les atteindre. Ils fournissent des signaux de biais dans une grande partie du reste du cerveau, affectant non seulement les processus visuels, mais également d’autres modalités sensorielles, ainsi que les systèmes responsables de l’exécution de la réponse, de la récupération de la mémoire, de l’évaluation émotionnelle, etc. L’effet global de ces signaux de biais est de guider le flux d’activité neuronale le long des voies qui établissent les mappages appropriés entre les entrées, les états internes et les sorties nécessaires pour effectuer une tâche donnée.’
Miller et Cohen s’appuient explicitement sur une théorie antérieure de l’attention visuelle qui conceptualise la perception d’une scène visuelle en termes de compétition entre plusieurs représentations – telles que les couleurs, les individus ou les objets L’attention visuelle sélective agit pour “biaiser” cette compétition en faveur de certaines caractéristiques ou représentations sélectionnées. Par exemple, imaginez que vous attendez dans une gare très fréquentée un ami qui porte un manteau rouge. Vous êtes en mesure de concentrer sélectivement votre attention sur la recherche d’objets rouges, dans l’espoir d’identifier votre ami. Desimone et Duncan soutiennent que le cerveau y parvient en augmentant sélectivement le gain de neurones sensibles à la couleur rouge, de sorte que la sortie de ces neurones est plus susceptible d’atteindre une étape de traitement en aval et, par conséquent, de guider le comportement. Selon Miller et Cohen, ce mécanisme d’attention sélective n’est en fait qu’un cas particulier de contrôle cognitif – celui dans lequel le biais se produit dans le domaine sensoriel. Selon le modèle de Miller et Cohen, le PFC peut exercer un contrôle sur les neurones d’entrée (sensorielle) ou de sortie (réponse), ainsi que sur les assemblages impliqués dans la mémoire ou l’émotion. Le contrôle cognitif est médié par une connectivité réciproque entre le PFC et les cortex sensoriel, limbique et moteur. Dans leur approche, le terme “contrôle cognitif” s’applique donc à toute situation où un signal de polarisation est utilisé pour promouvoir une réponse adaptée aux tâches, et le contrôle devient ainsi un élément crucial d’un large éventail de constructions psychologiques telles que l’attention sélective, la surveillance des erreurs, la prise de décision, l’inhibition de la mémoire et l’inhibition de la réponse.
Preuves expérimentales
Une grande partie des preuves expérimentales des structures neuronales impliquées dans le contrôle cognitif provient de tâches de laboratoire telles que la tâche Stroop ou la tâche de tri des cartes du Wisconsin (WCST). Dans la tâche Stroop, par exemple, les sujets humains sont invités à lire les noms de couleurs présentés dans des couleurs d’encre contradictoires (par exemple, le mot “ROUGE” à l’encre verte). Un contrôle cognitif est nécessaire pour effectuer cette tâche, car le comportement relativement surappris et automatique (lecture de mots) doit être inhibé au profit d’une tâche moins pratiquée – nommer la couleur de l’encre. Des études récentes de neuroimagerie fonctionnelle ont montré que deux parties du PFC, le cortex cingulaire antérieur (ACC) et le cortex préfrontal dorsolatéral (DLPFC), sont considérées comme particulièrement importantes pour effectuer cette tâche. Cependant, les études de neuroimagerie fonctionnelle ne peuvent à elles seules prouver qu’une région cérébrale donnée (activée) est essentielle à l’exécution d’une tâche – qui nécessite une neuropsychologie, par exemple, ainsi que d’autres études de perte de fonction utilisant la stimulation magnétique transcrânienne, par exemple.
Sensibilité au contexte des neurones PFC
D’autres preuves de l’implication du PFC dans le contrôle cognitif proviennent d’études d’électrophysiologie unicellulaire chez des primates non humains, tels que le singe macaque, qui ont montré que (contrairement aux cellules du cerveau postérieur) de nombreux neurones PFC sont sensibles à la conjonction d’un stimulus et d’un contexte. Par exemple, les cellules PFC peuvent répondre à un signal vert dans une condition où ce signal signale qu’un saccade vers la gauche doit être effectué, mais pas à un signal vert dans un autre contexte expérimental. Ceci est important, car le déploiement optimal du contrôle cognitif dépend invariablement du contexte. Pour citer un exemple offert par Miller et Cohen, un résident américain pourrait avoir une réponse exagérée pour regarder à gauche lorsqu’il traverse la route. Cependant, lorsque le “contexte” indique qu’il se trouve au Royaume-Uni, cette réponse devrait être supprimée au profit d’un appariement stimulus-réponse différent (regardez à droite lorsque vous traversez la route). Ce répertoire comportemental nécessite clairement un système neuronal capable d’intégrer le stimulus (la route) à un contexte (États-Unis, Royaume-Uni) pour marquer un comportement (regardez à gauche, regardez à droite). Les preuves actuelles suggèrent que les neurones du PFC semblent représenter précisément ce type d’information. D’autres preuves de l’électrophysiologie unicellulaire chez le singe impliquent la PFC ventrolatérale (convexité préfrontale inférieure) dans le contrôle des réponses motrices. Par exemple, des cellules ont été identifiées qui augmentent leur cadence de tir aux signaux NoGo ainsi qu’un signal qui dit “ne regardez pas là!” .
Preuves d’un biais attentionnel dans les régions sensorielles
Des études d’électrophysiologie et de neuroimagerie fonctionnelle impliquant des sujets humains ont été utilisées pour décrire les mécanismes neuronaux sous-jacents au biais attentionnel. La plupart des études ont cherché une activation aux “sites” de polarisation, tels que les cortex visuels ou auditifs. Les premières études ont utilisé des potentiels liés aux événements pour révéler que les réponses cérébrales électriques enregistrées sur le cortex visuel gauche et droit sont améliorées lorsque le sujet est invité à s’occuper du côté approprié (controlatéral) de l’espace. L’avènement de techniques de neuroimagerie basées sur le flux sanguin telles que l’imagerie par résonance magnétique fonctionnelle (IRMf) et la tomographie par émission de positons (TEP) a récemment permis de démontrer que l’activité neuronale dans un certain nombre de régions sensorielles, y compris les régions sensibles aux couleurs, aux mouvements et au visage du cortex visuel, est améliorée lorsque les sujets sont invités à s’occuper de cette dimension d’un stimulus, suggérant un contrôle du gain dans le néocortex sensoriel. Par exemple, dans une étude typique, Liu et ses collègues ont présenté des sujets avec des tableaux de points se déplaçant vers la gauche ou la droite, présentés en rouge ou en vert. Avant chaque stimulus, un repère d’instructions indiquait si les sujets devaient répondre en fonction de la couleur ou de la direction des points. Même si la couleur et le mouvement étaient présents dans tous les réseaux de stimulus, l’activité IRMf dans les régions sensibles à la couleur (V4) a été améliorée lorsque les sujets ont reçu l’ordre de s’occuper de la couleur, et l’activité dans les régions sensibles au mouvement a été augmentée lorsque les sujets ont été incités à s’occuper de la direction du mouvement. Plusieurs études ont également rapporté des preuves du signal de polarisation avant le début du stimulus, avec l’observation que les régions du cortex frontal ont tendance à devenir actives avant le début d’un stimulus attendu.
Connectivité entre le PFC et les régions sensorielles pendant le contrôle cognitif
Malgré la monnaie croissante du modèle de “biais” du contrôle cognitif, les preuves directes de la connectivité fonctionnelle entre le PFC et les régions sensorielles pendant le contrôle cognitif sont à ce jour plutôt rares. En effet, la seule preuve directe provient d’études dans lesquelles une partie du cortex frontal est endommagée, et un effet correspondant est observé loin du site de lésion, dans les réponses des neurones sensoriels,. Cependant, peu d’études ont exploré si cet effet est spécifique aux situations où un contrôle est nécessaire. D’autres méthodes de mesure de la connectivité entre des régions cérébrales distantes, telles que la corrélation dans la réponse IRMf, ont fourni des preuves indirectes que le cortex frontal et les régions sensorielles communiquent au cours de divers processus censés engager le contrôle cognitif, tels que la mémoire de travail, mais des recherches supplémentaires sont nécessaires pour établir comment les informations circulent entre le PFC et le reste du cerveau pendant le contrôle cognitif.
Contrôle inhibiteur descendant
Outre les mécanismes de contrôle facilitateurs ou amplificateurs, de nombreux auteurs ont plaidé pour des mécanismes inhibiteurs dans le domaine du contrôle de la réponse, de la mémoire, de l’attention sélective et des émotions.
Contributions plus récentes
Au cours des 6 années qui se sont écoulées depuis la publication de l’article de Miller & Cohen, d’autres preuves importantes des processus de contrôle cognitif dans le cortex préfrontal ont été décrites. Un article de revue largement cité souligne le rôle de la partie médiane du PFC dans les situations où le contrôle cognitif est susceptible d’être engagé – par exemple, lorsqu’il est important de détecter les erreurs, d’identifier les situations où un conflit de stimulus peut survenir, de prendre des décisions dans l’incertitude ou lorsqu’une probabilité réduite d’obtenir des résultats de performance favorables est détectée. Cette revue, comme beaucoup d’autres, met en évidence les interactions entre la PFC médiale et latérale, par laquelle le cortex frontal médial postérieur signale la nécessité d’un contrôle cognitif accru et envoie ce signal aux zones du cortex préfrontal dorsolatéral qui implémentent réellement le contrôle. Une autre théorie importante souligne que les interactions le long de l’axe perpendiculaire du cortex frontal, arguant qu’une “cascade” d’interactions entre le PFC antérieur, le PFC dorsolatéral et le cortex prémoteur guide le comportement en fonction du contexte passé, du contexte présent et des associations sensorimotrices actuelles respectivement.
- Posner, M.I., & Snyder, C.R.R. (1975). Attention et contrôle cognitif. Dans R. Solso (éd.), Traitement de l’Information et Cognition : Le Symposium Loyola. Il s’agit de l’un des plus grands noms de la littérature française.
- Posner, M.I. & Petersen, S.E. (1990) Le système d’attention du cerveau humain. Revue annuelle des Neurosciences, 13, 25-42
- Shallice, T., Venable, N., Rumiati, R.I. (1988). De la neuropsychologie à la structure mentale, Cambridge: CUP.
- Miller, E.K. & Cohen, J.D. (2001). Une théorie intégrative de la fonction du cortex préfrontal. Annu Rev Neurosci. 2001;24:167-202
- Desimone R, Duncan J (1995). Mécanismes neuronaux de l’attention visuelle sélective. Annu Rev Neurosci. 1995;18:193-222.
- Boursiers LK et Farah MJ. Le cortex cingulaire antérieur est-il nécessaire au contrôle cognitif?Cerveau. Avril 2005;128 (Pt 4): 788-96. Epub 2005 10 février.
- Rushworth MF et al. Role of the human medial frontal cortex in task switching: a combined IRMf and TMS study. J Neurophysiol. Mai 2002;87(5):2577-92
- Sakagami M et coll. Un code d’inhibition comportementale sur la base de la couleur, mais pas du mouvement, dans le cortex préfrontal ventrolatéral du singe macaque.J Neurosci. 2001 1er juillet; 21(13): 4801-8.
- Hasegawa RP et al. Neurones préfrontaux codant la suppression de saccades spécifiques.Neurone. 2004 5 août; 43(3): 415-25.
- Hillyard SA, Anllo-Vento L (1998). Potentiels cérébraux liés aux événements dans l’étude de l’attention sélective visuelle. Proc Natl Acad Sci U S A 95:781-7
- Liu T, Slotnick SD, Serences JT, Yantis S (2003). Mécanismes corticaux de contrôle attentionnel basé sur les caractéristiques. Céreb. Cortex 13:1334-43.
- Kastner S, Pinsk MA, De Weerd P, Desimone R, Ungerleider LG (1999). Activité accrue dans le cortex visuel humain pendant l’attention dirigée en l’absence de stimulation visuelle. Neurone 22:751-61
- Miller BT, D’Esposito M (2005). Recherche de “le haut” dans le contrôle de haut en bas. Neurone 48:535-8
- Barcelo F, Suwazono S, Chevalier RT (2000). Modulation préfrontale du traitement visuel chez l’homme.Nat Neurosci. 3:399-403
- Fuster JM, Bauer RH, Jervey JP. 1985. Interactions fonctionnelles entre le cortex inférotemporal et préfrontal dans une tâche cognitive. Brain Res. 330:299-307.
- Gazzaley A, Rissman J, D’esposito M (2004). Connectivité fonctionnelle pendant la maintenance de la mémoire de travail. Cogn Affecte le comportement Neurosci. 4:580-99
- Aron AR & Poldrack RA (2006). Contributions corticales et sous-corticales à l’inhibition de la réponse du signal d’arrêt: rôle du noyau sous-thalamique. Journal of Neuroscience 26 2424-2433
- Anderson MC, Green C (2001) Suppressing unwanted memories by executive control. Nature 410:366-369.
- Benne SP (2001) L’amorçage négatif reflète-t-il des mécanismes inhibiteurs? Un examen et une intégration des points de vue contradictoires. Q J Exp Psychol A 54:321-343.
- Ochsner KN, Gross JJ (2005) Le contrôle cognitif des émotions. Tendances Cogn Sci 9:242-249
- Ridderinkhof KR, Ullsperger M, Crone EA, Nieuwenhuis S (2004). Le rôle du cortex frontal médial dans le contrôle cognitif. Sciences 306:443-7
- MM Botvinick, TS Braver, DM Barch, CS Carter, JD Cohen (2001). Surveillance des conflits et contrôle cognitif. Revue psychologique 108:624-52
- Koechlin E, Ody C, Kouneiher F (2003). L’architecture du contrôle cognitif dans le cortex préfrontal humain. Sciences 302:1181-5
Cette page utilise du contenu sous licence Creative Commons de Wikipédia (voir les auteurs).