Dr Chittaranjan Das
L’objectif principal de notre laboratoire est de comprendre le rôle fonctionnel des enzymes deubiquitinantes (deubiquitinases ou DUBs) dans les voies cellulaires, en particulier celles impliquées dans la neurodégénérescence (perte progressive de neurones), telles que la maladie d’Alzheimer (MA) et la maladie de Parkinson (PD). Une grande variété de processus biologiques sont contrôlés par la modification réversible post-traductionnelle des protéines par la fixation covalente de l’ubiquitine, un polypeptide eucaryote à 76 résidus hautement conservé. L’ubiquitination peut être considérée comme l’événement de départ d’une cascade de signalisation (signalisation de l’ubiquitine) qui est finalement terminée par l’élimination hydrolytique de l’étiquette de l’ubiquitine par un DUB. Une étude du génome humain révèle la présence d’environ 90 DUBs, suggérant leur implication dans une grande variété de voies biochimiques. Notre approche de l’étude des DUBs est basée sur l’application combinée d’un certain nombre d’outils, notamment la synthèse chimique de sondes à petites molécules, la cristallographie aux rayons X et la protéomique basée sur la spectrométrie de masse.
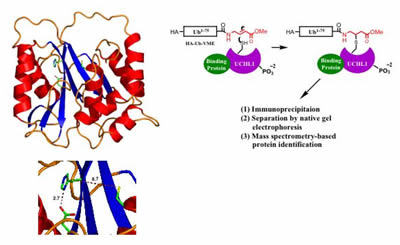
La structure de ERCL1 déterminée par cristallographie aux rayons X suggère que l’enzyme peut adopter deux états, un état inactif (dans lequel les résidus catalytiques sont désalignés, illustré à gauche) et un état actif présumé – dans lequel les résidus sont alignés par interaction de la protéine avec des cofacteurs inconnus. Une méthode proposée pour l’identification des cofacteurs d’ERCL1 via une purification basée sur l’activité à partir d’extraits de cellules entières (à droite).
Actuellement, nous étudions la fonction normale de l’ubiquitine C-terminale neuronale DUB hydrolase L1 (ERCL1) – une protéine spécifique neuronale associée à la PD dont la fonction physiologique est inconnue. Nos efforts dans cette direction visent à développer des inhibiteurs de petites molécules perméables aux cellules de l’ERCL1 qui peuvent être utilisés pour sonder sa fonction (normale et associée à la maladie), déterminer ses partenaires de liaison par purification basée sur l’affinité à partir d’extraits de cellules entières et définir la base moléculaire de la façon dont une variante naturelle de cette enzyme – dans laquelle Ser en position 18 est substituée par Tyr (appelé polymorphe S18Y) – fournit une protection contre la maladie de Parkinson (PD). En plus de l’ERCL1, nous menons également des études structurelles et mécanistiques sur d’autres enzymes apparentées qui seraient impliquées dans des processus biochimiques fondamentaux tels que la réparation de l’ADN, la modification des histones et l’endocytose des protéines de la membrane plasmique.
Éducation
- Doctorat., Institut indien des Sciences, 2001
- Boursier postdoctoral, Faculté de médecine de Harvard et Université Brandeis, 2006
Reconnaissances
- Bourse de recherche Senior, Commission des subventions Universitaires, Inde , 1996
Publications
Liste des publications