Frontières en médecine
- Introduction
- Patients et méthodes
- Sélection des patients dans la Base de données sur la surveillance, l’épidémiologie et les résultats finaux
- Analyse statistique
- Résultats
- Caractéristiques du patient
- Risque accru de stade T1 par rapport aux Autres Stades T dans le contexte de l’élévation sérique de l’AEC
- Effet de l’élévation sérique préopératoire de l’ACE au stade T
- Discussion
- Déclaration de disponibilité des données
- Énoncé d’éthique
- Contributions des auteurs
- Conflit d’intérêts
- Remerciements
Introduction
Le cancer du rectum est l’une des tumeurs malignes les plus courantes dans le monde (1). Selon le système de stadification du Comité mixte américain sur le cancer (AJCC), l’étendue anatomique de la tumeur primitive (stade T) est l’un des prédicteurs pronostiques les plus importants. Cependant, les patients présentant le même stade T du cancer rectal peuvent présenter des résultats cliniques considérablement différents.
Signalé pour la première fois en 1965, l’antigène carcinoembryonique (ACE) est une glycoprotéine de 180 à 200 kDa et fait partie de la superfamille des immunoglobulines (2). Le CEA est sécrété par une variété de tumeurs solides, dont 90% des cancers colorectaux (3). En tant que biomarqueur pronostique sérique le plus important et le plus fiable dans le cancer colorectal, des taux élevés d’ACE préopératoires sont associés à un pronostic pire du cancer colorectal (4-9).
Des études antérieures ont démontré que l’ACE était associée à l’adhésion des cellules cancéreuses et à l’immunité innée dans le cancer colorectal. De plus, il a également été rapporté que l’ACE facilitait la fixation des cellules cancéreuses colorectales aux sites de métastases et soutenait la progression tumorale (10-12).
Traditionnellement, la propagation à distance des cellules tumorales a été considérée comme un événement tardif, mais les résultats de plusieurs études antérieures ont indiqué que l’acquisition d’un potentiel métastatique pourrait se produire au tout début de la progression tumorale (13-16). Wo et coll. (17) ont rapporté qu’une très petite taille de tumeur impliquée dans la positivité des ganglions lymphatiques pouvait être un substitut à la biologie agressive. Nous soupçonnons alors que le cancer du rectum à un stade très précoce avec élévation de l’AEC sérique pourrait suggérer l’acquisition précoce d’un potentiel métastatique et prédire une très mauvaise survie du cancer du rectum.
Cependant, à notre connaissance, peu d’études ont été rapportées pour étudier l’association du stade T et des taux sériques d’ACE (C0 et C1) dans la détermination du pronostic du cancer du rectum. Par conséquent, nous menons cette vaste étude basée sur la population pour examiner si un stade T très précoce dans le contexte de l’élévation de l’ACE sérique peut être un substitut à une maladie biologiquement agressive et prédire une faible survie spécifique à une cause (CSS) du cancer rectal. Pour éliminer l’effet de la positivité des ganglions lymphatiques sur notre recherche, nous avons ensuite exclu les patients positifs aux ganglions et concentré l’analyse sur les patients de stade I–II.
Patients et méthodes
Sélection des patients dans la Base de données sur la surveillance, l’épidémiologie et les résultats finaux
En tant que source d’informations faisant autorité sur l’incidence et la survie du cancer aux États-Unis et source complète d’informations sur la population, y compris tous les nouveaux cas de cancer diagnostiqués dans les zones participantes à la Surveillance, à l’épidémiologie et aux résultats finaux (SEER), la base de données SEER englobe environ 28% de la population américaine. La base de données SEER ne contenait aucun identifiant et était accessible au public pour les chercheurs. SEER * Stat est un logiciel fourni par le programme SEER pour obtenir des informations sur les patients en utilisant un accès en ligne. Au début, la session de liste des cas du logiciel SEER* Stat (SEER * Stat 8.3.5) a été utilisée pour répertorier toutes les informations relatives au patient, et les patients diagnostiqués d’un cancer du rectum de stade I à II (nœud négatif) entre le 1er janvier 2004 et le 31 décembre 2015 ont été identifiés à partir de la base de données SEER (figure 1). Les patients atteints d’un cancer rectal ont été identifiés par les codes de site C199 et C209 de la CIM-O-3 et le code de comportement 3 (articles 522 et 523 de la NAACCR) (9). Nous avons choisi d’inclure ces années car les informations sur l’ACE sérique préopératoire ont été enregistrées à partir de 2004 et le suivi du SEER s’est terminé en 2015.

Figure 1. Organigramme des définitions des cohortes de patients.
Ensuite, ceux qui ont reçu une radiothérapie néoadjuvante, une absence de confirmation histologique positive, avec une race inconnue, des histologies non adénocarcinomiques ou un suivi non actif ont été exclus de notre étude. Les patients présentant un taux sérique d’ACE préopératoire disponible ont été inclus dans notre étude et nous avons regroupé “positif / élevé” et “négatif / normal; dans les limites normales” comme C1 et C0 (informations sur le stade C). Les valeurs limites de l’ACE étaient de 2,5 ng/ml pour les non-fumeurs et de 5 ng/ml pour les fumeurs, respectivement. De plus, les variables clinicopathologiques des patients suivantes ont également été extraites de la base de données SEER: stade T, race, sexe, localisation de la tumeur, âge au moment du diagnostic, année du diagnostic, grade et histologie.
Analyse statistique
Dans la présente étude, le test du chi carré de Pearson a été utilisé pour comparer toutes les variables clinicopathologiques des patients extraites de la base de données SEER entre les taux sériques normaux et élevés de CEA préopératoire. Certains modèles multivariables de risque proportionnel de Cox ont été construits pour identifier des variables pronostiques indépendantes du cancer rectal dans nos analyses. Les courbes de survie ont été générées à l’aide de la méthode de Kaplan–Meier, et les différences entre les courbes ont été analysées par un test de rang log. Les principaux résultats d’intérêt dans la présente étude étaient le CSS et la survie globale (OS). Le CSS a été calculé à partir de la date du diagnostic jusqu’à la date de décès spécifique au cancer. Les décès attribués au cancer rectal ont été traités comme des événements, et les décès d’autres causes ont été traités comme des observations censurées à la date du décès. Pour déterminer s’il y avait une interaction significative entre le niveau sérique préopératoire de CEA et le stade T dans la prédiction de CSS, nous avons également défini une variable d’interaction (stade T et niveau sérique de CEA). P < 0,05 recto-verso a été considéré comme statistiquement significatif. Les analyses statistiques ont été principalement effectuées à l’aide de la version 22 du SPSS (IBM Corporation, Armonk, NY, USA).
Résultats
Caractéristiques du patient
Dans l’ensemble, 19 184 patients atteints d’un cancer du rectum de stade I à II ont été identifiés à partir de la base de données SEER entre le 1er janvier 2004 et le 31 décembre 2015 (Figure 1). Parmi ces patients, 13 007 (67,8%) patients ont été affectés au stade C0 et 6 177 (32,2%) patients ont été affectés au stade C1. Le système de stadification AJCC a suggéré que 6 077 patients étaient au stade T1, 4 783 patients au stade T2, 7 021 au stade T3 et 1 303 au stade T4. Au total, 2 560 patients (13,3%) sont décédés d’un cancer du rectum à la fin de la période de suivi. La période médiane de suivi de l’ensemble de la cohorte était de 44 mois (0 à 143 mois). Les caractéristiques initiales des patients sont résumées dans le tableau 1.
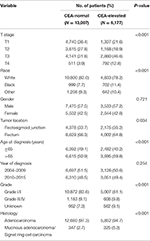
Tableau 1. Comparaison des caractéristiques de base du cancer rectal de stade I-II par le taux sérique d’antigène carcinoembryonique (ACE).
Risque accru de stade T1 par rapport aux Autres Stades T dans le contexte de l’élévation sérique de l’AEC
Il a été constaté que le stade C1 était plus susceptible d’être en corrélation avec un stade T plus élevé, une jonction noire, rectosigmoïde, un âge plus avancé, un grade plus élevé et un adénocarcinome mucineux / carcinome à cellules chevalières (tableau 1, P < 0,05). Comme le montre le tableau 2, la race, le sexe, l’emplacement de la tumeur, l’âge au moment du diagnostic, l’année du diagnostic, le grade, l’histologie, le stade T et le taux sérique d’ACE ont été inclus dans l’analyse multivariée de Cox. Lorsque l’analyse multivariée de Cox a été réalisée, nous avons convaincu les caractéristiques clinicopathologiques suivantes en tant que facteurs pronostiques indépendants du cancer rectal de stade I–II; ceux-ci comprenaient la race, le sexe, la localisation de la tumeur, l’âge au diagnostic, le grade tumoral, le stade T et le taux sérique de CEA, tandis que le risque entre T2, C0 et T1, C0 n’était pas une différence statistique (P = 0,925). Il a été montré que, dans le contexte de l’élévation de l’ACE sérique, le stade T1 présentait un risque inattendu plus élevé de mortalité spécifique au cancer rectal par rapport aux stades T2 et T3. Au stade T1 de la maladie, un taux élevé d’ACE sérique était associé à un risque accru de mortalité de 227,6 % par rapport au taux normal d’ACE sérique.

Tableau 2. Analyses de régression multivariée de Cox de la survie spécifique à la cause (CSS) dans le cancer rectal de stade I–II.
Les courbes de survie de Kaplan–Meier sont tracées dans les figures 2, 3. Le taux de CSS à 5 ans était de 92,2 % dans le T1C0, 75,2 % dans le T1C1, 93,1 % dans le T2C0, 86,7 % dans le T2C1, 84,6 % dans le T3C0, 76,3 % dans le T3C1, 62,9 % dans le T4C0 et 43,6 % dans le T4C1 (figure 2, P < 0,001). Par conséquent, T1C1 présentait un taux de CSS sur 5 ans similaire à T3C1 (75,2 contre 76,3 %, P = 0,238). De plus, la conclusion était encore plus prononcée dans OS. Le taux d’OS à 5 ans était de 78,6 % dans le T1C0, 48,3 % dans le T1C1, 77,1 % dans le T2C0, 62,3 % dans le T2C1, 68,5 % dans le T3C0, 54,5 % dans le T3C1, 45,3 % dans le T4C0 et 30,0 % dans le T4C1 (Figure 3, P < 0,001). T1C1 présentait un taux de CSS à 5 ans significativement plus faible que T3C1 (48,3 contre 54,5 %, P < 0,001).
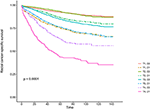
Figure 2. Courbes de survie spécifique à la cause (CSS) de Kaplan-Meier du stade T combinées au taux sérique d’antigène carcinoembryonique (CEA).
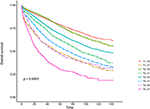
Figure 3. Courbes de survie globale (OS) de Kaplan–Meier du stade T combinées au taux sérique d’antigène carcinoembryonique (CEA).
Effet de l’élévation sérique préopératoire de l’ACE au stade T
La parcelle forestière a été dessinée pour montrer les rapports de risque (HRs) afin de comparer les CSS entre les groupes d’ACE normaux et élevés aux stades T respectifs (Figure 4). Par rapport au taux normal d’ACE sérique, au stade T2, un taux élevé d’ACE sérique était associé à un risque accru de mortalité spécifique au cancer rectal de 69,0%; au stade T3, un taux élevé d’ACE sérique était associé à un risque accru de mortalité spécifique au cancer rectal de 67,2% (HR = 1,672, IC à 95% = 1,486-1,882, P < 0,001); au stade T4, un taux élevé d’ACE sérique était associé à une augmentation de 81,3% risque de mortalité spécifique au cancer rectal (HR = 1,813, IC à 95% = 1,485-2,213, P < 0,001); en revanche, au stade T1, un taux élevé d’ACE sérique se présentait même jusqu’à 211.augmentation de 6% du risque de mortalité spécifique au cancer rectal (HR = 3,116, IC à 95% = 2,639-3,679, P < 0,001).
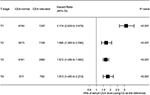
Figure 4. Rapports de risque (HRs) de survie spécifique à la cause (CSS) entre le niveau normal et élevé d’antigène carcinoembryonique sérique (CEA) selon le stade T.
Discussion
Nous avons cherché à étudier l’association du stade T et des taux sériques de CEA dans la détermination du CSS du cancer du rectum. Nous avons émis l’hypothèse que le cancer du rectum avec un stade T très précoce (stade T1) et une élévation de la CEA sérique pourrait être un substitut biologique pour une maladie agressive, prédisant ainsi un mauvais résultat oncologique. Avec ~ 20 000 patients diagnostiqués d’un cancer du rectum de stade I-II inclus dans notre étude.
Dans cette étude, il a été constaté que l’élévation du CEA sérique était plus susceptible d’être corrélée avec un stade T plus élevé, une jonction rectosigmoïde noire, un âge plus avancé et un adénocarcinome/ carcinome à cellules chevron mucineux de grade supérieur. Les analyses de survie de Kaplan-Meier ont montré que, dans le contexte de l’élévation sérique du CEA, le taux de CSS à 5 ans du stade T1 était de 75,2%, ce qui n’a pas permis d’obtenir de différence statistique par rapport au stade T3 (76,3%). En ce qui concerne la survie globale, le taux d’OS à 5 ans du stade T1 avec élévation sérique préopératoire de l’ACE (48,3%) était encore inférieur au stade T3 impliqué dans l’élévation de l’ACE (54,5%) et n’a pas atteint de différence statistique par rapport au stade T4 (45.3%), ce qui signifie qu’un taux sérique préopératoire élevé d’ACE pourrait identifier un sous-groupe de cancers rectaux de stade T1 présentant un CSS similaire par rapport à certaines maladies de stade T3 et un OS similaire par rapport à certaines maladies de stade T4.
Après ajustement des facteurs pronostiques connus du cancer du rectum (race, sexe, localisation de la tumeur, âge au diagnostic, année du diagnostic, grade et histologie), la variable d’interaction (stade T et taux sérique d’ACE) que nous avons définie s’est avérée être un facteur pronostique indépendant du cancer du rectum. L’analyse multivariée de Cox a montré que, dans le contexte de l’élévation de l’ACE sérique, le stade T1 présentait un risque inattendu plus élevé de mortalité spécifique au cancer rectal par rapport aux stades T2 et T3. Au stade T1 de la maladie, un taux élevé d’ACE sérique était associé à un risque accru de mortalité de 227,6 % par rapport au taux normal d’ACE sérique. De plus, la race, le sexe, l’emplacement de la tumeur, l’âge au moment du diagnostic et le grade de la tumeur ont également été identifiés comme des facteurs pronostiques indépendants du cancer rectal de stade I–II. En dehors de la T1, il a été constaté que l’élévation sérique préopératoire de l’ACE présentait des risques de mortalité spécifique au cancer rectal d’environ 75% au stade T respectif, mais le nombre a considérablement augmenté pour atteindre 211,6% au stade T1.
En 2000, le Groupe de travail colorectal de l’AJCC a proposé l’inclusion du taux sérique de CEA (stade C) dans le système de stadification TNM classique de l’AJCC du cancer colorectal (18). De plus, l’American Society of Clinical Oncology et le Groupe européen sur les marqueurs tumoraux ont tous deux soutenu l’inclusion du taux sérique préopératoire de CEA comme outil pronostique dans le cancer colorectal (19-21).
Plusieurs recherches antérieures ont rapporté que le taux sérique d’ACE jouait un rôle pronostique important dans le cancer du côlon (4-7, 22-26). En 2011, Thirunavukarasu et coll. (25) ont rapporté que le taux sérique d’ACE préopératoire était un biomarqueur pronostique indépendant du cancer du côlon, et que le pronostic était pire chez les patients atteints d’ACE élevée avec un stade inférieur par rapport aux patients atteints d’ACE faible avec un stade supérieur. Dans cette étude, une CEA élevée a même été jugée aussi forte que la positivité des nœuds pour prédire les mauvais résultats oncologiques du cancer du côlon.
Pourtant, peu d’études se concentrent sur l’élucidation du rôle pronostique du taux sérique d’ACE dans le cancer du rectum. En 2016, en utilisant également la base de données SEER, Tarantino et al. (9, 27) ont mené les deux grandes enquêtes basées sur la population, qui ont fourni des preuves convaincantes selon lesquelles un niveau élevé de CEA sérique préopératoire était un puissant prédicteur d’une survie globale et spécifique au cancer dans le cancer rectal. En 2018, Liu et coll. (8) a démontré que l’ACE sérique préopératoire était un facteur pronostique indépendant du cancer du rectum, et qu’un taux d’ACE sérique élevé présentait une survie manifestement moins bonne que le taux d’ACE sérique normal aux stades I à IV. Cependant, les deux seules études précédentes axées sur l’étude du rôle pronostique du taux d’ACE sérique préopératoire n’ont pas examiné l’association du niveau d’ACE et du stade T dans la prédiction des résultats tumoraux du cancer du rectum.
Bien que les études conventionnelles montrent que le cancer acquiert le potentiel métastatique étape par étape à mesure qu’il atteint une taille importante (28), certaines études antérieures ont cependant indiqué que l’acquisition du potentiel métastatique pouvait se produire très tôt dans la progression tumorale. Une recherche antérieure a démontré la survie extrêmement médiocre d’une tumeur de très petite taille lorsqu’elle est impliquée dans la positivité des ganglions lymphatiques (17). De plus, les résultats de nos recherches montrent que l’élévation du taux sérique préopératoire de CEA au stade très précoce (stade T1) du cancer du rectum est associée à de très mauvais OS et CSS et peut être un substitut de la biologie agressive. Nous pensons que l’atteinte des ganglions lymphatiques et l’élévation du CEA sérique sont considérées comme l’acquisition d’une capacité métastatique. Notre étude, combinée à celle de Wo et al. soutenir systématiquement l’idée susmentionnée selon laquelle l’acquisition d’un potentiel métastatique pourrait se produire très tôt dans la progression tumorale, donc associée à de mauvais résultats oncologiques, et la caractéristique biologique initiale est plus susceptible de déterminer le potentiel de métastases à distance pendant la progression du cancer, plutôt que la capacité métastatique accumulée (29).
De plus, les résultats de notre étude ont une signification clinique. Actuellement, le cancer rectal de stade I est traité par résection chirurgicale radicale seule en raison de résultats oncologiques relativement favorables. Cependant, environ 10 à 15% des patients développeront une récidive tumorale après résection radicale (30, 31). Dans la présente étude, il nous arrive d’identifier un sous-groupe de cancer du rectum de stade T1 avec un très mauvais pronostic par rapport au reste du cancer du rectum de stade I, ce qui signifie que les cancers du rectum de stade T1 avec atteinte d’une élévation sérique préopératoire de l’ACE devraient attirer davantage l’attention des oncologues.
Cependant, notre étude présente deux limites. D’une part, cette étude n’a pas inclus certains facteurs pronostiques connus du cancer rectal dans nos analyses, y compris l’état d’instabilité des microsatellites et les complications postopératoires, qui n’étaient pas disponibles dans la base de données SEER et pourraient introduire des biais dans une certaine mesure. Nous ne pouvons pas fournir de plages et de valeurs moyennes de l’ACE dans les deux groupes. D’autre part, la présente étude était rétrospective plutôt que basée sur des données prospectives. Par conséquent, nos résultats doivent encore être validés dans d’autres cohortes, en particulier dans de grandes études cliniques prospectives.
En conclusion, notre étude démontre que le cancer du rectum de stade T1, lorsqu’il est impliqué dans une élévation sérique préopératoire de l’AEC, peut être un substitut d’une maladie biologiquement agressive et être en corrélation avec un OS et un CSS défavorables. De plus, ce sous-groupe de cancer du rectum mérite une plus grande attention clinique des oncologues. Nos résultats, s’ils étaient validés dans de futures études de base de données, fourniraient une nouvelle idée de thérapie pour le cancer rectal à un stade précoce.
Déclaration de disponibilité des données
Les ensembles de données générés pour cette étude sont disponibles sur demande auprès de l’auteur correspondant.
Énoncé d’éthique
Les patients de cette étude ont été identifiés à partir de la base de données du SEER et l’approbation de l’utilisation des données a été obtenue grâce à une demande soumise au programme SEER. L’approbation du conseil d’examen institutionnel n’était pas nécessaire car la base de données SEER est accessible au public.
Contributions des auteurs
SW et WG ont apporté une contribution substantielle et directe à cette étude et l’ont approuvée pour soumission.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Ce travail a été soutenu en partie par le Projet de Plan de développement des Sciences et Technologies Médicales de Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Statistiques mondiales du cancer 2018: Estimations GLOBOCAN de l’incidence et de la mortalité dans le monde pour 36 cancers dans 185 pays. CA Cancer J Clin. (2018) 68:394–424. doi: 10.3322/caac.21492
Résumé PubMed / Texte intégral CrossRef / Google Scholar
2. Or P, Affranchi DONC. Demonstration of tumor-specific antigens in human coonic carcinomata by immunological tolerance and absorption techniques. J Exp Med. (1965) 121:439–62. doi: 10.1084/jem.121.3.439
Résumé PubMed / Texte intégral CrossRef / Google Scholar
3. Il s’agit d’une pièce de théâtre. Antigène carcinoembryonique dans la stadification et le suivi des patients atteints d’un cancer colorectal. Investir dans le cancer. (2005) 23:338–51. doi: 10.1081 /CNV-58878
Résumé PubMed / Texte intégral Croisé / Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, González MG, Hensley BJ, et al. Evaluating the prognostic role of elevated preoperative carcinoembryonic antigen levels in colon cancer patients: results from the national cancer database. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245/s10434-015-5014-1
Résumé PubMed / Texte intégral CrossRef / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, et al. Un taux d’antigène carcino-embrionique sérique préopératoire élevé peut être un indicateur efficace de la nécessité d’une chimiothérapie adjuvante après une résection potentiellement curative du cancer du côlon de stade II. J Surg Oncol. (2010) 99:65–70. doi: 10.1002/jso.21161
Résumé PubMed / Texte intégral CrossRef / Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Identification des patients atteints d’un cancer du côlon de stade II à haut risque pour un traitement adjuvant. C’est le Rectum du Côlon. (2008) 51:503–7. doi: 10.1007 / l10350-008-9246- z
Résumé PubMed / Texte intégral Croisé / Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. L’incorporation de CEA améliore la stratification du risque dans le cancer du côlon de stade II. J Gastrointest Surg. (2017) 21:770-7. doi: 10.1007/s11605-017-3391-4
Résumé PubMed / Texte intégral CrossRef / Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Combinaison de l’antigène carcinoembryonique avec le système de stadification TNM du Comité mixte américain sur le cancer dans le cancer rectal: une étude réelle et à grande échelle. Onco Cible Ther. (2018) 11:5827–34. doi: 10.2147/OTT.S171433
Résumé PubMed / Texte intégral Croisé / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, Güller U, Mieth M, Cerny T, et al. Valeur prédictive de l’ACE pour la survie dans le cancer rectal de stade I: une analyse de score de propension basée sur la population. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Oncogène. (2013) 32:849–60. doi: 10.1038/onc.2012.112
Résumé PubMed / Texte intégral CrossRef / Google Scholar
12. Cai Z, Xiao J, He X, Ke J, Zou Y, Chen Y, et al. Accéder à une nouvelle signification pronostique de l’antigène carcinoembryonique préopératoire dans le cancer colorectal recevant une résection tumorale: plus que positif et négatif. Biomark du cancer. (2017) 19:161–8. doi: 10.3233/CBM-160287
Résumé PubMed | Texte intégral Croisé / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, Fürstenberger G, Richter R, et al. Le processus de métastase pour le cancer du sein. Eur J Cancer. (2003) 39:1794–806. doi: 10.1016/S0959-8049(03)00422-2
Résumé PubMed / Texte intégral CrossRef / Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. La propagation systémique est une étape précoce du cancer du sein. Cellule cancéreuse. (2008) 13:58–68. doi: 10.1016/j.ccr.2007.12.003
Résumé PubMed / Texte intégral CrossRef / Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Ensemencement et propagation de cellules mammaires de souris non transformées dans le poumon. Sciences. (2008) 321:1841–4. doi: 10.1126 / science.1161621
Résumé PubMed / Texte intégral Croisé / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. Des cellules disséminées latentes aux métastases manifestes: analyse génétique de la progression systémique du cancer du sein. Proc Natl Acad Sci États-Unis. (2003) 100:7737–42. doi: 10.1073/pnas.1331931100
Résumé PubMed / Texte intégral Croisé / Google Scholar
17. ADJ JY, Chen K, Neville BA, Lin NU, Punglia RS. Effect of very small tumor size on cancer-specific mortality in node-positive breast cancer. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j. breastdis.2012.01.026
CrossRef Texte intégral / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. Conférence de consensus du comité mixte américain sur les facteurs pronostiques du cancer: groupe de travail colorectal. Cancer. (2015) 88:1739–57. doi: 10.1002 / (SICI)1097-0142(20000401)88:7<1739:: AIDE – CNCR30 >3.0.CO;2-T
Résumé PubMed / Texte intégral Croisé / Google Scholar
19. Il s’agit de l’un des plus grands groupes de la planète. Marqueurs tumoraux dans le cancer colorectal : Directives d’utilisation clinique du Groupe Européen des marqueurs tumoraux (EGTM). Eur J Cancer. (2007) 43:1348–60. doi: 10.1016/ j.ejca.2007.03.021
Résumé PubMed / Texte intégral CrossRef / Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS et coll. ASCO 2006 mise à jour des recommandations pour l’utilisation de marqueurs tumoraux dans le cancer gastro-intestinal. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200/JCO.2006.08.2644
Résumé PubMed / Texte intégral CrossRef / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, et al. Marqueurs tumoraux dans le cancer colorectal, le cancer gastrique et les cancers stromaux gastro-intestinaux: Mise à jour des lignes directrices 2014 du groupe européen sur les marqueurs tumoraux. Cancer Int J. (2014) 134:2513–22. doi: 10.1002 / cmi.28384
Résumé PubMed / Texte intégral CrossRef / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. L’antigène carcinoembryonique préopératoire prédit les résultats chez les patients atteints d’un cancer du côlon nodal négatif: une analyse multivariée de 572 patients. J Am Coll Surg. (1997) 185:55-9. doi: 10.1016/S1072-7515(97)00012-4
Résumé PubMed / Texte intégral CrossRef / Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Niveau d’antigène carcinoembryonique préopératoire en tant que facteur pronostique indépendant dans le cancer du côlon potentiellement curatif. J Surg Oncol. (2010) 101:396–400. doi: 10.1002/jso.21495
Résumé PubMed / Texte intégral CrossRef / Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata A, Nakagawa Y, Fujita S, et al. Incorporation des niveaux sériques d’antigènes carcinoembryoniques dans le système de regroupement pronostique du cancer du côlon. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007/s00384-017-2772-1
Résumé PubMed / Texte intégral CrossRef / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. Stade C du cancer du côlon: implications du biomarqueur d’antigène carcinoembryonique dans la stadification, le pronostic et la prise en charge. J Natl Cancer Inst. (2011) 103:689–97. doi: 10.1093/jnci/djr078
Résumé PubMed / Texte intégral Croisé / Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. Évaluation de la valeur pronostique des niveaux d’antigènes carcinoembryoniques dans le cancer du côlon de stade I et II. Eur J Cancer. (2018) 94:1–5. doi: 10.1016/ j.ejca.2018.01.112
Résumé PubMed / Texte intégral CrossRef / Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, Köberle D, Schmied BM, et al. Une CEA préopératoire élevée est associée à une survie plus mauvaise chez les patients atteints de cancer rectal de stade I-III. Frère J Cancer. (2012) 107:266. doi: 10.1038/ bjc.2012.267
Résumé PubMed / Texte intégral CrossRef / Google Scholar
28. Norton L, Massague J. Le cancer est-il une maladie d’auto-ensemencement? Nat Med. (2006) 12:875–8. doi: 10.1038/ nm0806-875
Résumé PubMed / Texte intégral Croisé / Google Scholar
29. Yu KD, Jiang YZ, Chen S, Cao ZG, Wu J, Shen ZZ, et al. Effect of large tumor size on cancer-specific mortality in node-negative breast cancer. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016/j. mayocp.2012.07.023
Résumé PubMed / Texte intégral CrossRef / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Cancer rectal de stade I: identification des patients à haut risque. J Am Coll Surg. (1998) 186:574-9; discussion: 579-80. doi: 10.1016/S1072-7515(98)00018-0
Résumé PubMed / Texte intégral Croisé / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O’Connell MJ, Begovic M, et al. Impact du stade T et N et du traitement sur la survie et la rechute dans le cancer rectal adjuvant: une analyse groupée. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200/JCO.2004.08.173
Résumé PubMed / Texte intégral croisé / Google Scholar