Frontières en neurologie
- Introduction
- Méthodes
- Sujets
- Études sur la conduction nerveuse
- Échographie
- Statistiques
- Résultats
- Caractéristiques cliniques
- Section transversale (CSA)
- Corrélation entre maxCSA et le score de somme du Medical Research Council (MRC)
- Corrélation de CSA et de CB
- Discussion
- Limites
- Déclaration de disponibilité des données
- Déclaration d’éthique
- Contributions des auteurs
- Conflit d’intérêts
- Remerciements
- Matériel supplémentaire
- Abréviations
Introduction
La neuropathie motrice multifocale (MMN) a été décrite pour la première fois en 1988 (1) comme une neuropathie purement motrice affectant plusieurs nerfs moteurs avec bloc de conduction (CB). Le CB moteur est la marque électrophysiologique de base pour le diagnostic du MMN. L’échographie nerveuse peut fournir les caractéristiques morphologiques des nerfs périphériques. L’hypertrophie multifocale des nerfs périphériques ou des racines cervicales dans les sections transversales nerveuses (CSAS) a été rapportée dans le MMN (2-4). Kerasnoudis et al. (5) ont signalé une corrélation entre les potentiels d’action motrice composés (CMAP) et les ASC du nerf médian dans le haut du bras (r = 0,851, p < 0,001). Beekman et coll. (6) ont constaté que les études échographiques montraient une CSA nerveuse accrue compatible avec des anomalies de conduction plus que prévu pour des raisons purement cliniques. De plus, certains sites présentaient une hypertrophie nerveuse sans CB. Les CBS multifocaux ont été distribués le long du nerf en MMN; cependant, ces études n’ont mesuré que quelques sites prédéterminés, fournissant des informations morphologiques limitées. Dans cette étude, l’utilisation d’un balayage consécutif le long du nerf et la mesure de la CSA sur plusieurs sites basés sur des ultrasons ont permis une corrélation plus précise entre le bloc de conduction et l’augmentation de la CSA dans le MMN.
Méthodes
Sujets
Entre décembre 2014 et mai 2018, 12 patients MMN ont été recrutés consécutivement à l’Hôpital du Collège médical de l’Union de Pékin selon les critères proposés par l’AANEM (7). Un même nombre de témoins sains (HC), appariés selon l’âge (± 1 an), ont été inscrits comme témoins. Tous les patients et les témoins sains ont subi un examen clinique standardisé comprenant des tests de force musculaire du poignet, de la flexion du pouce et des doigts, de l’opponens pollicis, de l’abducteur pollicis brevis, de l’étalement des doigts et de l’adducteur pollicis, ainsi que des tests sensoriels. Des examens cliniques, un électromyogramme et des études échographiques nerveuses ont été effectués le même jour. Le comité d’éthique du Peking Union Medical College Hospital a approuvé notre protocole d’étude et tous les patients ont signé un formulaire de consentement éclairé conformément à la Déclaration d’Helsinki.
Études sur la conduction nerveuse
Des études sur la conduction nerveuse motrice (NCSS) ont été réalisées sur tous les sujets des nerfs médian et ulnaire bilatéraux avec stimulation nerveuse supramaximale percutanée tout en enregistrant des CMAP avec des électrodes à disque de 10 mm. Les segments standard ont été définis comme du poignet au coude et du coude à l’aisselle pour le nerf médian, et comme du poignet au dessous du coude et du haut du coude à l’aisselle pour le nerf ulnaire. Une technique d’inching (stimulation le long du cours du nerf par incréments de 2 cm) a été réalisée sur certains segments standard avec un bloc de conduction partiel, détectant le site exact de CB, ainsi qu’un test échographique consécutif sur le même segment. Le diagnostic CB des segments standard et la technique d’inching ont été réalisés selon des critères suggérés par l’AANEM (7). Pour n’inclure que le vrai bloc de conduction, la CMAP distale devait être de 1 mV. La température ambiante a été maintenue pour s’assurer que la température de la peau reste à > 31 ° C. Les techniciens ont été aveuglés par les informations du patient.
Échographie
Des tests échographiques ont été effectués par traçage nerveux du poignet à l’aisselle sur les nerfs médian et ulnaire bilatéraux avec un transducteur à réseau linéaire de 10 MHz (GE LOGIQ e, États-Unis). Afin d’éliminer l’augmentation artificielle de la taille des nerfs, l’utilisation du grossissement du zoom n’a pas été autorisée pour ces mesures. Les réglages initiaux ont été maintenus constants pendant tous les examens, y compris les profondeurs. Le transducteur a été maintenu perpendiculaire au nerf à un angle choisi pour obtenir l’image la plus petite et la plus brillante. Les CSAs aux sites prédéterminés de chaque nerf ont été mesurés en traçant juste à l’intérieur du bord hyperéchoïque du nerf. Dix sites prédéterminés ont été mesurés sur chaque nerf selon un rapport précédent de notre laboratoire (8). Pour le nerf médian, les 10 sites comprenaient la sortie du canal carpien (M1), le point médian du pli du poignet (M2), l’entrée du canal carpien (M3), 4 cm proximal du pli du poignet (M4), le milieu entre le pli du poignet et le coude (M5), l’entrée dans les teres pronateurs (M6), le coude (M7), 4 cm au-dessus du coude (M8), 8 cm au-dessus du coude (M9) et l’aisselle (M10). Pour le nerf cubital, les 10 sites comprenaient le poignet (U1), 4 cm proximal au poignet (U2), le point de départ de l’artère ulnaire (U3), le long du ventre musculaire du fléchisseur carpi ulnaris (U4), la sortie du tunnel cubital (U5), à l’intérieur du tunnel cubital (U6), l’entrée du tunnel cubital (U7), 4 cm proximal à l’entrée du tunnel cubital (U8), 8 cm proximal à l’entrée du tunnel cubital (U6). U9), et l’aisselle (U10). À l’exception des sites susmentionnés, des mesures ont également été effectuées sur d’autres sites d’élargissement. L’élargissement CSA a été référencé aux valeurs normatives de notre laboratoire (dans le nerf médian, les segments avant-bras-coude étaient ≤ 10 mm2 et les segments coude-aisselle étaient ≤ 9 mm2; dans le nerf ulnaire, les segments avant-bras et bras étaient ≤ 6 mm2). Après la mesure CSA, le nerf a de nouveau été tracé en continu et enregistré à fond. Les neuropathies compressives courantes entraînant une hypertrophie nerveuse avaient été exclues de l’étude. Les échographes ont été aveuglés par les informations du patient.
Statistiques
Les CSAS de MMN ont montré une distribution non normale. Le test U de Mann-Whitney a été utilisé pour comparer le MMN et les témoins sains, ainsi que la différence de CSAs maximales entre les segments avec CB et ceux sans CB. La CSA maximale a été définie comme la CSA maximale dans le segment standard. Pour tous les tests, une valeur P bilatérale < 0,05 a été considérée comme statistiquement significative.
Résultats
Caractéristiques cliniques
Huit hommes et 4 femmes ayant un âge moyen de 43,7 ans (intervalle 21-62, écart-type 13,2), 12 témoins sains (âge moyen 43,6, intervalle 28-57, écart-type 13,3, 8 hommes) ont été inclus dans cette étude. La durée moyenne de la maladie était de 65 ans.3 (24-108) mois. La taille moyenne était de 168 (155-186) cm et le poids moyen était de 65,4 (56,5– 88) kg. Tous les patients étaient naïfs de traitement.
Section transversale (CSA)
Les valeurs CSA pour les nerfs médian et ulnaire en MMN et HC aux 10 sites sont indiquées dans le tableau 1 et dans la figure 1. Les élargissements de l’ASC étaient multifocaux comparativement aux témoins sains. Dans les nerfs médians, les valeurs de CSA plus élevées étaient principalement réparties dans le segment de l’avant-bras et le segment supérieur du bras. Les sites sous le coude et le segment supérieur du bras des nerfs ulnaires ont montré une hypertrophie CSA plus évidente. Fait intéressant, les sites communs de compression nerveuse, tels que le canal carpien et le tunnel cubital, n’ont pas révélé d’augmentation de la CSA chez les patients atteints de NMM comparativement aux témoins sains.

Tableau 1. CSA à différents sites des nerfs médians et ulnaires dans MMN et HC.

Figure 1. La distribution de 10 sites CSA dans les nerfs médian et ulnaire. La ligne de 10 mm2 a été établie pour distinguer les anomalies significatives des sites CSA des autres segments. (A) Pour le nerf médian: M1 – la sortie du cannelure du carpelle, M2 – le point médian du pli du poignet, M3 – l’entrée du cannelure du carpelle, M4 – 4 cm proximal du pli du poignet, M5 – le point médian entre le pli du poignet et le coude, M6 – l’entrée dans les teres du pronateur, M7 – le coude, M8 – 4 cm au-dessus du coude, M9 – 8 cm au-dessus du coude, M10 – l’aisselle. (B) Pour le nerf cubital: U1 – le poignet, U2 – 4 cm au-dessus du poignet, U3 – point de départ de l’artère cubitale, U4 – le long du ventre musculaire du fléchisseur carpi ulnaris, U5 – la sortie du tunnel cubital, U6 – à l’intérieur du tunnel cubital, U7 – l’entrée du tunnel cubital, U8 – 4 cm proximal à l’entrée du tunnel cubital, U9 – 8 cm proximal à l’entrée du tunnel cubital, U10 – aisselle. CSA, section transversale; MMN, neuropathie motrice multifocale.
Corrélation entre maxCSA et le score de somme du Medical Research Council (MRC)
Chez les 12 patients MMN, au total 23 nerfs médians et 23 nerfs ulnaires avaient été inclus parce qu’un des patients MMN avait été amputé pour blessure au travail. La tendance entre le CSA nerveux maximal d’un nerf et la force musculaire correspondante est divisée en deux types suivants (Figure 2): (1) CSA augmenté et MRC diminué. (2) L’ASC a augmenté et le MRC n’a montré aucun changement évident.
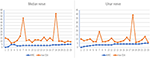
Figure 2. La corrélation entre le nerf maxCSA et le MRC. La tendance entre la section transversale nerveuse maximale (CSA) d’un nerf et la force musculaire correspondante. L’abscisse indique 23 nerfs bilatéraux chez 12 patients, dont l’un n’a pas pu enregistrer le nerf latéral en raison d’une amputation; l’ordonnée représente la section transversale nerveuse (mm2) ou l’indice de force musculaire. MRC, Score de somme du Conseil de recherches médicales; maxCSA, section transversale maximale d’un certain nerf.
Corrélation de CSA et de CB
Avec les NCSs moteurs, 12 zones CB définies et 12 zones CB probables ont été détectées sur les segments standard des nerfs médians et ulnaires. Avec des études échographiques, une CSA accrue a été détectée à 36 sites, éliminant les segments susceptibles d’être pressés. Dans le nerf médian, la médiane (P25, P75) du CSA maximal d’un segment standard était de 10,3 (8-12) mm2 pour ceux sans CB et de 21,22 (8,5, 38) mm2 pour ceux avec CB (Z = 1,409, P = 0,159). Dans le nerf cubital, la médiane (P25, P75) du CSA maximal d’un segment nerveux standard était de 7,7 (5.8,7) mm2 pour ceux sans CB et 6,25 (5,8,25) mm2 pour ceux avec CB (Z = 0,744, P = 0,457).
Il y avait 9 segments standard avec CB et CSA accru (Figure 3, Vidéo 1), 15 segments avec CB mais CSA normal (Figure 4, Vidéo 2) et 27 segments avec CSA accru mais sans CB (Figure 5, Vidéo 3). La technique d’inching et le balayage consécutif aux ultrasons ont été effectués sur cinq segments dont les blocs de conduction n’étaient guère confirmés par la détection de segments standard avec un bloc de conduction partiel. En combinant les techniques d’inching et les ultrasons, deux autres segments ont montré un CBS et une CSA accrue aux mêmes sites, et 3 segments ont montré un CBS mais une CSA normale aux mêmes sites.
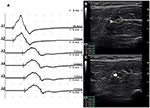
Figure 3. Mode 1. Un homme de 28 ans avec 4 ans de faiblesse asymétrique progressive des mains bilatérales. L’examen a révélé des muscles innervés du nerf ulnaire de la main (grade MRC 3 à droite, 4 à gauche). Une technique d’inching utilisée sur le segment de l’avant-bras gauche du nerf ulnaire a montré un bloc de conduction et une hypertrophie CSA au même site chez un patient atteint de NMM. (A) Un bloc de conduction a été détecté entre A1 (latence 4,9 ms, durée 8,2 ms, amplitude 14,8 mv, zone 38,2 mvms, vitesse de conduction 66,6 m / s) et A2 (latence 5,2 ms, durée 8,2 ms, amplitude 9,5 mv, zone 26,1 mvms, vitesse de conduction 11,6 m/ s). B) La pointe de flèche blanche indiquait que le CSA de A1 était de 8 mm2. (C) La flèche montre que le CSA de A2 était de 19 mm2 (A1, coude – 6 cm; A2, coude – 4 cm; A3, coude – 2 cm) (Vidéo 1). CSA, section transversale; CB, bloc de conduction; l, gauche; r, droite.
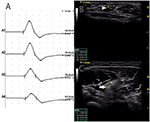
Figure 4. Mode 2. Une femme de 46 ans avec 11 ans de faiblesse asymétrique progressive des membres supérieurs bilatéraux, avec MRC du membre supérieur droit de grade 3 et du membre supérieur gauche 4, présentait un bloc de conduction et une CSA normale au même site. A) Des blocs de conduction ont été détectés entre A1 et A2. (B) La pointe de flèche blanche montrait 6 mm2 à A1 (Latence 2,8 ms, durée 3,8 ms, amplitude 12,4 mv, zone 13,3 mvms, vitesse de conduction 50,9 m/s) et (C) La flèche montrait 8 mm2 à A2 (Latence 6,8 ms, durée 3,9 ms, amplitude 8,2 mv, zone 7,7 mvms, vitesse de conduction 63 m/s) (A1, poignet; A2, coude) (Vidéo 2). CSA, section transversale; CB, bloc de conduction; l, gauche; r, droite.
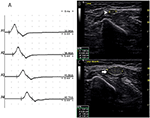
Figure 5. Mode 3. Une femme de 51 ans avec 4 ans de faiblesse du membre supérieur gauche et de grade MRC 4 a montré une hypertrophie CSA sans bloc de conduction correspondant. (A) Étude de conduction du nerf moteur du segment standard du nerf ulnaire gauche. Aucun CB n’a été détecté. L’étude par ultrasons nerveux sur le bras gauche du nerf ulnaire montre: (B) CSA (pointe de flèche blanche) qui était de 8 mm2 au site de A3 (latence 8,7 ms, durée 8,0 ms, amplitude 8,2 mv, zone 19,2 mvms, vitesse de conduction 48.6 m / s) et (C) CSA (flèche) du site 6 cm proximal au coude de l’ulnaire gauche qui était de 39 mm2 (latence 12,0 ms, durée 7,9 ms, amplitude 8,4 mv, aire 19,5 mvms, vitesse de conduction 18,2 m /s), mais aucun CB n’a été détecté sur le même segment (A1, poignet; A2, sous le coude; A3, au-dessus du coude; A4, aisselle) (Vidéo 3). CSA, section transversale; CB, bloc de conduction; l, gauche; r, droite.
Discussion
Les études électrophysiologiques reflètent les caractéristiques physiologiques d’un nerf, et les études échographiques révèlent les caractéristiques morphologiques d’un nerf. Le MMN est l’un des modèles idéaux pour explorer la corrélation entre le CB moteur et le CSA, pour lequel seul le nerf moteur est impliqué, et le CB est la principale caractéristique électrophysiologique. Bien que des études antérieures aient rapporté une corrélation entre CB et CSA (5, 6, 9), des sites limités ont été observés sans balayage continu nerveux sous échographie, et les lésions dans le MMN étaient distribuées de manière stochastique et pas toujours à des sites prédéterminés.
Dans cette étude, nous avons effectué un balayage consécutif le long de tout le nerf pour enregistrer le CSA à des sites anormaux. De plus, les CSAS ont été mesurées à 10 sites prédéterminés. La technique d’inching a été réalisée si nécessaire. Bien que la durée de la maladie chez ce groupe de patients atteints de MMN soit longue et variée, ce qui peut avoir affecté les caractéristiques ultrasonores et électrophysiologiques, nous avons tout de même trouvé trois modes de relations entre CSA et CB: CB avec élargissement correspondant du CSA nerveux (Mode 1), CB sans élargissement correspondant du CSA nerveux (Mode 2) et élargissement du CSA nerveux sans CB correspondant (Mode 3). Par conséquent, la CB n’est pas toujours corrélée à une CSA accrue.
Le mécanisme potentiel de ces différents modèles de corrélation entre CB et CSA n’est toujours pas clair. De plus, les véritables manifestations pathologiques correspondantes derrière l’élargissement nerveux n’ont pas été clairement révélées. L’élargissement hypoéchogène du nerf peut refléter une inflammation active et des bulbes d’oignon, tandis que l’élargissement du nerf avec des fascicules hyperéchogènes supplémentaires / tissu périfasciculaire peut refléter une dégénérescence axonale (10). C’est-à-dire que les lésions de la gaine axonale et de la gaine de myéline pourraient entraîner une hypertrophie du CSA nerveux (11). En ce qui concerne le mode 2, CB sans élargissement CSA correspondant peut être facilement compris. À l’heure actuelle, le MMN est considéré comme une neuropathie motrice immunomédiée, qui est liée à une atteinte des anticorps anti-GM1 aux canaux Na +-dépendants de la tension au niveau du nœud de Ranvier (12, 13). Théoriquement, les anticorps anti-GM1 déclenchent des dommages directs et dépendants du complément aux axones, conduisant à un bloc de conduction, alors qu’il peut n’y avoir aucune modification évidente de la myéline. Taylor et coll. a émis l’hypothèse que l’attaque d’anticorps pourrait être dirigée contre les composants de la myéline paranodale et a constaté que l’altération pathologique axonale MMN prédominait sur la pathologie de la myéline (14). De plus, nos résultats liés à la CSA et à la CB normales dans le MMN pourraient être une conséquence du fait que seuls les fascicules simples sont élargis, alors que le CSA du nerf principal n’est pas affecté (15).
En ce qui concerne le mode 1 (CB avec une CSA accrue), une CSA accrue dans le MMN a été rapportée dans des études d’imagerie par résonance magnétique (IRM) (16) et d’autres études échographiques (3). Notre constatation selon laquelle les patients atteints de NMM présentaient une hypertrophie du nerf CSA multifocal et un bloc de conduction au même site le long du nerf peut impliquer qu’au site de CB, il y avait non seulement des canaux Na +-fermés en tension endommagés, mais également certaines lésions, telles que la démyélinisation, l’œdème et la formation de bulbes d’oignon (6, 17). Ce mode indique que la CB peut être causée par différents mécanismes et que la MMN peut être un syndrome. Tous les cas de MMN ne sont pas causés par des anticorps anti-IgM GM1, et d’autres processus d’immunisation peuvent également être impliqués, entraînant des processus de démyélinisation / remyélinisation et de dégénérescence / régénération axonale.
Le mécanisme du mode 3 doit être exploré plus avant. Une hypertrophie du CSA nerveux sans CB dans le MMN, ou même des membres sans dysfonctionnement neurophysiologique, a également été trouvée dans d’autres rapports (6, 9, 18). Nous avons émis l’hypothèse que lorsque des infiltrats inflammatoires, un œdème et un dysfonctionnement des canaux se produisent au niveau des nœuds de Ranvier au stade précoce, le seuil de dépolarisation des canaux ioniques pourrait rester dans une plage normale, de sorte que le dysfonctionnement de la transmission du stimulus saltatoire n’a pas encore été atteint et qu’aucun CB ne peut être détecté. Chez les patients atteints de MMN, si une augmentation de la CSA est détectée sans CB, les modifications morphologiques du nerf doivent également avoir une signification clinique. Un balayage consécutif le long du nerf et des mesures sur un plus grand nombre de sites pour détecter les changements morphologiques pourraient augmenter la sensibilité diagnostique du MMN.
En conclusion, trois modèles de corrélations entre CB et CSA existaient, et les changements électrophysiologiques et morphologiques n’étaient pas toujours cohérents dans le MMN. Les études échographiques pourraient détecter plus de lésions le long du nerf en MMN, même sans CB. La combinaison de NCS moteurs et d’études échographiques pourrait fournir plus d’informations pour le diagnostic clinique du MMN.
Limites
Il s’agissait d’une étude transversale de comparaison d’un seul paramètre. Les différentes durées de la maladie des patients atteints de MMN dans cette étude, en plus de leurs hauteurs et de leurs poids variables, pourraient affecter la détection de la CSA nerveuse et de la vitesse de conduction nerveuse. De plus, nous avons seulement observé si le CB du nerf moteur se présentait et s’il y avait des changements connexes dans les CSAS lors d’une échographie; les mécanismes potentiels des différents modèles de corrélation entre le CB et le CSA nécessitent une étude plus approfondie. Seul le CSA nerveux, le paramètre le plus important, avait été inclus dans cette étude, donc afin d’effectuer des recherches plus précises, plus d’index comme l’intensité de l’écho, devraient être impliqués.
Déclaration de disponibilité des données
Toutes les données non publiées dans l’article sont disponibles et seront partagées sur demande de tout chercheur qualifié.
Déclaration d’éthique
Le comité d’éthique du Peking Union Medical College Hospital a approuvé notre protocole d’étude et tous les patients ont signé un formulaire de consentement éclairé conformément à la Déclaration d’Helsinki.
Contributions des auteurs
YL: études électrophysiologiques et ultrasonographiques, acquisition de données, analyse statistique et rédaction de manuscrits. JN : études électrophysiologiques et ultrasonographiques et analyses statistiques. LC: concept d’étude et conception et édition de manuscrits. TL : collecte de données et édition de manuscrits. QD: études électrophysiologiques et ultrasonographiques. SW et YG: études électrophysiologiques. ML: concept d’étude et conception, revue des données, édition de manuscrits et révision critique.
Conflit d’intérêts
ML a reçu le soutien du Beijing Capital Special Fund (Z171100001017220).
Les autres auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Nous remercions vivement le financement du Fonds spécial Beijing Capital (Z171100001017220).
Matériel supplémentaire
Le matériel supplémentaire pour cet article peut être trouvé en ligne à l’adresse suivante:: https://www.frontiersin.org/articles/10.3389/fneur.2019.01055/full#supplementary-material
Vidéo 1. Mode 1: Bloc de conduction et élargissement CSA au même site en MMN.
Vidéo 2. Mode 2: Bloc de conduction et CSA normal au même site en MMN.
Vidéo 3. Mode 3: Élargissement CSA sans bloc de conduction correspondant.
Abréviations
MMN, neuropathie motrice multifocale; CB, bloc de conduction nerveuse motrice; CSA, section transversale; NCS, études de conduction nerveuse motrice.
1. Parry GJ, Clarke S. Neuropathie démyélinisante acquise multifocale se faisant passer pour une maladie des motoneurones. Nerf musculaire. (1988) 11:103–7. doi: 10.1002/mus.880110203
Résumé PubMed / Texte intégral Croisé / Google Scholar
2. Grimm A, Rattay TW, Winter N, Axer H. Systèmes de notation par ultrasons du nerf périphérique: analyse comparative et analyse comparative. J Neurol. (2017) 264:243–53. doi: 10.1007/s00415-016-8305- y
Résumé PubMed / Texte intégral Croisé / Google Scholar
3. Il s’agit d’une espèce de poissons de la famille des cucurbitacées. Échographie nerveuse comme outil de suivi dans la neuropathie motrice multifocale traitée. Eur J Neurol. (2017) 24:1125–34. doi: 10.1111/ene.13344
Résumé PubMed / CrossRef Texte intégral / Google Scholar
4. Loewenbruck KF, Liesenberg J, Dittrich M, Schafer J, Patzner B, Trausch B, et al. Échographie nerveuse dans la différenciation de la neuropathie motrice multifocale (MMN) et de la sclérose latérale amyotrophique avec maladie du motoneurone inférieur prédominante (SLA / LMND). J Neurol. (2016) 263:35–44. doi: 10.1007/s00415-015-7927-9
Résumé PubMed / Texte intégral CrossRef / Google Scholar
5. Kerasnoudis A, Pitarokoili K, Behrendt V, Gold R, Yoon Neuropathie motrice multifocale MS.: corrélation des échographies nerveuses, des résultats électrophysiologiques et cliniques. J Périphérique Nerv Syst. (2014) 19:165–74. doi: 10.1111/jns5.12067
Résumé PubMed / Texte intégral Croisé / Google Scholar
6. Beekman R, van den Berg LH, Franssen H, Visser LH, van Asseldonk JT, Wokke JH. L’échographie montre des élargissements nerveux importants dans la neuropathie motrice multifocale. Neurologie. (2005) 65:305–7. doi: 10.1212/01.lno.0000169179.67764.30
Résumé PubMed / Texte intégral Croisé / Google Scholar
7. Olney RK, Lewis RA, Putnam TD, Campellone JV Jr. Critères de consensus pour le diagnostic de la neuropathie motrice multifocale. Nerf musculaire. (2003) 27:117–21. doi: 10.1002/mus.10317
Résumé PubMed / Texte intégral CrossRef / Google Scholar
8. Niu J, Cui L, Liu M. Échographie à plusieurs sites des nerfs périphériques pour différencier le type de dent de charcot-marie 1A de la polyradiculoneuropathie inflammatoire démyélinisante chronique. Neurol avant. (2017) 8:181. doi: 10.3389 / fneur.2017.00181
Résumé PubMed / Texte intégral CrossRef / Google Scholar
9. Pitarokoili K, Gold R, Yoon MS. Échographie nerveuse dans un cas de neuropathie motrice multifocale sans bloc de conduction. Nerf musculaire. (2015) 52:294–9. doi: 10.1002/mus.24583
Résumé PubMed / Texte intégral CrossRef / Google Scholar
10. Hartig F, Ross M, Dammeier NM, Fedtke N, Heiling B, Axer H, et al. L’échographie nerveuse prédit la réponse au traitement dans la polyradiculoneuropathie inflammatoire démyélinisante chronique – un suivi prospectif. Neurothérapie. (2018) 15:439–51. doi: 10.1007/s13311-018-0609-4
Résumé PubMed / Texte intégral CrossRef / Google Scholar
11. Tsukamoto H, Granata G, Coraci D, Paolasso I, Padoue L. Corrélation ultrasonore et neurophysiologique dans le bloc de conduction du nerf fibulaire commun à la tête fibulaire. Clin Neurophysiol. (2014) 125:1491–5. doi: 10.1016 / j. clinph.2013.11.041
Résumé PubMed / Texte intégral CrossRef / Google Scholar
12. Harschnitz O, Jongbloed BA, Franssen H, Straver DC, van der Pol WL, van den Berg LH. MMN: from immunological cross-talk to conduction block. J Clin Immunol. (2014) 34(Suppl 1):S112–9. doi: 10.1007/s10875-014-0026-3
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Franssen H. The node of Ranvier in multifocal motor neuropathy. J Clin Immunol. (2014) 34(Suppl 1):S105–11. doi: 10.1007/s10875-014-0023-6
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Taylor BV, Dyck PJ, Engelstad J, Gruener G, Grant I, Dyck PJ. Multifocal motor neuropathy: altérations pathologiques au site du bloc de conduction. J Neuropathol Exp Neurol. (2004) 63:129–37. doi: 10.1093/jnen/63.2.129
Résumé PubMed / Texte intégral Croisé / Google Scholar
15. Grimm A, Winter N, Rattay TW, Hartig F, Dammeier NM, Auffenberg E, et al. Un regard à l’intérieur de la morphologie nerveuse des fascicules nerveux chez des témoins sains et des patients atteints de polyneuropathie. Clin Neurophysiol. (2017) 128:2521–6. doi: 10.1016 / j. clinph.2017.08.022
Résumé PubMed / Texte intégral CrossRef / Google Scholar
16. Haakma W, Jongbloed BA, Froeling M, Goedee HS, Bos C, Leemans A, et al. L’IRM montre un épaississement et une diffusion altérée dans les nerfs médian et ulnaire dans la neuropathie motrice multifocale. Eur Radiol. (2017) 27:2216–24. doi: 10.1007/s00330-016-4575-0
Résumé PubMed / Texte intégral CrossRef / Google Scholar
17. Kaji R, Oka N, Tsuji T, Mezaki T, Nishio T, Akiguchi I, et al. Résultats pathologiques sur le site du bloc de conduction dans la neuropathie motrice multifocale. Ann Neurol. (1993) 33:152–8. doi: 10.1002/ ana.410330204
Résumé PubMed / Texte intégral Croisé / Google Scholar
18. Gallardo E, Noto Y, Simon NG. Échographie dans le diagnostic de la neuropathie périphérique: la structure rencontre la fonction dans la clinique neuromusculaire. J Neurol Neurochirurgie Psychiatrie. (2015) 86:1066–74. doi: 10.1136 / jnnp-2014-309599
Résumé PubMed / Texte intégral croisé / Google Scholar