Infection par le Cytomégalovirus (CMV) chez les patients atteints du VIH / SIDA et valeurs diagnostiques de la détection de l’ADN du CMV dans différents types d’échantillons
- Introduction
- Méthodes
- Sujets
- Inclusion et exclusion
- Réactifs et équipements
- Quantification de l’ARN du VIH
- Comptage des lymphocytes T CD4+
- Quantification de l’ADN-CMV
- Test d’anticorps contre le CMV
- Méthodes d’étude
- Détection des acides nucléiques
- Détection des sous-ensembles de lymphocytes T
- Détection d’anticorps immunitaires
- Analyse statistique
- Résultats
- Données générales
- Taux positifs d’ADN-CMV, d’IgG-CMV et d’IgM-CMV
- Corrélation entre l’infection à CMV et le nombre de lymphocytes T CDD4+
- Détection de l’ADN-CMV dans différents échantillons
- Discussion
- Conclusions
- Remerciements
- Note de bas de page
Introduction
Le cytomégalovirus (CMV) est un herpèsvirus courant répandu dans les populations humaines. L’infection à CMV ne provoque généralement pas de symptômes et affecte principalement les glandes salivaires, les reins et d’autres organes. Cependant, la réplication virale peut survenir chez les patients immunodéprimés et peut contribuer à endommager les organes et leurs fonctions. Les infections opportunistes sont plus fréquentes et plus graves chez les patients atteints du VIH/ SIDA. L’infection par le virus CMV est fréquente chez ces patients et peut affecter plusieurs organes / systèmes, notamment les yeux, les poumons, le système nerveux et le système digestif. De nombreuses études ont exploré les caractéristiques virologiques et immunologiques de l’infection à CMV simple (1), en particulier celles trouvées chez les femmes et les enfants. Cependant, les caractéristiques immunologiques de l’infection à CMV sont tout à fait uniques chez les patients déjà immunodéprimés atteints du VIH / SIDA. Il existe des différences dans les caractéristiques cliniques, les mesures de traitement, les facteurs pronostiques entre les patients séropositifs infectés par le CMV et ceux infectés par le CMV seul (2). La ligne directrice de la Chine a recommandé qu’un traitement antiviral immédiat du CMV et du TAR soit nécessaire chez les patients atteints de VIH / SIDA présentant des complications (rétinite, pneumonie, encéphalite à CMV, entérite, etc.) lorsque l’infection au CMV est identifiée. En raison de la non-spécificité des symptômes cliniques causés par une infection à CMV, l’examen de laboratoire est la principale base du diagnostic de l’infection à CMV. Les deux méthodes cliniques les plus largement utilisées sont la réplication du virus du CMV et les méthodes immunologiques sériques, y compris la détection des IgG du CMV, des IgM du CMV et de l’antigène du CMV PP65 (2) Chez les patients présentant une fonction immunitaire altérée, la production d’anticorps du CMV est affaiblie ou retardée, ce qui peut entraîner un faux négatif et augmenter le taux de diagnostic manqué. La détection par PCR de l’ADN du CMV est donc devenue en grande partie la méthode standard pour le diagnostic de l’infection au CMV et le suivi du traitement (3). Daisuke Mizushima et al. a rapporté que la PCR à l’ADN-CMV plasmatique a une valeur importante dans le diagnostic de la rétinite à CMV et de tous les CMV-EOD chez les patients atteints d’une infection avancée par le VIH-1 (4). La PCR à l’ADN-CMV peut être détectée dans divers types d’échantillons tels que le plasma, l’urine, le liquide céphalo-rachidien, l’humeur aqueuse, les matières fécales, etc. (5). Cependant, peu d’articles ont analysé et discuté de la signification et de la valeur de la détection par PCR de l’ADN-CMV dans des échantillons autres que le plasma. Dans la présente étude, nous avons analysé rétrospectivement les tests de laboratoire (y compris l’ADN du CMV, les anticorps du CMV, le nombre de lymphocytes T CD4 +, la charge virale du VIH, etc.) chez 808 patients atteints du VIH / SIDA qui ont été traités dans notre centre de 2017 à 2019 pour comprendre la coinfection du CMV et les forces et faiblesses de plusieurs méthodes de détection. Nous présentons l’article/le cas suivant conformément à la liste de contrôle des rapports MDAR (disponible à http://dx.doi.org/10.21037/apm-20-1352).
Méthodes
Sujets
Un total de 808 patients hospitalisés pour le VIH / SIDA admis dans notre centre entre janvier 2017 et octobre 2019 ont été inscrits. L’ARN-VIH, le nombre de lymphocytes T CD4+, l’ADN-CMV et les anticorps apparentés ont été mesurés chez chaque patient. Le diagnostic d’infection par le VIH était basé sur les Directives sur le Diagnostic et le traitement du VIH / SIDA (troisième édition) (6), et tous les patients ont été confirmés comme infectés par le VIH par les Centres municipaux de contrôle des maladies de Fuzhou (CDC) ou les CDC locaux qui ont traité le patient. Le diagnostic de l’infection au CMV reposait sur les critères suivants : (I) l’ADN du CMV positif dans le plasma, le liquide de lavage alvéolaire, l’urine, le liquide céphalo-rachidien (LCR) et/ou d’autres liquides corporels; (II) l’immunoglobuline M (IgM) sérique du CMV positive; (III) un diagnostic ophtalmologique de rétinite au CMV; (IV) Pneumonie à CMV se manifestant principalement par de la fièvre, de la toux, des mucosités et une oppression thoracique; ADN-CMV positif dans le liquide de lavage alvéolaire; (V) entérite ou œsophagite à CMV se manifestant principalement par une dysphagie / douleur à la déglutition, une diarrhée ou des douleurs abdominales et un traitement diagnostique efficace anti-CMV; (VI) encéphalite à CMV se manifestant par des symptômes du système nerveux et ADN-CMV positif dans le LCR ou le tissu cérébral; (VII) hépatite à CMV se manifestant par de la fièvre, une fonction hépatique anormale et une gêne dans la région du foie, et CMV – ADN positif dans la biopsie du foie. Un diagnostic d’infection au CMV a été posé si l’un des critères ci-dessus, à l’exception du point (II), était satisfait ou si le point (II) plus tout autre critère était satisfait (7).
Toutes les procédures effectuées dans cette étude impliquant des participants humains étaient conformes à la Déclaration d’Helsinki (telle que révisée en 2013). L’étude a été approuvée par le comité d’éthique médicale de notre centre (approbation No. KS2019-070-01). Les données sont anonymes et l’exigence de consentement éclairé a donc été levée.
Inclusion et exclusion
Critères d’inclusion: patients atteints du VIH / SIDA qui ont visité pour la première fois l’Hôpital hépatobiliaire de Mengchao de l’Université médicale du Fujian et ont terminé la détection de l’ARN VIH, de l’ADN CMV, de l’anticorps CMV-IgG, de l’anticorps CMV-IgM et des lymphocytes T CD4 + dans les 14 jours. Exclure les cas de VIH / sida qui ne peuvent pas effectuer les tests ci-dessus en raison de la taille insuffisante de l’échantillon.
Réactifs et équipements
Quantification de l’ARN du VIH
La réaction en chaîne de la polymérase (PCR) en temps réel quantitative fluorescente (FQ-PCR) a été réalisée sur le système QPCR Mx3000p (Agilent, USA) en utilisant le kit de quantification de l’ARN du VIH produit par QiaGen (Shenzhen, Chine).
Comptage des lymphocytes T CD4+
L’instrument utilisé était le cytomètre en flux FACSCalibur (BD Biosciences, USA), et le kit de réactifs utilisé était BD Multitest CD3/CD4/CD8/CD45 (BD Biosciences, USA).
Quantification de l’ADN-CMV
FQ-PCR a été réalisée sur le système QPCR Mx3000p (Agilent, USA) pour détecter les niveaux d’ADN-CMV dans le plasma, l’urine et le LCR. Le kit utilisé a été produit par Sansure Biotech (Hunan, Chine).
Test d’anticorps contre le CMV
Un immunoessai par chimiluminescence a été réalisé pour détecter les anticorps anti-CMV-IgG et IgM sur l’analyseur Cobas e601 (Roche Diagnostics, Allemagne) avec les kits de support (Roche Diagnostics, Allemagne).
Méthodes d’étude
Détection des acides nucléiques
Après l’admission des patients atteints du VIH / SIDA dans notre hôpital, 3 mL d’échantillon de sang total anticoagulé à jeun d’acide éthylènediaminetétraacétique (EDTA) ont été collectés puis centrifugés à 3 000 tr / min pendant 5 minutes pour récolter 200 µL de plasma pour la détection de l’ARN du VIH et de l’ADN du CMV. Chez tous les patients, 5 mL d’échantillon d’urine ont été collectés le matin et mélangés à fond, puis 200 µL ont été récoltés pour la détection de l’ADN-CMV. Pour les patients présentant des symptômes neurologiques, 1 mL de LCR a été obtenu pour la détection de l’ADN-CMV. Selon la limite de détection et la norme de jugement positif du kit d’ADN-CMV et du kit d’ARN-VIH. Les échantillons ont été considérés positifs si la valeur de l’ADN-CMV était supérieure à 400 copies/mL, ou si le taux d’ARN-VIH était supérieur à 500 copies/mL.
Détection des sous-ensembles de lymphocytes T
Chez les patients atteints du VIH / SIDA, 3 mL d’échantillon de sang total à jeun anticoagulé à l’EDTA ont été prélevés à l’admission, puis soigneusement mélangés pour la détection des sous-ensembles de lymphocytes T sur un cytomètre en flux BD FACSCalibur à l’aide des réactifs auxiliaires.
Détection d’anticorps immunitaires
Chez les patients atteints du VIH / SIDA, 3 mL d’échantillon de sang à jeun ont été prélevés à l’admission, centrifugés à 3000 tr / min pendant 5 minutes dans un tube sérique avec séparateur de gel, puis testés sur la machine.
Tous les tests ci-dessus ont été effectués en stricte conformité avec les instructions du réactif dans le manuel du fabricant et les procédures opérationnelles standard des instruments.
Analyse statistique
L’analyse statistique a été réalisée à l’aide du logiciel SPSS 21.0. Les données de mesure normalement distribuées sont présentées en utilisant la moyenne ± écart-type (x ± écart-type), et les données non normalement distribuées sont exprimées en médiane (25 à 75 centiles). Les données de comptage sont exprimées en pourcentages et en taux. La comparaison des données de mesure non normalement distribuées entre deux groupes a été effectuée à l’aide d’un test de somme de rang non paramétrique, tandis que les données de comptage ont été comparées à l’aide du test du Chi carré. Une valeur de P < 0,05 a été considérée comme statistiquement significative.
Résultats
Données générales
Les données générales de 808 patients atteints du VIH/SIDA sont résumées dans le tableau 1. Le sexe et l’âge n’ont montré aucune différence significative entre le groupe CMV et le groupe non CMV. Le nombre absolu de CD4 dans le groupe infecté par le CMV était significativement inférieur à celui du groupe non infecté par le CMV (Z = -8,87, P < 0,001), et le taux d’ARN du VIH était significativement plus élevé dans le groupe infecté par le CMV que dans le groupe non infecté par le CMV (Z = -3,207, P < 0,05) (tableau 1).
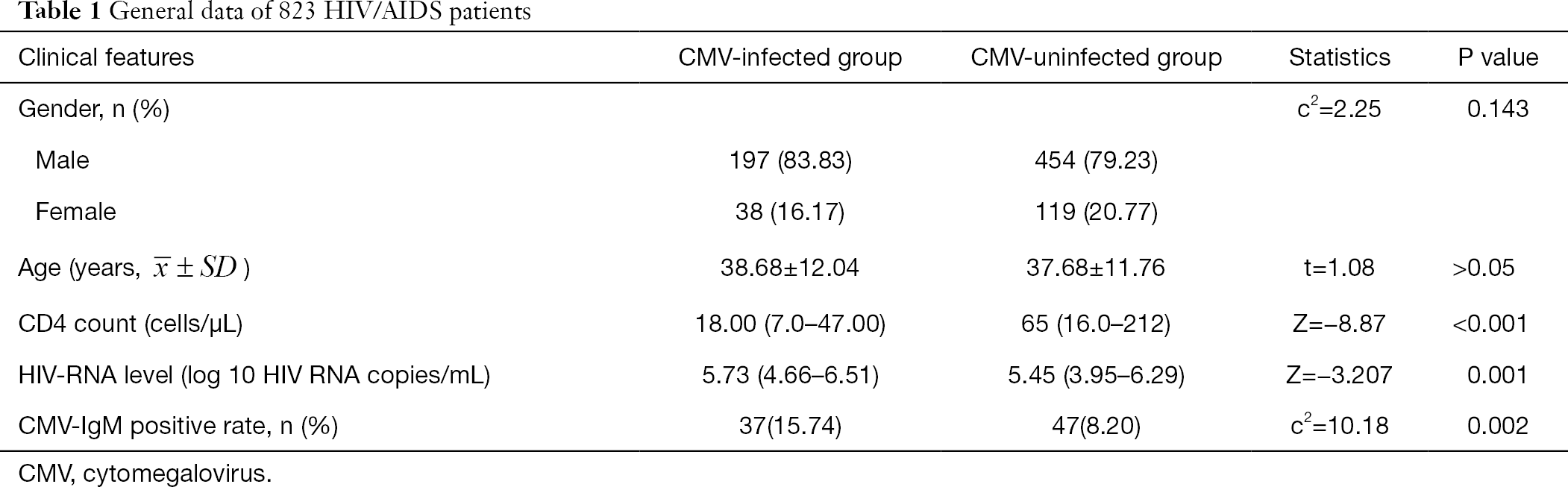
Tableau complet
Taux positifs d’ADN-CMV, d’IgG-CMV et d’IgM-CMV
Le taux positif global d’ADN-CMV était de 29,08 % (235/808 ); plus précisément, il était de 5,70% (13/228) dans le LCR, de 26,01% (77/296) dans le plasma et de 25,75% (180/699) dans l’urine. Le taux positif de CMV-IgG était de 99,8% (806/808) et le taux positif de CMV-IgM était de 10,40% (84/808).
Corrélation entre l’infection à CMV et le nombre de lymphocytes T CDD4+
Après avoir groupé le nombre de lymphocytes T CD4 +, nous avons constaté que la proportion de patients infectés par le cytomégalovirus à basse fréquence de lymphocytes T CD4 + était supérieure à celle des patients non infectés par le CMV. L’incidence de l’infection à CMV a augmenté avec la diminution du nombre de CD4 (tableau 2).
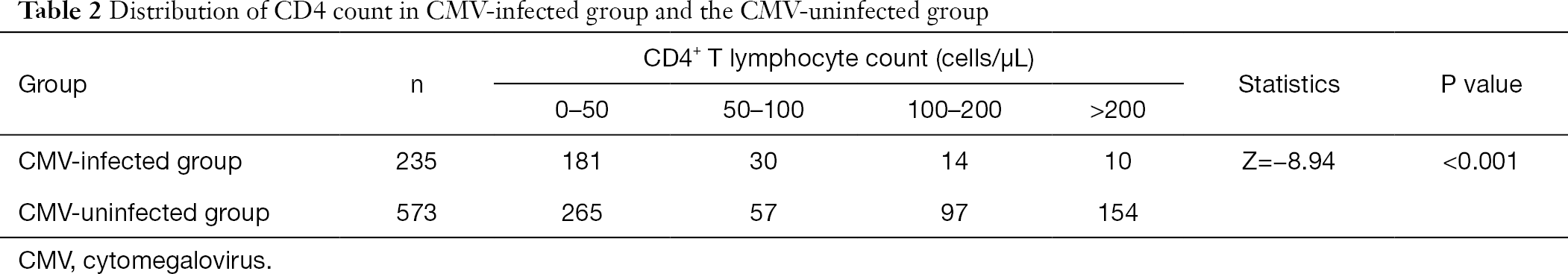
Tableau complet
Détection de l’ADN-CMV dans différents échantillons
Parmi ces 808 patients, 198 patients ont également reçu des tests de dépistage de l’ADN-CMV plasmatique et urinaire et de l’anti-plasma – Anticorps CMV-IgG et CMV-IgM. En utilisant l’analyse du Chi carré pour les données appariées, nous avons effectué des comparaisons par paires de l’ADN-CMV urinaire et de l’ADN-CMV plasmatique avec l’anticorps-CMV-IgM plasmatique, respectivement. Il a été constaté que les résultats de la détection de l’ADN-CMV dans l’urine et le plasma différaient significativement de celui du test d’anticorps plasmatiques CMV-IgG (P < 0,001), alors que le résultat de la détection de l’ADN-CMV dans le plasma n’était pas significativement différent de celui de la détection de l’ADN-CMV dans l’urine (P > 0,05) (tableaux 3,4).

Tableau complet
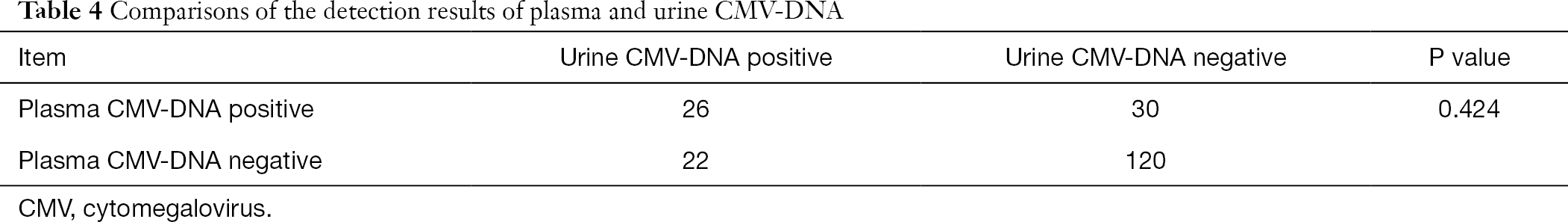
Tableau complet
Discussion
Le CMV fait partie du groupe du virus de l’herpès β et se caractérise par sa spécificité d’espèce stricte et son incidence généralisée dans les populations humaines. La séroprévalence au CMV est d’environ 85% chez les enfants et jusqu’à 95% chez les adultes. Dans notre étude actuelle, le taux positif de CMV-IgG a atteint 99,8%. Le CMV est latent dans la plupart des cas, mais chez les personnes immunodéprimées, le virus se réplique de manière exponentielle et se propage dans tout le corps avec le sang, provoquant une virémie au CMV et même une maladie organique du CMV (8). L’infection à CMV est l’une des infections opportunistes courantes chez les patients atteints du VIH / SIDA. Les lymphocytes T CD4 + sont les cellules cibles du virus VIH, et leur nombre peut souvent refléter l’évolution du SIDA et peut également être utilisé comme indicateur pour évaluer le statut immunitaire des patients atteints du sida. Cette étude a analysé l’infection à CMV, le nombre de CD4 et le taux d’ARN-VIH chez 808 patients atteints du VIH / SIDA. Nous avons constaté que le taux positif de CMV chez les patients atteints du SIDA augmentait avec la diminution du nombre de CD4 et avec l’augmentation de la charge virale du VIH. Toujours dans notre étude actuelle, jusqu’à 77,02% des patients positifs au CMV présentaient un nombre de CD4 < 50 cellules / µL, suggérant que CD4 < 50 cellules / µL est un facteur de risque de co-infection VIH-CMV, ce qui est cohérent avec les conclusions de Deng et al. (9). Le niveau quantitatif d’ARN du VIH dans le groupe infecté par le CMV était plus élevé que celui du groupe non infecté par le CMV, ce qui suggérait indirectement que des niveaux élevés de charge virale en ARN du VIH constituaient un autre facteur de risque d’infection par le CMV chez les patients atteints du VIH / SIDA.Par conséquent, il est recommandé aux patients atteints du VIH / SIDA d’initier un traitement antirétroviral dès que possible afin de favoriser la reconstitution immunitaire afin de prévenir les infections opportunistes et le dépistage du VHC est essentiel pour les patients atteints du VIH / SIDA ayant un taux de CD4 < 50 cellules / µL (2).
Nous avons également évalué les valeurs des dosages d’acides nucléiques viraux et des méthodes immunologiques dans la détection clinique de l’infection à CMV. Des études en Chine et au niveau international ont montré que l’ADN-CMV apparaît plus tôt que les symptômes cliniques et les réactions sérologiques des infections à CMV. La FQ-PCR est actuellement la méthode de quantification microbienne la plus précise et la plus rapide et est capable de surmonter certains problèmes de la PCR traditionnelle (par exemple, contamination des produits d’amplification et non-quantification) (10). Dans notre étude actuelle, le taux positif d’ADN-CMV était de 5.70% (13/228) dans les échantillons de LCR de 228 patients présentant des symptômes neurologiques, ce qui était beaucoup plus faible que dans les échantillons de plasma et d’urine, ce qui pourrait s’expliquer par la barrière hémato-encéphalique et la sensibilité des organes. L’anticorps anti-CMV-IgM est souvent utilisé comme marqueur d’infection virale active; cependant, le taux positif de l’anticorps anti-CMV-IgM n’était que de 10,40% (84/808) chez nos patients atteints du VIH / SIDA, ce qui était inférieur au taux positif d’infection à CMV rapporté dans les populations non séropositives (11). En outre, son taux positif était en mauvais accord avec les résultats de la détection des acides nucléiques, ce qui pourrait être dû à l’affaiblissement du système immunitaire ou à la génération retardée d’anticorps IgM chez les patients atteints du VIH / SIDA. Par conséquent, la détection de l’anticorps CMV-IgM joue un rôle limité dans le dépistage du VHC chez les patients atteints du VIH / SIDA. De plus, le taux positif d’infection au CMV chez 808 patients était de 29,05% (235/808) dans notre étude actuelle, ce qui est légèrement supérieur aux 21,85% rapportés par Li et al., et peut être dû à la plus grande variété d’échantillons (y compris le plasma, l’urine et le LCR) collectés dans cette étude (12). Le taux positif d’ADN-CMV était de 25,57% dans l’urine et de 26,01% dans le plasma, la différence n’était pas statistiquement significative. Par conséquent, nous recommandons que le dépistage de l’ADN-CMV dans le plasma et l’urine soit effectué lorsque le nombre de lymphocytes T CD4 + est inférieur à 200 cellules / µL, en particulier lorsque < 50 cellules / µL; de plus, la détection de l’ADN-CMV dans le LCR est nécessaire si des symptômes neurologiques évidents sont présents.
Conclusions
En conclusion, un faible nombre de lymphocytes T CD4+ et une charge virale élevée du VIH-1 sont des facteurs de risque d’infection à CMV chez les patients atteints du VIH / SIDA. La détection de l’ADN-CMV urinaire ou plasmatique par FQ-PCR est très utile pour le dépistage de l’infection à CMV chez les patients atteints du VIH / SIDA, tandis que la détection des taux sanguins d’IgG et d’IgM du CMV a une valeur clinique limitée. Le dépistage de l’ADN du CMV dans le sang ou l’urine est recommandé pour les patients atteints du SIDA afin de prévenir et de diagnostiquer précocement l’infection au CMV et d’améliorer leur qualité de vie.
Remerciements
Financement: Parrainé par le Programme de construction de disciplines spécialisées cliniques Clés du Fujian, C.R.P.
Note de bas de page
Liste de contrôle des rapports: Les auteurs ont rempli la liste de contrôle des rapports MDAR. Disponible à http://dx.doi.org/10.21037/apm-20-1352
Déclaration de partage des données : Disponible à http://dx.doi.org/10.21037/apm-20-1352
Conflits d’intérêts : Tous les auteurs ont rempli le formulaire de divulgation uniforme de l’ICMJE (disponible à http://dx.doi.org/10.21037/apm-20-1352). Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Déclaration d’éthique: Les auteurs sont responsables de tous les aspects du travail en veillant à ce que les questions liées à l’exactitude ou à l’intégrité de toute partie du travail soient examinées et résolues de manière appropriée. Toutes les procédures effectuées dans cette étude impliquant des participants humains étaient conformes à la Déclaration d’Helsinki (telle que révisée en 2013). L’étude a été approuvée par le comité d’éthique médicale de notre centre (approbation No. KS2019-070-01). Les données sont anonymes et l’exigence de consentement éclairé a donc été levée.
Déclaration de Libre Accès : Il s’agit d’un article en Libre Accès distribué conformément à la Licence internationale Creative Commons Attribution-NonCommercial-NoDerivs 4.0 (CC BY-NC-ND 4.0), qui permet la reproduction et la distribution non commerciales de l’article à la stricte condition qu’aucune modification ou modification ne soit apportée et que l’œuvre originale soit correctement citée (y compris les liens vers la publication officielle via le DOI concerné et la licence). Voir : https://creativecommons.org/licenses/by-nc-nd/4.0/.
- Yu X, Tong M, He G. Effects of cytomegalovirus infection on regulatory immune cells in pregnant women Chinese. Journal de Nosocomiologie. 2017;27:2103-6.
- Le Groupe de recherche sur les infections opportunistes du Grand Projet National de Science et de Technologie au cours du 13e Plan quinquennal. Consensus d’experts sur le diagnostic clinique et le traitement du sida compliqué avec la maladie à cytomégalovirus. Journal de l’Université du Sud-Ouest (Édition des sciences naturelles): 1-17.
- Hodowanec AC, Pikis A, Komatsu TE, et al. Traitement et Prévention de la maladie du CMV chez les Receveurs de transplantation: Connaissances actuelles et Perspectives futures. J Clin Pharmacol 2019; 59:784-98.
- Mizushima D, Nishijima T, Yashiro S, et al. Utilité diagnostique de la PCR quantitative de l’ADN du cytomégalovirus plasmatique pour les maladies des organes terminaux du cytomégalovirus chez les patients infectés par le VIH-1. J Acquérir Un Déficit immunitaire Syndr 2015;68:140-6.
- Michaelides A, Liolios L, Glare EM, et al. L’augmentation de la charge d’ADN du cytomégalovirus humain (HCMV) dans les leucocytes du sang périphérique après une transplantation pulmonaire est corrélée à une pneumopathie à HCMV. Transplantation 2001; 72:141-7.
- L’infection de la neurologie, groupe SIDA de l’association médicale chinoise. Directives sur le diagnostic et le traitement du VIH/SIDA (troisième édition). Journal chinois des maladies infectieuses 2015; (10): 577-93.
- Corrales I, Giménez E, Solano C, et al. Incidence et dynamique de l’infection à cytomégalovirus actif chez les patients transplantés de cellules souches allogéniques selon des polymorphismes nucléotidiques simples dans les gènes CCR5, MCP-1, IL-10 et TLR9 du donneur et du receveur. J Med Virol 2015; 87:248-55.
- Tagarro A, Del Valle R, Dominguez-Rodríguez S, et al. Modèles De Croissance chez Les Enfants Atteints D’Une Infection Congénitale À Cytomégalovirus. Pediatr Infect Dis J 2019; 38:1230-5.
- Deng X, Liu J, Zhang M, et al. Analyse des caractéristiques virologiques et immunologiques du VIH / SIDA associées à une infection à cytomégalovirus. Journal Chinois des infections hospitalières 2019; 29:2241-6.
- Kawano Y, Kawada J, Kamya Y, et al. Analysis of circulating human and viral microRNA sin patients with congénital cytomegalovirus infection. J Périnatol 2016; 36:1101-5.
- Li L, Gao S, Zhang T, et al. Comparaison de la détection de l’ADN et de la détection des IgM de l’infection à cytomégalovirus humain et discussion de leur valeur d’application combinée. Journal Chinois des diagnostics expérimentaux 2015; (1): 78-80.
- Li X, Cao L, Yu C, et al. Étude sur l’infection du cytomégalovirus chez les patients atteints du SIDA. Médecine Préventive Moderne 2012;39:2278-9.
( Éditeur de langue anglaise: J. Gray)