L’engagement d’antigènes apparentés sur les cellules parenchymateuses stimule la prolifération des lymphocytes T CD8+ in situ
- Les lymphocytes T CD8+ apparentés se trouvent dans le tissu LN et enflammé
- Les lymphocytes T CD8+ se développent au site de l’inflammation
- L’interaction apparentée avec les îlots favorise l’expansion
- Aucune interaction apparentée avec les leucocytes résidents n’est requise
- L’interaction apparentée avec les cellules parenchymateuses est importante
- Les cellules T prolifèrent au site de l’inflammation
- L’interaction apparentée avec les cellules parenchymateuses entraîne la prolifération
- L’IL-2 est plus importante au site de l’inflammation
Les lymphocytes T CD8+ apparentés se trouvent dans le tissu LN et enflammé
Dans les expériences initiales (Fig. 1) nous avons établi un modèle dans lequel les réponses des lymphocytes T CD8 à un antigène parenchymateux, l’ovalbumine (OVA), pourraient être analysées. Les souris OT-I expriment un TCR transgénique qui médie la reconnaissance des lymphocytes T CD8+ du peptide OVA257-264 présenté sur la molécule H-2Kb de classe I du CMH. Les cellules T CD8 ont été enrichies à partir de souris OT-I/CD45.1, marquées par colorant CFSE et transférées de manière adoptive par i.v. dans des souris hôtes B6 (CD45.2+). Les cellules T transférées de manière adoptive pouvaient être distinguées des cellules hôtes par une coloration CD45.1 (ainsi que CD8 et la chaîne Va2 du TCR OT-I) tandis que la dilution du colorant CFSE était utilisée pour identifier les cellules qui avaient proliféré (par exemple, Fig. 1a, Fig. supplémentaire. 1). L’antigène parenchymateux a été introduit par greffe B6.Îlots ßOVA (ces îlots expriment des OVULES dans les cellules β parenchymateuses sous le promoteur de l’insuline de rat, Tableau supplémentaire 1) sous la capsule rénale de souris hôtes ayant déjà reçu des lymphocytes T OT-I/CD45.1. Les trois sources (hôte, donneur de lymphocytes T et donneur d’îlots) ont un arrière-plan B6 et expriment donc H-2Kb. Ainsi, bien que l’expression de l’antigène des OVULES soit limitée aux cellules β greffées, nous avons supposé que la présentation d’OVULES dérivés des cellules β par un APC non parenchymateux tel que le DC via une présentation croisée serait nécessaire pour l’amorçage de LN et peut-être des réponses locales des lymphocytes T17,18.

Cellules OT-I divisées (porte CD45.1 + CD8 + Va2 + viables) en LN rénale drainante et greffe 3 ou 6 jours après la réception d’un seul greffon de 400 B6.Îlots ßOVA. a) Graphiques de cytométrie en flux représentatifs. La position du pic OT-I indivis a été déterminée en utilisant le contrôle “sans antigène” d’un greffon d’îlot B6. (b) Nombre total d’OT-I divisés dans le LN rénal et le greffon où chaque point représente une souris individuelle. Données regroupées de sept expériences indépendantes: n = 8 receveurs de greffe au jour 3 et n = 14 receveurs de greffe au jour 6. Un jour, la greffe 6 a été perdue en raison d’un dysfonctionnement du cytomètre de flux. Les barres horizontales sont des moyennes, les valeurs de P ont été calculées par un test t à deux queues non apparié avec la correction de Welch.
Les lymphocytes T CD8+ se développent au site de l’inflammation
Comme prévu, une réponse OT-I puissante a d’abord été détectée dans le LN rénal qui draine le site de greffe et cela dépendait de la présence d’antigène OVOÏDE (Fig. 1 bis, b). 3 jours après la greffe, l’OT-I divisé a pu être détecté dans le LNs drainant le B6.Les greffes d’îlots ßOVA (Fig. 1a) et étaient abondants (Fig. 1b, moyenne = 9,2 × 104). En revanche, des cellules OT-I divisées 100 fois moins ont pu être détectées dans B6.Greffons ßOVA (Fig. 1a, b, moyenne = 6,6 × 102). Le nombre de cellules OT-I divisées a été multiplié par 300 au site de greffe du jour 3 au jour 6 (Fig. 1b, moyenne = 6,6 × 102 au jour 3 à 2,1 × 105 au jour 6, P < 0,0001, test t à deux queues non apparié avec correction de Welch) alors qu’il n’y avait pas d’augmentation du LN (Fig. 1b). La réponse OT-I en B6.Les greffes ßOVA pourraient s’expliquer par l’infiltration de cellules OT-I qui avaient proliféré dans le LN. Cependant, les profils de CFSE étaient différents entre les sites greffés et LN car les cellules OT-I des greffons étaient plus fortement divisées que celles du LN au jour 6 (Fig. 1 bis). Il y a au moins deux explications possibles à cette différence. Seules les cellules qui s’étaient divisées plusieurs fois se sont infiltrées dans la greffe. Alternativement, les cellules atteignant le greffon se divisent plus rapidement, peut-être en raison de l’abondance de l’antigène disponible. L’augmentation du nombre absolu de cellules dans le greffon par rapport à LN au jour 6 nous a amenés à étudier cette dernière explication.
L’interaction apparentée avec les îlots favorise l’expansion
Pour déterminer la contribution possible du CMH apparenté dans le greffon à l’expansion locale, nous avons utilisé des îlots dérivés de bm1.Souris ßOVA (Tableau supplémentaire 1). En bm1.Les souris ßOVA, la molécule H-2Kbm1 est incapable de présenter le peptide OVA257–264 en raison de trois mutations en H-2Kb (réf. 19). Une comparaison des réponses à B6.ßOVA et bm1.Les greffes d’îlots ßOVA ont montré que malgré des réponses OT-I similaires dans la LN rénale drainante, l’expansion de l’OT-I était réduite de six fois dans bm1.ßOVA par rapport à B6.Greffes ßOVA (moyenne = 4.7 × 104 par rapport à 2,6 × 105 OT-I divisé; P = 0,0153 test t à deux queues non apparié avec correction de Welch; Fig. 2 bis). Cette expansion moins efficace des cellules OT-I infiltrant bm1.Les greffes ßOVA suggèrent que les interactions apparentées avec les cellules d’îlots greffées contribuent à l’expansion locale des lymphocytes T.

Analyse par cytométrie en flux de cellules OT-I (porte CD45.1 + CD8 + Va2+ viable) 6 jours après la greffe. (a) OT-I total divisé dans le LN rénal drainant et le greffon après réception d’un seul greffon de 400 B6.ßOVA ou bm1.Îlots ßOVA. Données pour B6.Les souris greffées ßOVA sont un sous-ensemble de celle représentée à la Fig. 1b. Chaque point représente une souris individuelle. Les données regroupées de deux expériences indépendantes sont présentées dans chaque panel : n = 5 destinataires de B6.Greffes ßOVA, et n = 6 receveurs de bm1.Greffes ßOVA. Les barres horizontales sont des moyennes, les valeurs de P ont été calculées par un test t à deux queues non apparié avec la correction de Welch. (b) Schéma d’un modèle de greffe bipolaire dans lequel des greffons de 200 îlots sont placés aux pôles opposés d’un même rein et partagent une LN rénale drainante commune. Total divisé OT-I en (c) B6.ßOVA et KbKO.Les greffes bipolaires ßOVA et (d) B6.Les greffons bipolaires ßOVA et B6 (n = 5 souris receveuses regroupées à partir de deux expériences indépendantes dans chacune des souris c et d) sont reliés par des lignes pointillées pour la même souris : Les valeurs de P ont été calculées par un test t apparié de rapport.
Pour éliminer toute contribution de l’alloantigen H-2Kbm1, nous avons généré KbKO.Souris ßOVA qui expriment l’antigène OVOÏDE dans les cellules bêta des îlots mais qui n’ont pas d’alloantigène ou de H-2Kb (Tableau supplémentaire 1). Nous avons ensuite utilisé un “modèle de greffe bipolaire” pour comparer les réponses à B6.ßOVA et KbKO.Des greffes d’îlots ßOVA placées aux pôles opposés du même rein chez une souris hôte B6 de telle sorte que les lymphocytes T infiltrants par greffe sont dérivés de lymphocytes T amorcés dans le même LN (Fig. 2b). Il y avait 10 à 100 fois plus de lymphocytes T présents dans B6.ßOVA que KbKO.Greffons ßOVA (Fig. 2c). En utilisant le rapport d’OT-I divisé aux pôles opposés du rein calculé pour des souris individuelles, nous avons dérivé un Rapport de réponse relative (RRR). Le RRR a indiqué que l’expansion locale des lymphocytes T était 26 fois plus grande lorsque l’engagement apparenté avec les cellules greffées s’est produit (RRR = 26,4 ±14,1 dans B6.ßOVA : KbKO.Greffons ßOVA, P = 0,0025, rapport test t apparié, Fig. 2c).
Nous avons également comparé les réponses à B6 bipolaire.Greffes ßOVA et B6 (sans antigène) (Fig. 2d). Très peu d’OT-I ont pu être détectés dans les greffons B6 (Fig. 2d) et nous considérons qu’il est probable que beaucoup d’entre eux circulaient de l’OT-I provenant d’une contamination sanguine. Ainsi, une inflammation non spécifique associée à la transplantation de greffons dépourvus d’antigène ne conduit pas à une expansion efficace des lymphocytes T dans le tissu enflammé. En revanche, la réponse à B6.Les greffons ßOVA étaient à nouveau très puissants et plus de 900 fois supérieurs à ceux des greffons B6 (RRR = 950±252 pour B6.ßOVA: Greffons B6, P < 0,0001, test t apparié de rapport, Fig. 2d).
Ensemble, ces expériences ont indiqué que l’expansion des lymphocytes T CD8 dans le tissu cible enflammé était significativement favorisée par la présentation locale de l’antigène. Cela n’exclut pas nécessairement d’autres contributions à l’expansion des lymphocytes T, par exemple en présentant le DC de l’hôte croisé dans le greffon. Nous n’avérons que l’interaction apparentée entre les cellules T et les cellules des îlots entraîne une expansion substantielle des cellules T.
Aucune interaction apparentée avec les leucocytes résidents n’est requise
Les îlots sont des amas complexes de cellules comprenant des cellules β, des cellules endothéliales et des leucocytes résidents d’îlots (IRL). Par conséquent, nous avons ensuite cherché à clarifier quelles cellules d’îlots présentaient un antigène aux lymphocytes T infiltrants pour stimuler l’expansion des lymphocytes T. Le candidat le plus évident serait IRL. Ces cellules CD45+ ont été diverses fois définies comme des macrophages DC ou, co-expriment CD11c et F4/80, et il a été démontré qu’elles traitent et présentent des antigènes 20, 21, 22, 23. Nous avons donc examiné le rôle de l’IRL du donneur dans l’expansion locale des lymphocytes T CD8. B6.Les souris ßOVA ont été croisées à CD11c.DTR.Souris GFP afin d’obtenir CD11c.DTR.GFP.Souris ßOVA dont les cellules β expriment des OVULES et dont les cellules CD11c+ pourraient être ablatées par injection de toxine diphtérique (DT)8. Nous avons d’abord testé par FACS que des îlots isolés de CD11c.DTR.Les souris GFP traitées par DT ont été appauvries en cellules CD11c+ (Fig. 3 bis, b). CD11c + IRL chez des souris témoins non traitées ont été identifiés par coloration pour CD45 et CD11c ainsi que leur expression du rapporteur de la GFP et ont été clairement épuisés par traitement DT (Fig. 3a, b, P = 0,0002, test t à deux queues non apparié avec correction de Welch). Nous avons également confirmé que le CD11c + IRL co-exprimait F4/80 et H-2 Kb CMH de classe I (Fig. 2a) et par conséquent des cellules F4/80+ ont également été appauvries des îlots de souris traitées par DT (Fig. supplémentaire. 2b). CD11c.DTR.GFP.Des îlots ßOVA isolés de souris non traitées et traitées par DT ont été greffés aux pôles opposés du même rein. Le nombre OT-I divisé était similaire entre les greffons, indiquant que la déplétion IRL n’avait aucun effet sur l’expansion des lymphocytes T CD8 + au site du greffon (Fig. 3c). Pour confirmer que les IRL n’étaient pas importantes pour l’expansion locale des lymphocytes T CD8, nous avons effectué une deuxième série d’expériences. KbKO.Des souris ßOVA ont été irradiées et reconstituées avec de la moelle osseuse (BM) KbKO ou B6 pour générer une source d’îlots ßOVA dans lesquels l’expression de H-2Kb était absente de toutes les cellules ou rétablie sélectivement en IRL (Fig. 3d). La comparaison de ces îlots dans le modèle de greffe bipolaire a montré des niveaux similaires d’expansion cellulaire OT-I dans les deux greffes (Fig. 3e). Par conséquent, les IRL ne sont pas des moteurs majeurs de l’expansion locale des lymphocytes T CD8.

Analyse par cytométrie en flux montrant une déplétion de CD11c + IRL dans CD11c.DTR.Souris GFP traitées par DT: (a) Des graphiques représentatifs montrant le déclenchement de CD11c + IRL dans des îlots de souris témoins non traitées et leur épuisement le jour suivant un seul traitement DT, et (b) le dénombrement de CD11c + IRL chez des souris non traitées et traitées DT. Chaque point représente une préparation individuelle d’îlots contenant des îlots mis en commun de 1 à 8 souris, n = 5 préparations d’îlots non traitées et 6 préparations d’îlots traitées DT mises en commun à partir de quatre expériences indépendantes. Valeur de P calculée par test t à deux queues non apparié avec correction de Welch. (c) OT-I divisé total à 6 jours après la greffe bipolaire d’îlots obtenus à partir de CD11c.DTR.GFP.Souris ßOVA non traitées ou traitées par DT (n = 6 souris receveuses regroupées à partir de deux expériences indépendantes). Les données pour la même souris sont reliées par des lignes pointillées; Les valeurs P sont calculées par le rapport t-test apparié. (d) Des parcelles représentatives montrant l’absence ou la présence d’expression de H-2Kb sur CD11c + IRL de souris KbKO reconstituées avec KbKO ou B6 BM respectivement. Pré-panaché sur des cellules viables. (e) OT-I divisé total à 6 jours après la greffe bipolaire d’îlots obtenus à partir de souris chimériques (n = 3 souris receveuses d’une seule expérience). Les données de la même souris sont reliées par des lignes pointillées; Valeurs de P calculées par rapport t-test apparié.
L’interaction apparentée avec les cellules parenchymateuses est importante
B6.Les souris RIP-Kb expriment transgéniquement H-2Kb dans les cellules β sous le contrôle du promoteur de l’insuline chez le rat24. En croisant ces souris à KbKO.Souris ßOVA nous avons généré KbKO.ßOVA.Souris ßKb chez lesquelles l’expression de H-2Kb était limitée aux cellules β (Tableau supplémentaire 1). L’expression de H-2Kb sur les cellules β a été confirmée par l’analyse FACS des îlots (Fig. 4 bis). Nous avons étudié les cellules hématopoïétiques des îlots (CD45+) et les cellules endothéliales (CD31+) et avons montré que H-2Kb n’était pas exprimé sur ces cellules dans les deux KbKO.ßOVA ou KbKO.ßOVA.Les souris ßKb comparées à une forte expression chez les souris B6 (Fig. 4 bis). Les cellules CD45−CD31 restantes sont autofluorescentes positives et enrichies en cellules endocrines. Analyse FACS des îlots de KbKO.ßOVA.Les souris ßKb ont montré une expression de H-2Kb au sein de la population autofluorescente enrichie en cellules β à des niveaux similaires à ceux observés dans les îlots B6 (Fig. 4 bis). La comparaison dans le modèle de greffe bipolaire a indiqué que l’expansion de l’OT-I était 14 fois plus grande lorsque l’antigène apparenté était exprimé sur les cellules β (RRR = 14,0 ±4,1 pour KbKO.ßOVA.ßKb : KbKO.Greffons ßOVA, P = 0,0008, rapport test t apparié, Fig. 4b).

( a) Des parcelles de cytométrie en flux (fermées sur des cellules viables) montrant une restauration sélective de l’expression de H-2Kb sur des cellules parenchymateuses. Les histogrammes représentent des îlots de KbKO (ombré), B6 (en pointillés) ou KbKO.Souris ßKb (gras). (b) OT-I total divisé à 6 jours après la greffe bipolaire de KbKO.ßOVA et KbKO. ßOVA.ßKb. îlots (n = 6 souris receveuses regroupées à partir de trois expériences indépendantes). Les données pour la même souris sont reliées par des lignes pointillées; Les valeurs P sont calculées par le rapport t-test apparié.
Les cellules T prolifèrent au site de l’inflammation
Nos résultats ci-dessus indiquent qu’il y avait une prolifération locale au site cible. Afin de détecter des cellules en prolifération active, nous avons croisé des souris OT-I /CD45.1 à des souris FucciRG pour générer FucciRG/OT-I/CD45.1 souris (en abrégé FucciOT-I). Chez ces souris, les cellules fluorescent en rouge (FucciR) pendant G0/G1 et en vert (FucciG) pendant les phases du cycle cellulaire S/G2/m25,26. La dégradation et l’accumulation graduelles des reporters de FucciR et de FucciG lors de la transition entre les phases du cycle permettent de faire d’autres distinctions : expression de FucciR plus intense dans les cellules G0 reposantes par rapport aux cellules G1 cycliques, doubles cellules FucciR−G− négatives dans les cellules G1 très précoces et faiblement doubles cellules FucciR+G+ positives dans les cellules G1/S (références 26, 27). Les cellules FucciOT-I quiescentes de souris non greffées étaient des FucciG- (Fig. 5a, panneau supérieur, non greffé). Pour éviter les interférences avec les colorants Fucci, nous avons remplacé CFSE par CTV. Chez les souris qui avaient reçu B6.Greffes ßOVA, l’analyse de la dilution du CTV a indiqué que du FucciOT-I divisé était présent dans le LN rénal drainant et que certains d’entre eux étaient FucciG+ suggérant une division cellulaire active (Fig. 5a, panneau supérieur, vidange LN). Sur le site de greffe, nous avons détecté du FucciOT-I qui avait subi de nombreuses divisions (le CTV n’est plus détectable) et beaucoup d’entre elles étaient des FucciG+ favorables à la prolifération en cours (Fig. 5a, panneau supérieur, greffe fraîche). Comparaison de la proportion de cellules FucciG+ au sein de la population OT-I divisée (Fig. 5c) ont indiqué que la prolifération continue au sein des greffons frais (26,8 ±8,8% de FucciG+) dépassait celle du LN rénal drainant (7,3 ±1,6%, P = 0,008, test t à deux queues non apparié avec correction de Welch) ou du LN rénal non drainant (2,1 ±2,1%, P = 0,003, test t à deux queues non apparié avec correction de Welch). En effet, l’examen de l’expression à la fois du FucciG et du FucciR a montré que la plupart des OT-I infiltrants de greffe se divisaient activement, c’est-à-dire que très peu de cellules présentaient une expression élevée du FucciR caractéristique des cellules quiescentes dans le LN des souris non greffées (Fig. 5a, panneaux inférieurs). Bien que nous ayons supposé que cette prolifération au site de l’inflammation était générée in situ, nous ne pouvions pas complètement écarter la possibilité que cela reflète simplement l’arrivée récente de cellules proliférantes. Pour clarifier cela, nous avons récolté les greffons bipolaires de B6.Ilots ßOVA pour analyser un greffon immédiatement après l’excision et cultiver l’autre greffon pendant 1 jour (Fig. 5 bis). Alors que le nombre d’OT-I n’a pas augmenté au cours de la période de culture (Fig. 5b), reflétant vraisemblablement la mort cellulaire dans des conditions ex vivo sous-optimales, de nombreuses cellules FucciG+ OT-I ont continué à être détectées (14,2±4,2% de FucciG+, Fig. 5c). Le profil du greffon cultivé, sans recrutement possible pendant une journée, indiquerait une prolifération élevée de novo dans le greffon.

( a) Des diagrammes de cytométrie en flux schématiques et représentatifs (basés sur des lymphocytes CD45.1 + CD8 + Va2 + viables) montrant la réponse des cellules FucciOT-I dans le LNs rénal ou le B6 bipolaire.Greffes ßOVA. Le LNs et le greffon d’un pôle ont été examinés immédiatement (frais 6 jours après la greffe) tandis que le greffon du pôle opposé a été mis en culture pendant 1 jour avant l’analyse. LN d’une souris non greffée a été inclus pour montrer l’absence de division et d’expression de FucciG (panneau supérieur) et la prédominance des cellules hautes de FucciR (panneau inférieur) dans le FucciOT-I au repos. (b) FucciOT-I divisé total dans les greffes fraîches et cultivées. Moyenne + d.s., n = 5, Valeurs de P calculées par le test t apparié du rapport à deux queues. (c) % FucciG + divisé OT-I en LN rénal frais non drainant et drainant le greffon ainsi qu’en greffes fraîches et cultivées. Moyenne + d.s., n = 5 à l’exception de LN non drainant pour lequel n = 4 en raison de la perte d’un LN pendant le traitement. Les valeurs de P ont été calculées par test t non apparié à deux queues avec correction de Welch. Les données sont regroupées à partir de deux expériences indépendantes.
L’interaction apparentée avec les cellules parenchymateuses entraîne la prolifération
Nous avons ensuite profité du modèle FucciOT-I pour évaluer le rôle d’un autre facteur local potentiel de prolifération des lymphocytes T dans le greffon, l’APC dérivé de l’hôte tel que le DC inflammatoire. Afin d’éliminer toute contribution de l’APC hôte, nous avons d’abord dérivé un arrière-plan KbKO. Comme les souris KbKO rejetaient les cellules OT-I, nous avons créé KbKO BM en chimères B6 pour les utiliser comme hôtes; ainsi, les cellules hématopoïétiques manquaient de H-2Kb mais étaient permissives des cellules OT-I. Ces chimères ont reçu des cellules FucciOT-I T et des greffes bipolaires de KbKO.Îlots ßOVA (absence d’expression de H-2Kb et donc de capacité à présenter l’antigène OVOÏDE) et KbKO.ßOVA.Îlots ßKb (l’antigène H-2Kb et OVULES était limité aux cellules β). Comme la chimère n’avait pas d’APC positif H-2Kb, il a été nécessaire d’administrer des cellules de rate revêtues de peptide OVA257-264 afin d’initier la réponse OT-I. Le succès de cet amorçage a été démontré par la dilution de CTV dans les cellules FucciOT-I dans le LN rénal, bien qu’au moment de la récolte, celles−ci étaient FucciG- et ne semblaient pas se diviser activement (0,1±0,0% FucciG+, Fig. 6 bis, d). Très peu d’OT-j’ai infiltré le KbKO.Les greffes de ßOVA mais ont été clairement élargies au sein de KbKO.ßOVA.Greffes ßKb (RRR de 61,4±26,6 pour KbKO.ßOVA.ßKb : KbKO.ßOVA, Fig. 6b, P = 0,0008, test t apparié à deux queues). Ainsi, même en l’absence d’antigène apparenté sur l’APC hôte, l’antigène apparenté sur les cellules β parenchymateuses était suffisant pour entraîner l’expansion des lymphocytes T CD8 au site de greffe. Les quelques cellules FucciOT-I T présentes dans KbKO.Les greffons ßOVA ressemblaient à ceux du LN à la fois en termes de progression inefficace vers la fraction fortement divisée (Fig. 6a, c, 7,5 ±0,9% fortement divisé en LN et 19,3 ±3,3% fortement divisé en KbKO.Greffes ßOVA) et l’absence d’expression de FucciG (Fig. 6a, d, 0,1±0,0% en LN et 0,1±0,1% en KbKO.Greffes ßOVA) suggérant qu’une faible prolifération de l’OT-I s’est produite au site du greffon en l’absence d’antigène apparenté. En revanche, l’OT-I au sein de KbKO.ßOVA.Les greffons ßKb étaient principalement très divisés (92,3±1,0%, Fig. 6a, c) et certains d’entre eux étaient FucciG+ et proliféraient ainsi activement (Fig. 6a, d, 5,0± 1,2% FucciG+). Par conséquent, la présentation d’antigènes apparentés par des cellules β parenchymateuses d’îlots a pu conduire la prolifération de novo du FucciOT-I in situ.

Réponse FucciOT-I aux greffes de KbKO BM chez des souris hôtes B6 chez lesquelles les cellules hématopoïétiques hôtes manquent d’expression H-2Kb. Les souris greffées ont reçu des cellules de rate revêtues de peptides le jour de la greffe afin d’initier l’amorçage de l’OT-I. (a) Placettes de cytométrie en flux représentatives (fixées sur des lymphocytes CD45.1 + CD8 + Va2+ viables). Le panneau supérieur montre un manque de division et d’expression de FucciG dans l’OT-I au repos chez une souris qui n’a été ni greffée ni amorcée. Les trois panneaux inférieurs montrent des reponses chez une souris bipolaire greffée et amorcée: LN rénal drainant, KbKO.ßOVA et KbKO.ßOVA.Greffes ßKb. Les cellules divisées de souris greffées ont été divisées en deux secteurs, les cellules fortement divisées tombant dans le secteur dans lequel la VCT a été diluée au-delà de la limite de détection. (b) FucciOT-I total divisé en KbKO.ßOVA et KbKO.ßOVA.Greffes bipolaires ßKb, valeurs de P calculées par test t apparié à deux queues. (c) % fortement divisé et (d)% FucciG + OT-I dans le LN rénal drainant et les greffes de souris greffées bipolaires. Les valeurs de P ont été calculées par test t apparié à deux queues. Les résultats pour les souris individuelles sont reliés par des lignes pointillées, n = 6 souris receveuses regroupées à partir de deux expériences indépendantes.
L’IL-2 est plus importante au site de l’inflammation
Nous montrons que l’expression de l’IL-2Ra était plus importante pour la prolifération et l’accumulation des lymphocytes T CD8+ dans le parenchyme périphérique (greffes d’îlots) que dans le site d’amorçage dans le LN drainant (Fig. 7 bis). De plus, nous avons analysé la réponse dans un deuxième site éloigné du site d’amorçage, c’est-à-dire non drainant LN. Des cellules T CD8+ marquées au CTV provenant de souris OT-I.IL-2RaKO (IL-2Ra−CD45.2+) et OT-I/Ly5.1 (IL-2Ra+, CD45.1 + CD45.2+) ont été co-transférées dans des souris hôtes B6.CD45.1 (CD45.1+) avant de recevoir une seule greffe de B6.Îlots ßOVA. Les signatures alléliques distinctes de CD45 de chacune des populations de lymphocytes T transférées (en combinaison avec la coloration de CD8 et de Va2) nous ont permis de quantifier et de comparer le rapport POIDS divisé : IL-2RaKO OT-I (Fig. 7a, Fig. supplémentaire. 3). L’IL-2Ra en POIDS a nettement surpassé l’IL-2Ra KO OT-I au site du greffon par rapport à l’IL-2ra drainant (P = 0,025, test t apparié à deux queues) ou non drainant (P = 0,044, test t apparié à deux queues) LN. Ceci est compatible avec une dépendance accrue des lymphocytes T CD8 + à l’IL-2 au moment de la rencontre secondaire avec l’antigène au site de l’inflammation par rapport à l’amorçage initial dans la LN drainante.
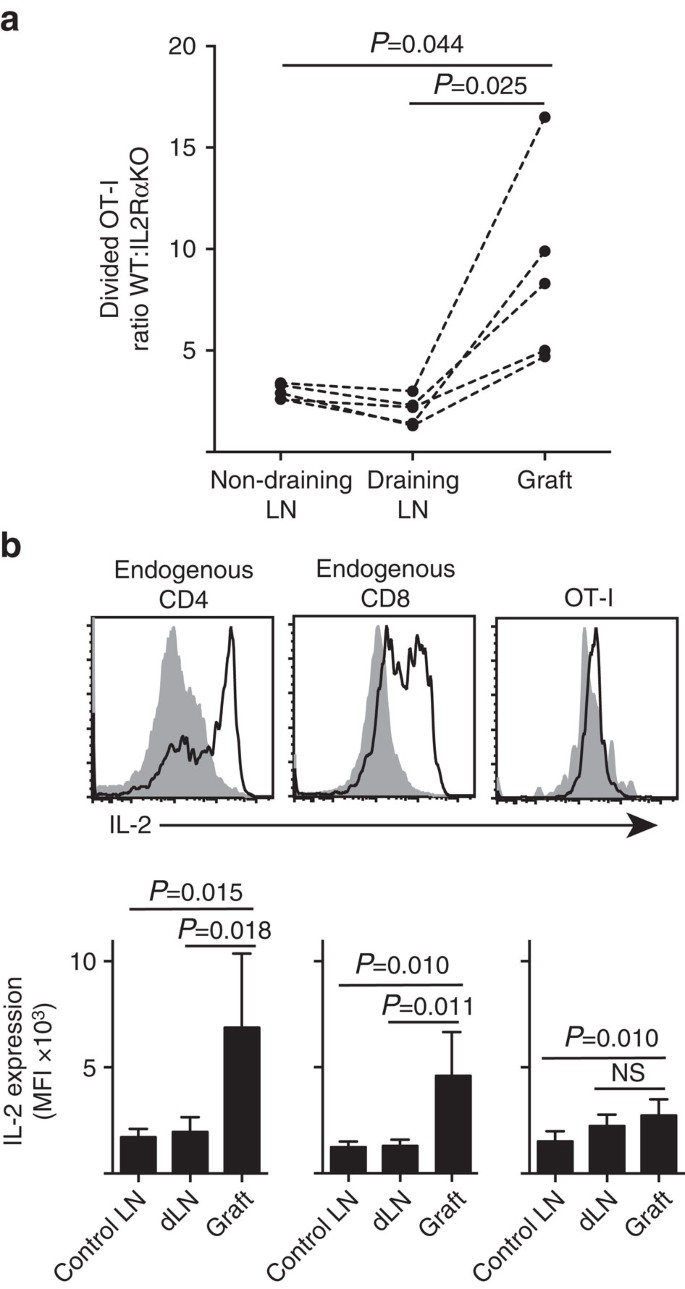
( a) Rapport des cellules IL-2Ra divisées en POIDS: IL-2Ra KO OT-I récupérées à partir de B6.Greffe d’îlots ßOVA, LN rénale drainante et LN inguinale non drainante après co-transfert (106 de chacun) dans des souris hôtes B6.CD45.1. Les ratios ont été calculés pour des organes individuels avec des résultats pour des souris individuelles reliées par des lignes pointillées et comparées par un test t apparié à deux queues. Résultats présentés pour n = 5 souris receveuses et représentatifs de trois expériences indépendantes. (b) Expression de l’IL-2 dans les cellules endogènes CD4+ et CD8+ et cellules OT-I transférées chez les receveurs B6 de B6.Greffes d’îlots ßOVA. Les panneaux supérieurs montrent des diagrammes de cytométrie en flux représentatifs pour le LN rénal drainant le greffon (gris solide) et le greffon (ligne noire). Les panneaux inférieurs résument l’intensité fluorescente moyenne (IMF) de l’expression de l’IL-2 pour le LNS rénal prélevé sur des souris non greffées (LN témoin), ainsi que le LN rénal greffé et drainant (dLN) de souris greffées. Les résultats présentés sous forme de moyenne + d.s., n = 6 ont été regroupés à partir de deux expériences indépendantes et comparés par un test t non apparié à deux queues avec la correction de Welch.
La dépendance accrue à l’IL-2 pour la prolifération des lymphocytes T CD8+ au site de l’inflammation a déduit une nécessité pour la production locale d’IL-2. Par conséquent, nous avons examiné le potentiel de diverses cellules T (CD4+ et CD8+ endogènes dérivés de l’hôte ainsi que les cellules T CD8+ OT-I transférées) pour la capacité de produire de l’IL-2 (Fig. 7b). Des suspensions cellulaires préparées à partir de greffons ou de LN ont été brièvement (4 h) restimulées avec PMA et ionomycine avant coloration pour l’expression de l’IL-2 intracellulaire. L’examen des lymphocytes T CD4+ et CD8+ dérivés de l’hôte endogène a fourni des preuves convaincantes de la production d’IL-2 au site de l’inflammation du greffon avec une nette augmentation de l’IMF de la coloration de l’IL-2 par rapport à la LN drainante ou non drainante. Les taux d’IL-2 dans les lymphocytes T CD8+ OT-I au site de l’inflammation ont été modérément augmentés par rapport à ceux de la LN non drainante, mais ne différaient pas significativement de ceux de la LN drainante. Une interprétation de ces données est que l’interaction apparentée de l’OT-I avec les cellules parenchymateuses induit une prolifération rapide mais une production médiocre d’IL-2, de sorte que les OT-I dépendent de l’IL-2 paracrine dérivée des lymphocytes T CD4+ et CD8 + endogènes dans l’environnement de greffe local. Cependant, une expérience supplémentaire a indiqué que l’IL-2 exogène en l’absence d’antigène parenchymateux ne pouvait pas entraîner l’expansion cellulaire OT-I CD8+. L’IL-2 (hIL-2 recombinant, 25 000 UI) a été administré par voie intrapéritonéale à des souris B6 ayant reçu des greffons bipolaires de B6.Îlots ßOVA et B6. La comparaison de la récupération de l’OT-I dans des organes prélevés sur des souris traitées à l’IL-2 ou au véhicule au jour 6 après la greffe n’a montré aucune augmentation significative de l’accumulation de cellules OT-I divisées dans deux sites dépourvus d’antigène parenchymateux, à savoir des greffes d’îlots B6 (3 ±3 dans le véhicule traité contre 49 ±64 chez les souris traitées à l’IL-2, P = 0.342) et LN inguinale non drainante (1 648 + 633 chez les souris traitées par véhicule contre 1 660 + 1 023 chez les souris traitées par IL-2, P = 0,987, moyenne ±d.s., n = 3, test t non apparié à deux queues avec correction de Welch).