Qu’Est-Ce Que La Validation D’Un Système Informatique et Comment Le Faire Correctement ?

Le processus de validation du logiciel garantit que le système correspond à son utilisation prévue et fonctionne comme il se doit. La validation des systèmes informatiques (CSV) pour l’informatique de laboratoire est essentielle car les entreprises réglementées doivent assurer la sécurité de leurs produits pour les consommateurs, et leurs systèmes informatiques de laboratoire (LIMS, ELN, CDS) en font partie intégrante. Compte tenu de son importance, la validation a tendance à être considérée comme déroutante et difficile à exécuter correctement. Bien sûr, il est possible de le faire correctement, et CSols en a la preuve. En près de 30 ans de CSV, nous n’avons entendu aucun de nos clients recevoir un formulaire FDA 483.
La validation fait partie du cycle de vie du développement logiciel. Dans ce blog, nous examinerons ce que cela signifie et comment le faire pour que votre système soit défendable lors d’un audit réglementaire.
- Bases de la validation des systèmes informatiques
- Le processus de validation
- Le Plan Directeur de validation
- La relation Entre la collecte des exigences et les tests de qualification
- ALCOA+ et Intégrité des données
- L’avenir du CSV: Assurance du système informatique
- Défis de la validation des systèmes informatiques
Bases de la validation des systèmes informatiques
Aucune discussion sur la validation des systèmes informatiques n’est complète sans un aperçu de la législation qui l’entoure. Aux États-Unis, la Food and Drug Administration (FDA) réglemente des industries spécifiques qui ont un impact direct sur la santé des consommateurs, notamment les produits pharmaceutiques, les cosmétiques et les aliments et boissons. Ces industries ont une responsabilité supplémentaire de s’assurer que leurs produits sont sûrs et que leurs données sont sécurisées. La législation pertinente traitant des aspects de la validation des systèmes informatiques aux États-Unis provient du Code of Federal Regulations (CFR), plus précisément de la partie 11 du 21 CFR (Partie 11), traitant des enregistrements et des signatures électroniques. Des organismes gouvernementaux et des réglementations similaires s’appliquent également dans d’autres pays.
La partie 11 exige que les documents et signatures électroniques soient considérés comme exacts, fiables, facilement récupérables et sécurisés, afin de remplacer légalement les documents papier et les signatures manuscrites. La validation de votre système informatique est le principal moyen de déterminer que les enregistrements et les signatures électroniques peuvent être utilisés de cette manière.
Le processus de validation
La validation peut prendre de nombreuses formes au cours du cycle de vie du système informatique, selon qu’il s’agit d’une nouvelle implémentation ou d’une mise à niveau vers un système existant. Pour les nouveaux systèmes que l’utilisateur espère pouvoir résoudre un problème actuel, la validation se fait à partir de zéro. Pour un système existant qui a besoin d’une mise à niveau ou élargit la portée de son utilisation prévue, il est nécessaire de maintenir le système dans un état validé en testant les nouvelles capacités avant de les mettre en production. Le processus de validation se termine lorsqu’un système est retiré et que ses données sont migrées avec succès vers un nouveau système ou archivées. La figure ci-dessous montre comment la validation soutient le cycle de vie du projet.

Le Plan Directeur de validation
Votre plan directeur de validation vous guide tout au long du processus de validation et devient une sorte de liste de contrôle pour vous assurer que tout se passe comme il se doit. Une fois que vous avez évalué l’état tel quel de votre système, le plan directeur de validation comprend toutes les autres étapes que vous prendrez pour vous assurer que votre système est validé dans son état actuel et adapté à l’utilisation prévue.

Le plan directeur de validation devrait tenir compte de la collecte des exigences, d’une évaluation des risques fonctionnels, d’une matrice de traces, de protocoles et de tests IQ OQ PQ et de procédures de contrôle des changements avec examens périodiques. Chaque partie du plan directeur de validation est exécutée dans un ordre défini. Vos exigences doivent être complètes et l’évaluation des risques effectuée avant de passer au développement de la matrice de traces, puis de faire les tests. De cette façon, vous minimisez le risque de devoir revenir en arrière et développer de nouveaux cas de test tard dans le processus.
La relation Entre la collecte des exigences et les tests de qualification
Il est essentiel de s’assurer que vos exigences et spécifications sont bien définies et approuvées avant de valider le système informatique. Le modèle en V de validation est couramment utilisé pour visualiser la relation entre les exigences et les spécifications et les tests effectués sur celles-ci (voir le diagramme ci-dessous). Les tests de qualification (sur le côté droit du V) sont conçus en fonction de votre utilisation prévue et de la fonctionnalité requise pour répondre à cette utilisation (représentée sur le côté gauche du V).
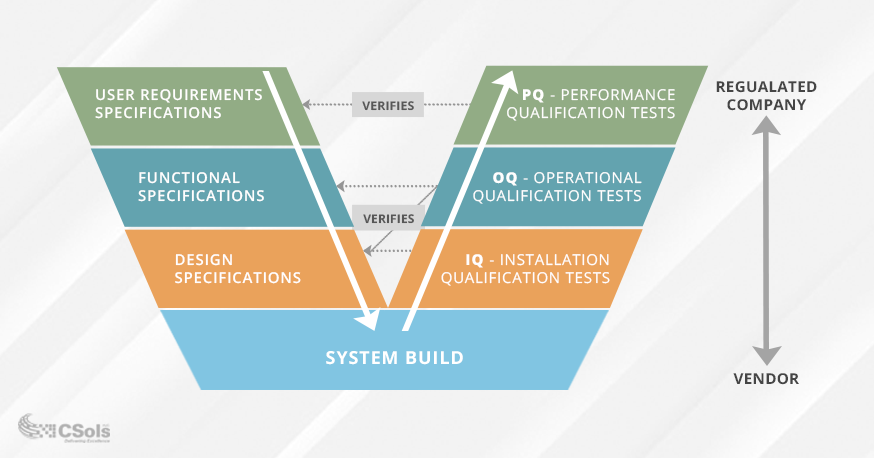
- La spécification des exigences de l’utilisateur documentera ce que les utilisateurs ont besoin du système pour faire, et PQ testing vérifie ces exigences.
- La Spécification des exigences fonctionnelles documentera la fonctionnalité du système requise pour répondre à la Spécification des exigences de l’utilisateur, et les tests OQ vérifient ces spécifications.
- Les spécifications de conception documenteront la conception du système (p. ex. modules, unités, etc.), et les tests IQ vérifient que l’installation du système répond à ces exigences de conception.
Les tests IQ / OQ / PQ sont sans doute une partie essentielle du processus de validation. La réussite des tests permettra de vérifier que votre système fonctionne comme prévu et est adapté à l’utilisation prévue dans votre environnement. Il est recommandé d’approuver les exigences de l’utilisateur et les spécifications fonctionnelles avant les tests afin d’éviter le fluage de la portée et d’éventuels nouveaux tests.
Pour en savoir plus sur les tests IQ OQ PQ, regardez notre webinaire.
Les personnes qui écrivent et exécutent vos tests IQ/OQ/PQ doivent bien connaître votre système informatique de laboratoire (LIMS, ELN, CDS) et votre utilisation prévue. Si votre personnel interne n’a pas la bande passante ou l’expérience nécessaires pour effectuer des tests appropriés, vous devez travailler avec des consultants CSV qualifiés, tels que CSols, qui possèdent l’expérience requise avec vos systèmes informatiques.
ALCOA+ et Intégrité des données
L’importance des données informatiques de laboratoire ne peut être sous-estimée. Lorsque vous disposez de données dans un environnement validé, vous devez vous assurer que vos données restent sécurisées et fiables. L’acronyme ALCOA identifie les cinq principes de base de l’intégrité des données : les données doivent être attribuables, Lisibles, Contemporaines, Originales et Exactes. Plus récemment, quatre principes supplémentaires ont été ajoutés, de sorte que l’acronyme est maintenant ALCOA +. Les quatre ajouts sont Complets, Cohérents, Durables et Disponibles.

L’intégrité des données fait partie intégrante de toutes les activités de validation. Suivre les principes d’ALCOA+ garantit que votre système capture, produit, rapporte, transfère et stocke des données sécurisées, récupérables à volonté et fiables.
L’avenir du CSV: Assurance du système informatique
Bien que nous attendions toujours que la FDA publie ses directives attendues sur l’assurance du système informatique (CSA), cela arrive. À la base, l’ASC renforce une approche axée sur le risque qui élargit les principes du GAMP 5 de compréhension des produits et des processus, de gestion des risques de qualité et de mise à profit des activités des fournisseurs. Le risque est évalué en fonction de la vue d’ensemble du processus opérationnel global. Cela met davantage l’accent sur l’efficacité des tests, en se concentrant sur les tests qui garantissent que le système est adapté à son objectif.
Défis de la validation des systèmes informatiques
La validation des systèmes informatiques peut comporter des défis, notamment le risque de défaillance du système, les politiques restrictives de l’entreprise et les exigences réglementaires de plus en plus strictes. Un autre problème important est le moment où les utilisateurs doivent équilibrer l’équation risque / coût après la définition des catégories de risque. Une approche basée sur les risques de la CSV peut aider à atténuer certains de ces défis.
Les étapes supplémentaires que vous pouvez suivre pour éviter les problèmes de validation sont les suivantes:
- S’assurer que votre plan directeur de validation est complet et respecte les meilleures pratiques et réglementations de l’industrie
- Définissant le système informatique (c.-à-d. le matériel, les logiciels, les personnes et les processus) qui doit être validé
- En fournissant des limites claires pour vos résultats attendus; c.-à-d., ce qui est acceptable
- Décrire et répondre aux exigences et spécifications approfondies pour l’utilisation prévue du logiciel
L’exécution correcte d’une validation de système informatique est un processus impliqué, mais vous pouvez le faire lorsque vous avez la bonne expertise. Si vous n’êtes pas sûr que votre personnel interne possède l’expérience CSV nécessaire, contactez-nous.