Réarrangement de Claisen
Le réarrangement de Claisen (à ne pas confondre avec la condensation de Claisen) est une puissante réaction chimique de formation de liaisons carbone–carbone découverte par Rainer Ludwig Claisenin en 1912. Le chauffage d’un éther allylique vinylique va initier un réarrangement a-sigmatropique pour donner un carbonyle γ, δ-insaturé.
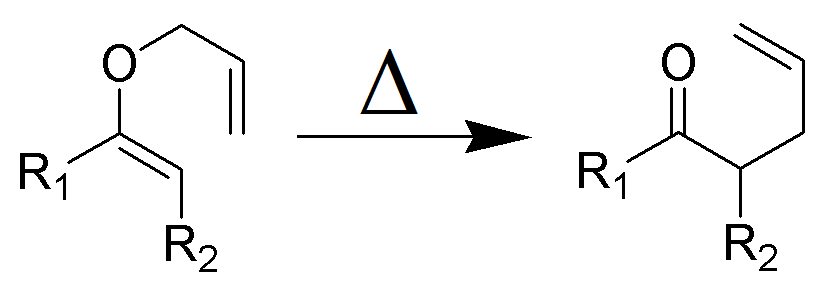
Figure 1: Wikimédia (travail propre) – réarrangement sigmatropique.
Le réarrangement de Claisen est une réaction péricyclique exothermique concertée (clivage de liaison et recombinaison). Les règles de Woodward–Hoffmann montrent une voie de réaction suprafaciale et stéréospécifique. La cinétique est du premier ordre et l’ensemble de la transformation passe par un état de transition cyclique fortement ordonné et est intramoléculaire. Les expériences croisées éliminent la possibilité que le réarrangement se produise via un mécanisme de réaction intermoléculaire et sont compatibles avec un processus intramoléculaire.
Des effets de solvant importants sont observés dans le réarrangement de Claisen, où les solvants polaires ont tendance à accélérer la réaction dans une plus grande mesure. Les solvants de liaison à l’hydrogène ont donné les constantes de vitesse les plus élevées. Par exemple, les mélanges de solvants éthanol / eau donnent des constantes de vitesse 10 fois plus élevées que le sulfolane. Il a été démontré que les réactifs organoaluminiques trivalents, tels que le triméthylaluminium, accélèrent cette réaction.
Le premier réarrangement de Claisen rapporté est le réarrangement sigmatropique d’un éther allylphénylique en intermédiaire 1, qui se tautomérise rapidement en un phénol ortho-substitué.
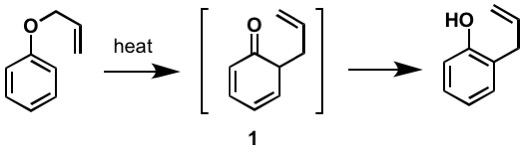
Figure 2: Par Kchemyoung (Travail propre), via Wikimedia Commons
Réarrangement Ireland-Claisen
Le réarrangement Ireland–Claisen est la réaction d’un carboxylate allylique avec une base forte (telle que le diisopropylamide de lithium) pour donner un acide carboxylique γ, δ-insaturé. Le réarrangement passe par le silylcétène acétal, qui est formé en piégeant l’énolate de lithium avec du chlorotriméthylsilane. Comme le Bellus-Claisen (ci-dessus), le réarrangement Ireland-Claisen peut avoir lieu à température ambiante et au-dessus. Les acétals de silylcétène configurés en E et en Z conduisent respectivement à des produits réarrangés anti et syn. Il existe de nombreux exemples de réarrangements énantiosélectifs d’Ireland-Claisen trouvés dans la littérature pour inclure des réactifs chiraux au bore et l’utilisation d’auxiliaires chiraux.
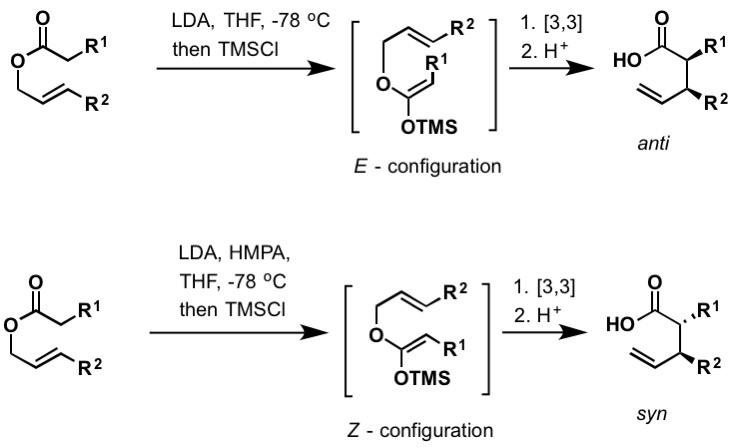
Figure 5: Image utilisée avec autorisation (CC BY-SA 4.0; Kchemyoung)
Réarrangement de Johnson-Claisen
Le réarrangement de Johnson–Claisen est la réaction d’un alcool allylique avec un orthoester pour donner un ester γ, δ-insaturé. Des acides faibles, tels que l’acide propionique, ont été utilisés pour catalyser cette réaction. Ce réarrangement nécessite souvent des températures élevées (100 à 200 ° C) et peut prendre de 10 à 120 heures. Cependant, le chauffage assisté par micro-ondes en présence d’argile KSF ou d’acide propionique a montré des augmentations spectaculaires de la vitesse de réaction et des rendements.
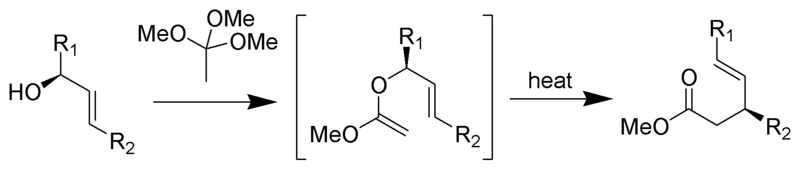
Mécanisme:
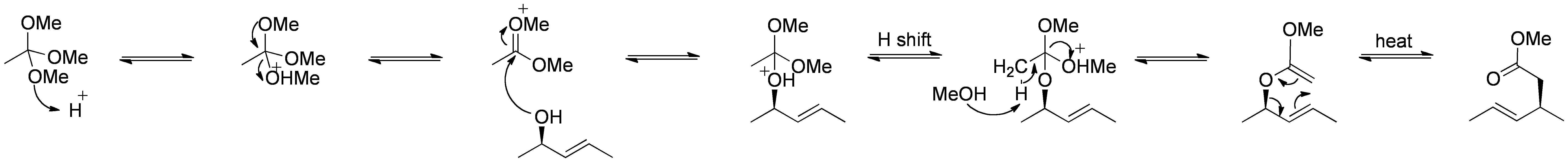
Par Self Made by RAN 10 (-), via Wikimedia Commons
Réarrangement de Photo-Claisen
Le réarrangement de photo-Claisen est étroitement lié au réarrangement de photo-Fries, qui procède par un mécanisme radical similaire. Les éthers aryliques subissent le réarrangement photo-Claisen, tandis que le réarrangement photo-Fries utilise des esters aryliques.
Hétéro -Claisens
Aza-Claisen
Un iminium peut servir de fragment lié au pi dans le réarrangement.
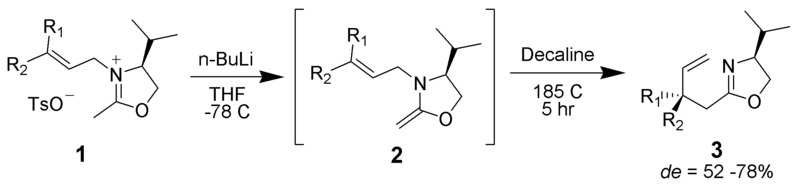
Par aucun auteur lisible par machine fourni. ~ K supposé (basé sur les revendications de droits d’auteur). , via Wikimedia Commons
Oxydation du chrome
Le chrome peut oxyder les alcools allyliques en cétones insaturées alpha-bêta du côté opposé de la liaison insaturée de l’alcool. Ceci se fait par une réaction hétéro-Claisen concertée, bien qu’il existe des différences mécanistiques puisque l’atome de chrome a accès à des orbitales de coque d qui permettent la réaction sous un ensemble de géométries moins contraint.
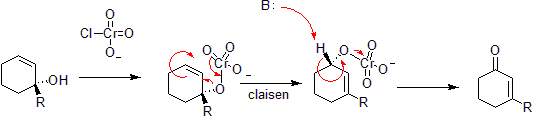
Par Le téléchargeur original était Takometer sur Wikipedia anglais – Le réarrangement du Phosphorimidate ou la réaction de Staudinger-Claisen installe un phosphite à la place d’un alcool et profite de la réduction de Staudinger pour le convertir en une imine. Le Claisen ultérieur est entraîné par le fait qu’une double liaison P = O est plus favorable énergétiquement qu’une double liaison P = N.
.png?revision=1&size=bestfit&width=660&height=112)
Par Howcheng à en.wikipédia, via Wikimedia Commons
Réarrangement d’Overman
Le réarrangement d’Overman (nommé d’après Larry Overman) est un réarrangement de Claisen des trichloroacétimidés allyliques en trichloroacétamides allyliques.
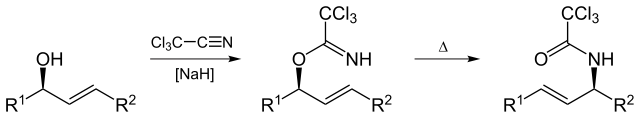
Par Yikrazuul (Son propre travail), via Wikimedia Commons
Le réarrangement d’Overman est applicable à la synthèse de vicinol diamino comp à partir de 1,2 diol allylique vicinal.
Réarrangement Claisen Zwitterionique
Contrairement aux réarrangements Claisen typiques qui nécessitent un chauffage, les réarrangements Claisen zwitterioniques ont lieu à température ambiante ou en dessous de celle-ci. Les ions acyl-ammonium sont hautement sélectifs pour les énolates Z dans des conditions douces
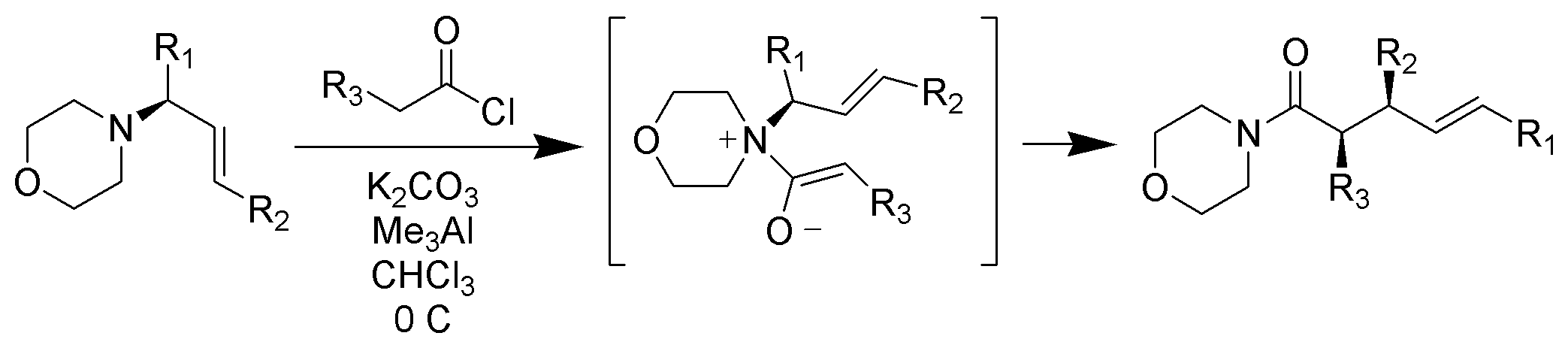
https://upload.wikimedia.org/wikiped…ent_Scheme.png
Réarrangement de Claisen dans la nature
L’enzyme Chorismate mutase (EC 5.4.99.5) catalyse le réarrangement de Claisen de l’ion chorismate en ion préphénate, un intermédiaire clé dans la voie de l’acide shikimique (voie biosynthétique vers la synthèse de la phénylalanine et de la tyrosine).
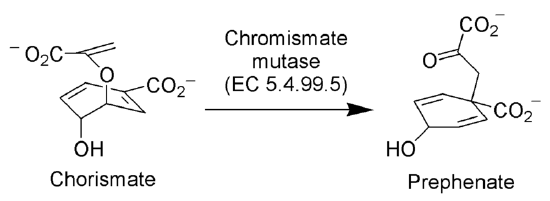
Par aucun auteur lisible par machine fourni. ~ K supposé (basé sur les revendications de droits d’auteur). , via Wikimedia Commons