Valeur pronostique de la taille de la tumeur dans le cancer colorectal de stade II et III dans la population tunisienne
-
La taille de la tumeur (TuS) a été rapportée comme pronostique dans le cancer colorectal.
-
Dans notre étude, nous avons étudié le rôle pronostique du TuS et identifié une valeur de coupure avec les performances de prédiction les plus élevées.
-
Une taille de 4 cm avait un impact pronostique et interférait avec d’autres facteurs pronostiques.
-
Nous avons observé que l’âge ≥65 ans, le stade III, l’invasion veineuse et la nP + supérieure à 3 étaient des facteurs pronostiques significatifs chez les patients présentant un TuS ≥4, mais que seul le stade III était un facteur pronostique indépendant dans l’analyse multivariée.
-
L’administration de chimiothérapie a été le seul facteur ayant un impact significatif sur la survie dans les analyses univariées et multivariées chez les patients présentant un TuS inférieur à 4 cm.
Le cancer colorectal (CRC) est le troisième cancer le plus fréquent dans le monde et la deuxième cause de décès liés au cancer dans les pays occidentaux. En Tunisie, il représente un problème de santé publique. Son incidence a augmenté au cours des 15 dernières années. Malgré l’amélioration des procédures de diagnostic et de travail et également en raison de l’absence de programmes de dépistage, la plupart des cas de CRC en Tunisie restent détectés à un stade localement avancé (pT3–T4, nœud positif) ou métastatique. Le pronostic s’est amélioré ces dernières années, avec une prise en charge multidisciplinaire; La survie globale à 5 ans est estimée à environ 70% au stade II et à 50% au stade III. De nombreux efforts ont été déployés pour affiner les facteurs d’évaluation des risques dans le cadre du CRC afin d’identifier les patients les plus susceptibles de bénéficier d’un traitement adjuvant. Ces facteurs sont principalement cliniques, pathologiques et récemment moléculaires (instabilité des microsatellites / stabilité des microsatellites, ADNc), certains d’entre eux sont encore hors de portée dans de nombreux pays. La taille de la tumeur (TuS) est un marqueur de survie de substitution dans de nombreux cancers gastro-intestinaux: cancer gastrique, tumeur stromale gastro-intestinale, tumeurs carcinoïdes. Sa pertinence dans le cadre de la Convention relative aux droits de l’enfant n’est pas claire, avec des résultats contradictoires dans plusieurs séries rapportées. Le TuS n’a pas intégré les lignes directrices internationales comme l’un des marqueurs à prendre en compte lors de l’évaluation du risque et de l’indication de la chimiothérapie adjuvante. Dans une étude récente avec évaluation pathologique de 1443 nouveaux cas de CRC dans la région centrale de la Tunisie, 67,5% des patients avaient un TuS supérieur à 5 cm, ce constat est complètement différent des cas dans les pays occidentaux. Dans notre étude actuelle, nous avions pour objectif d’étudier la performance du TuS dans la prédiction de la survie aux stades II et III du CRC et d’étudier la relation entre le TuS et les facteurs pronostiques connus.
Patients & méthodes
Nous avons passé en revue rétrospectivement une cohorte de 257 patients ayant reçu un diagnostic d’adénocarcinome du côlon et/ou du rectum, traités dans deux centres d’oncologie : l’Hôpital Abderrahmen Mami et l’Hôpital Clinique Taoufik entre 2003 et 2014. Nous avons inclus des cas de stade II-III, selon la 7ème édition du Comité Mixte Américain sur le Cancer (AJCC) / Union Internationale Contre le Cancer (UICC), traités avec une intention curative. Nous n’avons pris en compte que les patients ayant un bilan complet et des données de pathologie disponibles, y compris les TuS et les données de suivi. Au cours de la période d’étude, le suivi a été programmé après la fin du traitement curatif, tous les 3-4 mois au cours des 2 premières années, tous les 6 mois des années 3 à 5 et annuellement par la suite. À chaque visite, les patients ont subi un examen physique et ont été contrôlés pour détecter les symptômes et les toxicités thérapeutiques. Une échographie abdominale et une radiographie thoracique ont été réalisées tous les 6 mois, à partir de 2012, une tomodensitométrie thoracoabdominale et des marqueurs tumoraux (antigène carcinoembryonique, CA19–9) tous les 6 mois.
Le TuS a été défini comme l’extension tumorale horizontale mesurée par le diamètre maximal de la tumeur. Nous avons utilisé la caractéristique de fonctionnement du récepteur (ROC) pour déterminer la performance du TuS dans la prédiction de la survie et pour identifier une valeur de coupure corrélée à la survie. Nous avons également comparé les caractéristiques des deux groupes en fonction de la valeur de coupure et étudié les facteurs pronostiques dans des analyses univariées et multivariées dans chaque groupe.
Analyse statistique
Toutes les analyses ont été effectuées à l’aide du logiciel SPSS 20. Nous avons analysé les courbes ROC et analysé l’aire sous la courbe (ASC) pour déterminer la précision des UT dans la prédiction de la survie. Une ASC de 1,0 était une prédiction sans erreur du cancer chez les patients, alors qu’une ASC de 0,50 représente une demi-probabilité d’une prédiction précise de l’état du cancer. Plus l’AUC–ROC est élevé, plus le pouvoir discriminatoire des UT pour le résultat est grand. OS a été défini comme l’heure entre la date du diagnostic et le décès de toute cause ou perte au suivi ou aux dernières nouvelles. OS a été évalué selon la méthode de Kaplan–Meier. Les facteurs pronostiques ont été évalués par une analyse univariée à l’aide du test log-rank et par une analyse multivariée à l’aide d’un modèle de risques proportionnels de Cox. Une valeur de p inférieure à 0,05 a été considérée comme statistiquement significative.
Résultats
Pour l’ensemble de la population, l’âge moyen était de 59 ans (entre 25 et 85 ans), 57 ans.2% étaient des hommes. Nous avons observé une maladie de stade III chez 53% des patients dont 37,5% étaient pN2. Une chimiothérapie adjuvante a été administrée à tous les patients atteints de stade III (97,7% contenant de l’oxaliplatine). Dans la maladie de stade II, 53% des cas ont reçu une chimiothérapie, ils étaient au stade pT4 dans 22,5%, moins de 12 ganglions lymphatiques enlevés dans 28% et ont subi une chirurgie d’urgence dans 15% des cas. Le TuS moyen était de 7 cm.
Dans l’analyse ROC, l’ASC des UT dans la prédiction de la survie a été montrée à la figure 1. La performance du TuS dans la prédiction de la survie a été comparée à la performance par rapport au nombre de ganglions lymphatiques impliqués. L’AUC était de 0.62 ± 0,048 pour le TuS et 0,60 ± 0,56 pour les ganglions lymphatiques positifs.

Une taille de 4 cm a été identifiée comme prédicteur de la survie avec une sensibilité de 88,2% et une spécificité de 59,2%. Nous avons observé 98 patients avec une TuS ≤4 cm et 159 patients avec une TuS supérieure à 4 cm. Les patients présentant un TuS supérieur à 4 cm étaient plus susceptibles d’avoir un cancer situé dans le côlon (81,1 vs 70,4%, p = 0,002) et généralement pT4 (44 vs 22.4%, p = 0,0001). Nous n’avons pas observé de différence significative selon le sexe, la chirurgie d’urgence, le taux de ganglions lymphatiques retirés de moins de 12, le nombre de ganglions lymphatiques positifs, le stade et l’administration d’oxaliplatine entre les patients TuS ≤4 cm et les patients avec TuS supérieur à 4 cm (tableau 1).
| Variables | Taille de la tumeur ≤4 cm, % (n = 89) | Taille de la tumeur > 4 cm, % (n = 159) | valeur p |
|---|---|---|---|
| Âge: | |||
| – Âge médian (moyen) – ≥65 ans | 56 73.4 (72) 22.6 (26) |
62.8 (100) 38.2 (59) |
0.32 0.07 |
| Sexe: | |||
| – Mâle – Femelle |
50 (49) 50 (49) |
57.2 (91) 43.8 (68) |
0.25 |
| IMC†: | |||
| – <30 – ≥30 |
91.3 (63) 8.7 (6) |
85.8 (85) 14.2 (14) |
0.28 |
| Emplacement: | |||
| – Côlon – Rectum |
70.4 (69) 29.6 (29) |
81.1 (129) 8.9 (30) |
0.002* |
| Urgence chirurgicale: | |||
| – Oui | (14) (84) |
11.3 (18) 88.7 (141) |
0.52 |
| <12 ganglions lymphatiques examinés§: | |||
| – Oui | 34.6 (34) 65.4 (64) |
44.6 (71) 55.3 (88) |
0.11 |
| pN+: | |||
| – 1–3 – >3 |
83.6 (82) 16.4 (16) |
77.9 (124) 22.1 (35) |
0.26 |
| pT: | |||
| pT1–pT3 pT4 |
77.6 (76) 22.4 (22) |
55.9 (89) 44.1 (70) |
<0.01* |
| Stage: | |||
| – Stage II – Stage III |
47.9 (47) 52.1 (51) |
47.1 (75) 42.9 (84) |
0.9 |
| Adjuvant therapy: | |||
| – Yes – No |
76.6 (75) 23.4 (23) |
79.2 (126) 20.8 (33) |
0.6 |
| Oxaliplatine: | 0.48 | ||
| – Yes – No |
48.9 (48) 51.1 (50) |
53.4 (85) 46.6 (74) |
|
| Relapse rate (%) | 35.2 | 37.1 | 0.75 |
| TTR‡ (mois) | 26 | 34 | 0.13 |
† Disponible uniquement chez 168 patients.
‡ Il est temps de rechuter.
§ Dans les deux étapes II et III.
* Valeurs p significatives.
Reproduit avec l’autorisation de © Oxford University Press (2017).
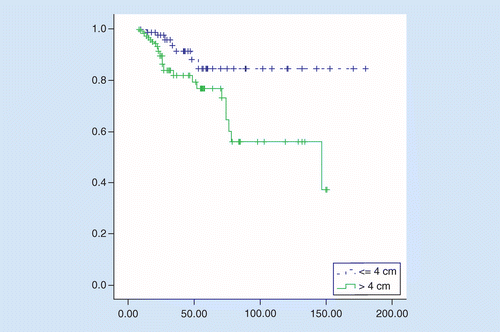
L’OS était significativement meilleur dans les UT ≤4 cm par rapport aux UT supérieures à 4 cm, la survie moyenne était de 158 par rapport à 106 mois, le rapport de risque = 2.92 (IC À 95% : 1,27-6,75, p = 0,01). le taux de survie à 5 ans des patients était de 84 % chez les patients présentant une TuS ≤ 4 cm et de 76% chez les patients présentant une TuS supérieure à 4 cm (p = 0,008; voir Figure 2).
Les facteurs pronostiques ont été examinés dans les deux groupes. En analyse univariée, nous avons observé un impact négatif significatif de l’âge ≥65 ans, du stade III, de l’invasion veineuse et de la nP + supérieure à 3 sur la survie chez les patients présentant un TuS supérieur à 4 cm. En analyse multivariée uniquement, le stade III était un facteur pronostique indépendant. Chez les patients présentant une UT ≤4 cm, la chimiothérapie en milieu adjuvant était le principal facteur ayant un impact significatif sur la survie dans les analyses univariées et multivariées, il n’y avait pas d’impact pronostique des autres facteurs testés (tableau 2).
| Variables | Taille de la tumeur < 4 cm (n = 159) | Taille de la tumeur ≥4 cm (n = 89) | ||
|---|---|---|---|---|
| 5- OS de l’année (%) | HR (IC À 95 %) | OS de 5 ans (%) | HR (IC À 95%) | |
| Âge: | ||||
| – <65 années – ≥65 ans |
87 78 |
1.07 (0.208−5.531) | 82 60 |
2.47 (1.35–5.88)* |
| pN+: | ||||
| – 1-3 – >3 |
78 82 |
2.14 (0.41–11.08) | 79 65 |
2.838 (1.25–6.41)* |
| pT: | ||||
| – pT1–pT3 – pT4 |
84 82 |
1.51 (0.29–7.79) | 84 74 |
1.44 (0.67–3.09) |
| Venous invasion: | ||||
| – Yes – No |
80 81 |
0.97 (0.189–5.08) | 63 84 |
2.94 (1.14–7.78)* |
| Stage: | ||||
| – Stage II – Stage III |
77 86 |
0.651 (0.148–2.955) | 85 58 |
0.285 (0.123–0.66)* |
| Adjuvant therapy: | ||||
| – Yes – No |
94 58 |
0.135 (0.025–0.696)* | 78 67 |
0.641 (0.257–1.6) |
| Oxaliplatine: | ||||
| – Yes – No |
92 83 |
0.28 (0.034–2.39) | 78 70 |
0.441 (0.19–1.02) |
| Tumor location: | ||||
| – Colon – Rectum |
90 75 |
0.428 (0.095-1.931) | 75 80 |
2.699 (0.806–9.03) |
* Valeurs RH importantes.
HR: Rapport de risque; OS: Survie globale.
Discussion
De nos jours, dans les pays occidentaux, l’intégration de programmes de dépistage occulte a conduit au diagnostic du CRC à des stades plus précoces. Dans une étude récente basée sur les données du SEER entre 2006 et 2012, 38% des cas de cancer du côlon et 43% des cas de cancer du rectum ont été diagnostiqués à un stade précoce. Dans les pays à revenu faible et intermédiaire, un tel programme de dépistage n’est pas disponible; et la plupart des cas sont diagnostiqués à un stade régional ou avancé avec une TuS élevée. L’identification des facteurs pronostiques est un outil important pour améliorer les résultats dans ces pays. Notre étude a étudié le rôle pronostique de la TS dans les stades II et III de la CRC dans la population tunisienne. Nous avons observé que le TuS avait non seulement un impact sur la survie, mais interférait également avec d’autres facteurs pronostiques. Le stade III était un facteur pronostique indépendant dans les tumeurs à volume élevé, alors que de nombreux facteurs pronostiques “classiques” n’avaient aucun impact dans les tumeurs plus petites. Plusieurs études ont rapporté la valeur pronostique du TuS avec une diminution du TuS associé à la survie. Dans une étude de Kornprat et al., Le TuS était significativement associé à une survie sans progression et spécifique au cancer dans les analyses univariées et multivariées dans le côlon, mais pas dans les cancers du rectum. Dans notre série, un TuS plus élevé était plus fréquent dans la localisation du cancer du côlon. En fait, le cancer du côlon peut rester asymptomatique plus longtemps, ce qui explique un TuS plus élevé au diagnostic par rapport au cancer du rectum. Cependant, il n’y avait aucune différence de survie entre les tumeurs ≥4 cm situées dans le côlon et les tumeurs ≥4 cm situées dans le rectum. Il n’y avait pas non plus d’impact de la localisation de la tumeur dans une tumeur plus petite (< 4 cm). Ainsi, sur la base de cette analyse, le TuS n’a pas joué de rôle dans la prédiction du pronostic en fonction de la localisation de la tumeur (côlon vs rectum). Saha et coll. rapporté dans leur grande série de patients que le TuS est positivement corrélé avec des facteurs pronostiques importants et a un impact négatif sur la survie dans le cancer du côlon. Son rôle dans le cancer du rectum n’est toujours pas clair.
Un TuS plus élevé a également été associé au stade pT4, dont le pronostic était le plus mauvais que le stade T1–2N1 (essai intergroupe INT-0089). La charge tumorale peut refléter la capacité d’une tumeur à se disséminer à travers la paroi intestinale, les ganglions et d’autres organes. En fait, dans notre étude, le TuS avait une valeur d’analyse ROC prédictive proche de la valeur prédictive du nombre de lymphe positive. Dans les tumeurs de moins de 4 cm, nous n’avons pas observé de différence de survie entre les patients de stade II et III. Cette constatation peut s’expliquer par le fait que notre population de stade II était une population à haut risque avec un pronostic plus mauvais (proche du pronostic de stade III): de nombreux cas de stade pT4, de nombreux cas avec moins de 12 ganglions lymphatiques enlevés, de nombreux cas opérés en urgence (pour perforation et obstruction). Dans deux études basées sur les données du SEER, les tumeurs plus petites avaient un pronostic pire, c’est-à-dire une maladie de stade II. Les auteurs ont émis l’hypothèse que de petites UT pourraient être un marqueur de substitution de l’agressivité biologique, ce qui entraînerait des résultats inférieurs à ceux des UT relativement plus importantes au stade II. Les mêmes observations ont été observées dans une étude italienne. Nous avons également étudié le rôle de plusieurs facteurs pronostiques selon le TuS. Nous avons observé que plusieurs facteurs pronostiques tels que l’âge, le stade, le nombre de ganglions lymphatiques impliqués, la localisation de la tumeur n’avaient pas d’impact significatif dans le groupe de patients présentant un TuS faible. Dans notre étude, la chimiothérapie adjuvante a eu un impact positif dans les petites tumeurs, le TuS doit-il être considéré comme un facteur “à haut risque” au stade II? D’autres études axées sur cette question particulière sont nécessaires.
Plusieurs pièges peuvent être relevés dans notre série: la petite taille de l’échantillon, la collecte rétrospective des données et l’absence d’examen central du rapport de pathologie pour une évaluation précise des TS. Nous n’avions pas assez de données disponibles sur la localisation exacte de la tumeur, nous n’avons donc pas pu effectuer une telle analyse. Les tests moléculaires ont été introduits en Tunisie en 2015, pendant notre période d’étude, ils n’étaient pas disponibles. L’évaluation du TuS en fonction du stade et de l’administration d’oxaliplatine n’a pas été effectuée, pour un nombre trop faible de patients pour tirer des conclusions.
Conclusion
Le TuS est un paramètre objectif qui peut être facilement mesuré lors de l’examen pathologique. Il peut représenter un facteur pronostique supplémentaire dans une population avec un taux élevé de stade localement avancé.
Perspectives d’avenir
Plusieurs alétraions et / ou voies génétiques complexes pourraient être à l’origine du TuS dans le cancer colorectal, l’analyse moléculaire prenant en compte la taille de la tumeur pourrait conduire à des explantations plus précises dans son pronostic. le rôle.
Informations financières & divulgation des intérêts concurrents
Les auteurs n’ont aucune affiliation ou participation financière pertinente avec une organisation ou une entité ayant un intérêt financier ou un conflit financier avec le sujet ou les documents discutés dans le manuscrit. Cela comprend l’emploi, les cabinets de conseil, les honoraires, l’actionnariat ou les options, les témoignages d’experts, les subventions ou les brevets reçus ou en instance, ou les redevances.
Aucune aide à l’écriture n’a été utilisée pour la production de ce manuscrit.
Conduite éthique de la recherche
Les auteurs déclarent avoir obtenu l’approbation appropriée du comité d’examen institutionnel ou avoir suivi les principes énoncés dans la Déclaration d’Helsinki pour toutes les enquêtes expérimentales sur l’homme ou l’animal. En outre, pour les enquêtes impliquant des sujets humains, le consentement éclairé a été obtenu des participants impliqués.
- 1 Torre LA, Bray F, Siegel RL et al. Statistiques mondiales sur le cancer, 2012. CA. Cancer J. Clin. 65(2), 87–108 (2015).Crossref, Medline, Google Scholar
- 2 Missaoui N, Jaidaine L, Abdelkader AB et al. Cancer colorectal dans le centre de la Tunisie: tendances croissantes de l’incidence sur une période de 15 ans. Pac Asiatique. J. Cancer Précédent. 12(4), 1073–1076 (2011).Medline, Google Scholar
- 3 Missaoui N, Trabelsi A, Parkin DM et al. Tendances de l’incidence du cancer dans la région de Sousse, Tunisie, 1993-2006. Int. J. Cancer 127(11), 2669-2677 (2010).Il s’agit d’une étude de cas, réalisée par les chercheurs de l’Université de Toronto, et qui a permis d’établir des liens entre l’Université de Toronto et l’Université de Toronto. Les caractéristiques des cancers colorectaux localisés différemment soutiennent la classification proximale et distale: une étude basée sur la population de 57 847 patients. PLoS ONE 11 (12), e0167540 (2016).Il s’agit de l’un des plus grands groupes de l’histoire de la Chine. L’impact de la taille de la tumeur sur la survie des patients atteints d’un cancer gastrique pT4aN0M0. Être. Surg. 79(3), 328-331 (2013).Medline, Google Scholar
- 6 Zhai ZW, Gu J. Influence de la taille de la tumeur sur le pronostic chez les patients atteints d’un cancer du côlon. Zhonghua Wei Chang Wai Ke Za Zhi. 15(5), 495–498 (2012).Medline, Google Scholar
- 7 Huang B, Feng Y, Zhu L et al. Une taille de tumeur plus petite est associée à une faible survie dans le cancer du côlon de stade II: une analyse de 7719 patients dans la base de données SEER. Int. J. Surg. Lond. Engl. 33 (Pt A), 157-163 (2016).Il s’agit d’un projet de recherche sur les technologies de l’information et de la communication. La taille de la tumeur est associée à la réponse inflammatoire systémique, mais pas à la survie chez les patients atteints d’un cancer colorectal primaire opérable. J. Gastroentérol. Hépatol. 22(12), 2288–2291 (2007).Il s’agit d’un projet de recherche sur la santé et la santé des personnes âgées, qui vise à améliorer la qualité de vie des personnes âgées et à améliorer la qualité de vie des personnes âgées. Cancer du côlon précoce: Lignes directrices de pratique clinique de l’ESMO pour le diagnostic, le traitement et le suivi. Ann. Oncol. 24 (Suppl. 6), VI64-VI72 (2013).Crossref, Medline, Google Scholar
- 10 Mandel JS, Church TR, Bond JH et al. L’effet du dépistage du sang occulte fécal sur l’incidence du cancer colorectal. N. Engl. J. Med. 343(22), 1603–1607 (2000).Il s’agit d’un projet de recherche sur les technologies de l’information et de la communication. Statistiques du cancer colorectal, 2017. CA Cancer J. Clin. 67(3), 177–193 (2017).Crossref, Medline, Google Scholar
- 12 Kornprat P, Pollheimer MJ, Lindtner RA, Schlemmer A, Rehak P, Langner C. Valeur de la taille de la tumeur en tant que variable pronostique dans le cancer colorectal: une réévaluation critique. Être. J. Clin. Oncol. 34(1), 43–49 (2011).Crossref, Medline, Google Scholar
- 13 Saha S, Shaik M, Johnston G et al. La taille de la tumeur prédit la survie à long terme du cancer du côlon: analyse de la Base de données nationale sur le cancer. Être. J. Surg. 209(3), 570-574 (2015).Il s’agit d’un projet de recherche sur la santé et la santé publique, qui a pour but d’améliorer la santé et la sécurité des personnes et de les aider à améliorer la santé et la sécurité des personnes. La survie au cancer du côlon est associée à un nombre croissant de ganglions lymphatiques analysés: une enquête secondaire de l’essai intergroupe INT-0089. J. Clin. Oncol. 21(15), 2912–2919 (2003).Crossref, Medline, CAS, Google Scholar
- 15 Wang Y, Zhuo C, Shi D et al. Effet défavorable de la petite taille de la tumeur sur la survie spécifique à la cause dans le cancer du côlon de stade IIA, une étude basée sur le VOYANT. Int. J. Dis colorectal. 30(1), 131–137 (2015).Il s’agit de l’un des plus grands groupes de l’histoire de l’art et de l’histoire de l’art et de l’art. La taille de la tumeur comme facteur pronostique chez les patients atteints d’un cancer du côlon de stade IIa. Être. J. Surg. doi:10.1016/j.amjsurg.2017.03.038 (2017) (Epub ahead of print).Medline, Google Scholar
- 17 Mejri N, Dridi M, Labidi S et al. P-299 prognostic value of tumor size in stage II and III colorectal cancer in Tunisian population. Ann. Oncol. 28(Suppl. 3), mdx261.296 (2017).Google Scholar