cikk
Josivan Gomes Lima1*, Marcel Cat .. o.Santos Ferreira-sziget1. O., Tamara Julliane Ara. O. A. Campos2. O.
2a Trairi Egészségtudományi Kar, Rio Grande do North Szövetségi Egyetem (UFRN), Natal, Rn, Brazília
absztrakt
a veleszületett generalizált lipodystrophia (CGL) ritka és súlyos autoszomális recesszív betegség. A betegek hibásak a testzsír tárolásában, következésképpen zsírt raknak le a méhen kívüli szövetekbe, főleg a májba, és cirrhosis alakulhat ki. Az inzulinrezisztencia tipikus megállapítás, amely cukorbetegséget okoz, amely nagy napi inzulinadagot igényel. Rio Grande do Norte államban, Brazíliában a CGL-ben szenvedő betegek egyik legnagyobb csoportja van. Ebben a cikkben áttekintjük a betegség patofiziológiáját, klinikai képét és kezelését.
Bevezetés
a 2-es típusú cukorbetegség világméretű egészségügyi probléma, és általában a túlzott súly és a megnövekedett zsigeri zsír miatt következik be, ami perifériás inzulinrezisztenciát okoz, és a hasnyálmirigy képtelen felszabadítani az inzulint, hogy kompenzálja ezt a rezisztenciát. A cukorbetegség egyéb kevésbé gyakori típusai specifikus genetikai mutációk miatt fordulnak elő, mint például a veleszületett generalizált lipodystrophia (CGL), más néven Berardinelli-Seip veleszületett lipodystrophia (BSCL). A CGL egy autoszomális recesszív betegség, amelyet négy típusba sorolnak, génmutáció alapján. A megváltozott gének alapvető szerepet játszanak az adipocita képződésében, a lipidtermelésben és a megfelelő tárolásban az adipocita belsejében. A mutációk csökkentik a zsírszövetet, aminek következtében a méhen kívüli helyeken zsírlerakódás következik be, ami zsírmájat, megváltozott szénhidrát anyagcserét, hyperinsulinaemiával és acromegaloid jellemzőkkel járó súlyos inzulinrezisztenciát és dyslipidemia1-3-at okoz. A CGL-szindrómáról körülbelül 500 esetet jelentettek a világon. Brazíliában, Rio Grande do Norte államban (RN) 54 esetet diagnosztizáltunk, kezeltünk és követtünk az elmúlt 20 évben4, 5. Egy másodlagos adatokat használó leíró vizsgálatban összesen 103 beteget becsültünk meg az RN6-ban. Ez sokkal magasabb prevalenciát jelez, mint amit az irodalomban jelentettek (1: 1 millió) 7.
triacil-glicerin képződés és tárolás lipidcseppekben
a trigliceridek és foszfolipidek bioszintézise (1a.ábra) azzal kezdődik, hogy a glicerin-3-foszfát Acil-transzferáz (GPAT) az 1. pozícióban acilezi a glicerin-3-foszfátot, és 1-acil-glicerin-3-foszfátot (lizofoszfatidsav) képez. Ezt követi egy másik acilezési lépés a második helyen az agpat enzim (1-acil-glicerin-3-foszfát-Acil-transzferáz), amely 1,2-diacil-glicerin-3-foszfátot (foszfatidsav) eredményez. Ez kulcsfontosságú közbenső lépés mind a trigliceridek, mind a foszfogliceridek bioszintézisének útjában. Az AGPAT enzimeknek 11 izoformája van, amelyeket különböző gének kódolnak4. Az AGPAT1 és az AGPAT2 a legszélesebb körben tanulmányozott. Az AGPAT1 nagy mennyiségben van jelen a herékben, a hasnyálmirigyben és kisebb mértékben a zsírszövetben és más szövetekben, mint a szív, a placenta, az agy, a tüdő, míg az AGPAT2 bőséges a zsírszövetben. A következő lépésekben a citoszol foszfatidsav-foszfatáz enzim (PAP vagy lipin) 1,2-diacil-glicerint, az 1,2-diacil-glicerin-Acil-transzferáz (DGAT) pedig triacil-glicerint4 képez. A foszfatidsav és a diacil-glicerin más foszfolipidekből is származhat, mint például a kardiolipin, a foszfatidilinozit és a foszfatidilkolin.
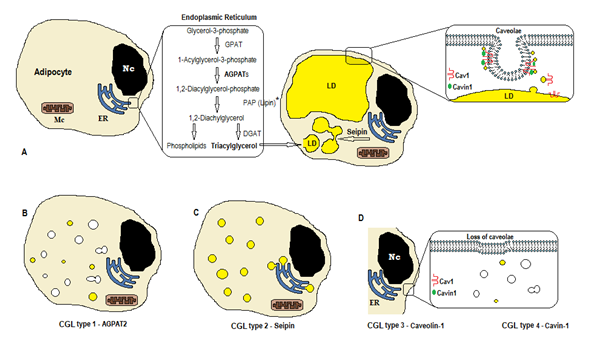
1. ábra. A trigliceridszintézis rendszere CGL típusok szerint. (A) a triacil-glicerin (TAG) normális szintézise és tárolása az adipocitában. (B) az AGPAT2 mutációja csökkenti a CÍMKETERMELÉST (néhányat még mindig szintetizálnak más AGPATs stimulálása alatt). (C) A seipin gén mutációja csökkenti a TAG szintézist és a lipidcseppek (ld) képződését és fúzióját. (D) A Caveolin-1 és a Cavin-1 szükséges a caveolae kialakulásához és stabilizálásához. A CAV1 (3.típus) vagy a CAVIN1 (4. típus) mutációja a caveolae elvesztését okozhatja a membránban. Nc, nucleus. Endoplazmatikus retikulum. Mc, mitokondriumok. * A Lipin egy citoszol enzim, amelyet a seipin rögzít az ER-ben.
ezek a reakciók az adipociták endoplazmatikus retikulumában (ER) fordulnak elő, ahol a trigliceridek progresszív felhalmozódása kis lipidcseppek (LD)képződését okozza8. A bscl2 gén terméke egy transzmembrán fehérje, az úgynevezett seipin, amely a kis ld fúzióját okozza, ami nagy LD-t eredményez. A Seipin az ER-ben található, és a kialakuló LD-vel való találkozásánál koncentrálódik, megkönnyítve az ER és az LD közötti lipidforgalmat, valamint a trigliceridek beépülését az LD9-be. A Seipin ER horgonyként is működhet a Lipin 1 citoszol enzimhez. Amellett, hogy szükséges a lipidcseppek fúziójához, méretéhez és morfológiájához, a seipin elengedhetetlen az adipogenezishez (a lipin 1-hez való kölcsönhatás révén) és a celluláris triglicerid lipolízishez10, 11. A seipin hiánya akadályozza a pre-adipociták adipocitákká történő differenciálódását, és befolyásolja a végső érést9, amint azt a mezenchimális őssejteken végzett vizsgálatok kimutatták, a BSCL2 kiütésével12. A nem zsírszövetek is expresszálják a seipint, és más funkciókat kell meghatározni.
az adipocitákban a caveolae, amelyek speciális 50-100 nm-es membráninvaginációk, a plazmamembrán területének 20% – át teszik ki, így az adipociták a legnagyobb sűrűségű caveolae13 sejtek. A lipidcseppek kialakulásához membránfehérje (Caveolin – a caveolae membránok fő összetevője) és citoplazmatikus fehérje (Cavin-1)szükséges 14. A cav1, CAV2 és CAV3 gének a caveolin három formáját kódolják hasonló struktúrákkal (Caveolin-1, Caveolin-2 és Caveolin-3). A Caveolin-1 és a Caveolin-2 jelen van az adipocitákban, a fibroblasztban és az endothel sejtekben, és a Caveolin-3 csak a csontvázban és a szívizomban van jelen13, 15. A Caveolin – 1 A legfontosabb és a leginkább tanulmányozott. Két különböző izoformában (1a és 1b) fejezik ki. A Caveolin-1 transzlokálódik a plazmamembránból a lipidcseppekbe, ami szükséges a lipidkereskedelemhez és metabolizmushoz16. A lipidcseppek etetés után tárolják a triglicerideket, és ezek a molekulák zsírsavvá hidrolizálódnak, és éhgyomorra szabadulnak fel; ezt a mechanizmust a Caveolin-116 szabályozhatja. A Caveolin-1 hiány növeli az autofágia által okozott sejthalálra való hajlamot17.
a CAVIN1 gén egy caveolae asszociált fehérje 1 (Cavin-1)14, 16 nevű citoplazmatikus fehérjét kódol, amely kötelező a caveolae kialakulásához és stabilizálásához. A Cavin-1 adipocitákban, izomsejtekben és más sejtekben expresszálódik, és elengedhetetlen a caveolae eredetű jelek továbbításában14, 18. A CAV1 gén kiesése a caveolae hiányát okozza a nem izomsejtekben, míg a CAVIN1 kiütése a caveolae hiányát okozza minden szövetben, beleértve az izmot is14. A caveolae hiánya befolyásolhatja a lipolízis szabályozását, zsírsav fluxus, triglicerid szintézis, valamint más utak jelzései.
a CGL típusai
a kimutatható genetikai változások alapján négy típust írnak le. Az 1-es és a 2-es típus felelős az esetek több mint 95% – áért, és a 2-es típusnak súlyosabban érintett fenotípusa van. A 3.típusból csak egy, a 4. típusból pedig mintegy 30 esetről számoltak be4.
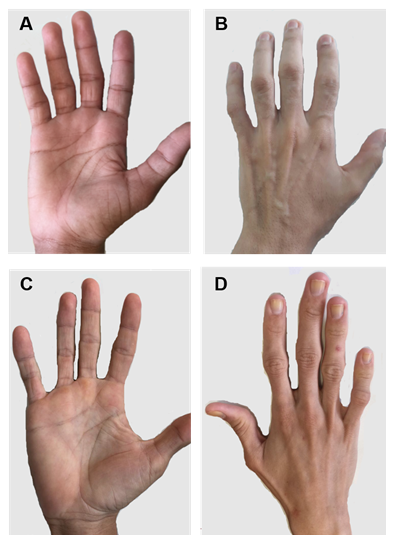
2. ábra. Az 1-es és 2-es típusú CGL-ben szenvedő betegek kezei. A) és B) az 1-es típusú betegek kezének elülső és hátsó nézetei. Nyilvánvalóan normális kezek, mivel még mindig van mechanikus zsírszövet. C) és D) A 2-es típusú betegek kezének elülső és hátsó nézetei. A betegség súlyossága nagyobb, és a zsírhiány nyilvánvaló és könnyen észrevehető.
1.típusú CGL. 1999-ben Garg et al. leírták a betegek mutációját a 9q34 kromoszómán, majd három évvel később Agarwal et al. megmutatta AGPAT2 mint a mutáció által érintett enzim2, 19. Ennek az AGPAT2-nek a mutációja miatt a triacil-glicerin nem vagy minimális termelése más izoformák stimulálásával történik. Az AGPAT2 knockout egerek fenotípusa hasonló a CGL típusú emberekéhez, megerősítve ennek az enzimnek a szerepét a patofiziológiában20, 21.
2.típusú CGL. Magre et al. elsőként azonosították a seipin gén mutációját (11q13 kromoszóma) 3. A seipin gén (BSCL2) mutációi (többnyire nonszenszek) csonka fehérjét termelnek, és különböző mechanizmusokkal befolyásolhatják a lipid anyagcserét: a) A seipin stabilitásának csökkenése; b) a lipin 1 kötési képességének csökkenése; és c) az oligomerizáció és a kizárólag az ER membránra lokalizálás sikertelensége11. Egyes sejtek még mindig képesek triacil-glicerint és kis lipidcseppeket előállítani, de a nagy lipidcseppek hiányoznak a kis lipidcseppek fúziós képességének elvesztése miatt. Az adipogén tényezők, például a peroxiszóma proliferátor által aktivált receptor gamma (PPARG), valamint az adiponektin és az adipocita zsírsav-kötő fehérje (FABP4)11, 16 expressziója is hibás. A Seipin-hiány rontja az adipogenezist, fokozza a lipolízist, és megakadályozza a trigliceridek felhalmozódását az adipocitákban.
3.típusú CGL. Ezt a típust nemrégiben írták le egy olyan betegnél, aki annak ellenére, hogy CGL fenotípusa van, nem volt mutációja az AGPAT2 vagy a BSCL222 génekben. A Cav1 mutációval rendelkező egerek ellenállnak az étrend által kiváltott elhízásnak, inzulinrezisztenciával, hipertrigliceridémiával, csökkent adiponektinnel, csökkent zsírtömeggel és kis adipocitákkal rendelkeznek16. Miután kiválasztotta a jelölt géneket egereken végzett vizsgálatok alapján, Kim et al. megerősítette a nonszensz mutáció jelenlétét a caveolin-1 génben (CAV1), a 7q3122 kromoszómán.
4.típusú CGL. Ebben egy ritka típus az érintett gén a CAVIN1, amely a Cavin-1 fehérjét kódolja. Emberben beszámoltak generalizált veleszületett lipodystrophiában és izomdisztrófiában szenvedő betegekben15, 23.
a közelmúltban a PCYT1A és a PPARG gének mutációit is leírták, amelyek lipodisztrófiát okoznak24, 25.
klinikai jellemzők
a CGL-ben szenvedő betegeknél általában akromegaloid facies, acanthosis nigricans, phebomegalia, hepatomegalia és izom hipertrófia5, 26, 27. Számos szerző említi a köldöksérv mint a szindróma klinikai megállapítása26. Megvizsgáltuk a gyakoriságát a betegsorozatunkban, és egyikük sem mutatta be ezt a változást28. Valójában a periumbilicalis zsírszövet hiánya a köldökzsinór kiemelkedését okozza, ami tévesen diagnosztizálható hernia28, 29.
amint az adipociták nem képesek megfelelően tárolni a zsírt, felhalmozódik más szövetekben, például a májban és az izmokban, súlyos inzulinrezisztenciát okozva. A csontdenzitometria (DXA) normális vagy magas csont ásványi sűrűséget mutathat30 és csökkent teljes testzsír (általában kevesebb, mint 6%)27. Az alacsony testzsír miatt a szérum adiponektin és leptin is alacsony27. Mivel a leptin elengedhetetlen az éhség szabályozásában, ezek a betegek általában hiperfágiában szenvednek, ami gyermekkora óta nyilvánvaló. Az adiponektin fontos szerepet játszik inzulinérzékenyítőként, hiánya rontja az inzulinrezisztenciát. Ennek ellenére kezdetben a glükóz és a glikált hemoglobin normális a nagyon magas inzulinszint rovására. A cukorbetegség általában pubertáskor kezdődik; sorozatunkban a megjelenés átlagos életkora 15,8 6,1 év volt27. Kezdetben orális gyógyszerekkel szabályozzák őket, néhány év alatt nagy dózisú inzulint igényelnek27. Az artériás hipertónia a betegek egyharmadában fordul elő27.
az egyes CGL-típusoknak vannak bizonyos specifikus klinikai jellemzői. Az 1. típusú betegek továbbra is mechanikus zsírzsírt mutatnak, különösen tenyérben, talpban, orbitális, peri-artikuláris régiókban31. Ezzel szemben a 2-es típusú betegek metabolikus és mechanikai zsírszövetek hiányát mutatják. A Seipin erősen expresszálódik az agyban és a kisagyban, és részt vesz az idegi funkciók szabályozásában is. A 2-es típusú betegek több mint felének van valamilyen kognitív károsodása1, 8. A 3-as és a 4-es típus megőrzi a mechanikai és csontvelő zsírtartalmát, és a 4-es típus izomgyengesége magas szérum kreatin-kinázzal és gerinc instabilitással jár15.
vannak nemi specifikus klinikai jellemzők is. Gyakori a policisztás ovárium és az amenorrhoea32. A menstruációs ciklusok általában normalizálódnak a metreleptin alkalmazásával, valószínűleg az inzulinérzékenység javulása és az LH pulzatilitás helyreállítása32 miatt. A 2. típusú férfiaknál teratozoospermia lehet a csírasejtekben a seipin hiánya miatt33.
hipertrigliceridémia az élet első évei óta fordul elő, és akut pancreatitist okozhat. A HDL általában alacsonyabb, mint 30 mg/dL. A májenzimek emelkedése szintén korai megállapítás, és a májban lévő zsírlerakódásból származik. A szérum thrombocytaszám fokozatos csökkenése a májbetegség rosszabbodására és valószínű cirrhosisra utal34.
mivel a Cavin-1 jelen van az izomsejtekben, a 4-es típusú betegek enyhe izomgyengeséggel és emelkedett kreatin-kinázszinttel rendelkeznek15.
a várható élettartam, főleg a 2. típusban, jelentősen csökken, a halál nem ritkán fordul elő 30 éves kor előtt (személyes tapasztalat 20 beteg alapján, akik az elmúlt 19 évben haltak meg). A halál okai cukorbetegséggel (veseelégtelenség, hirtelen halál), májjal (cirrhosis, emésztési vérzés) vagy fertőzésekkel kapcsolatosak.
diagnózis és kezelés
a CGL diagnózis klinikai adatokon alapul: akromegaloid jellemzők, acanthosis nigricans, a teljes testzsír csökkentése, izom hipertrófia és a köldökheg kiemelkedése. A laboratóriumi adatok súlyos inzulinrezisztenciával és hipertrigliceridémiával járó cukorbetegséget is mutathatnak. A képalkotó vizsgálatok segíthetnek azonosítani a méhen kívüli zsírlerakódásokat elsősorban a májban és a hasnyálmirigyben (máj steatosis hepatomegáliával és hasnyálmirigy steatosissal). A DXA megerősítheti az alacsony testzsírt és a magas csontsűrűséget30.
a CGL kezelése az étrend szigorú ellenőrzéséből áll, a zsír, elsősorban a trigliceridek és a magas glikémiás indexű élelmiszerek bevitelének csökkentésével a komorbiditások megelőzése és ellenőrzése29. Az ideális étrend azonban kihívást jelent a megnövekedett étvágy és a szigorú korlátozás miatt. A társbetegségek kontrolljának javítása érdekében ösztönözni kell a fizikai aktivitást is, kivéve azokat a betegeket, akiknek ellenjavallatai vannak, például súlyos kardiomiopátia29.
ami a gyógyszeres kezelést illeti, ezek a betegek kezelhetők a cukorbetegség, a magas vérnyomás és a diszlipidémia szokásos gyógyszereivel. A cukorbetegség és az inzulinrezisztencia kezelésére az első választás a metformin, de általában nem elég. A részleges lipodystrophia kezelésével ellentétben a tiazolidindionokat óvatosan kell alkalmazni29. Egyéb orális antidiabetikumokat alkalmaznak, de ezeket nem vizsgálták kifejezetten CGL-ben szenvedő betegeknél. Állatokon végzett adatok arra utalnak, hogy az SGLT2 inhibitorok (dapagliflozin) alkalmazása előnyös lehet a kardiomiopátia megelőzésében35; vizsgálatok szükségesek ennek igazolására embereken. A betegség előrehaladtával és a súlyos inzulinrezisztencia kialakulásával nagy napi inzulinadagokra van szükség. A szubkután zsírszövet hiánya problémát jelent a nagy dózisú inzulin beadásakor. Koncentráltabb inzulinra (U-300 vagy U500) lehet szükség36. Ezek a betegek súlyos diszlipidémiát mutatnak, elsősorban a trigliceridek és az alacsony HDL növekedése miatt, ezért a fibrát alkalmazása néha szükséges az akut pancreatitis megelőzéséhez. Ezen túlmenően ezen betegek magas kardiovaszkuláris kockázata miatt fontolóra kell venni a sztatinnal történő beavatkozást, és az LDL vagy a nem HDL célpontjainak szigorúaknak kell lenniük29.
a metreleptin napi injekciói jelentősen csökkentik az étvágyat, és előnyökkel járnak a glikémia, a trigliceridémia és a májenzimek csökkentésével. Különösen gyermekeknél figyelemre méltó a hasi kerület csökkenése, valószínűleg a hepatomegalia csökkenése miatt.
következtetés
a CGL ritka és súlyos betegség, amely cukorbetegség (általában nagy adag inzulint igényel) és korai halál esetén fordulhat elő. A beteg fenotípusa meglehetősen jellemző, azonban megköveteli, hogy az egészségügyi szakemberek ismerjék a szindrómát a korai diagnózis felállításához. Úgy tűnik, hogy a Metreleptin jelenleg az egyetlen gyógyszer, amely módosíthatja a betegség természetes történetét.
összeférhetetlenség: nincs.
- Nolis T. a gyakoribb genetikai és szerzett lipodisztrófiák mögötti patofiziológia feltárása. Journal of human genetics. 2014 január; 59(1): 16-23.
- Agarwal AK, Arioglu E, De Almeida s, et al. Az AGPAT2 mutálódik a veleszületett generalizált lipodystrophiában, amely a 9q34 kromoszómához kapcsolódik. Nat Genet. 2002 május; 31(1): 21-3.
- Magre J, Delepine M, Khallouf E, et al. A Berardinelli-Seip veleszületett lipodystrophiában megváltozott gén azonosítása a 11q13 kromoszómán. Természet genetika. 2001 augusztus; 28(4): 365-70.
- Patni N, Garg A. Veleszületett generalizált lipodystrophiák … új betekintés az anyagcsere-diszfunkcióba. Természet vélemények endokrinológia. 2015 szeptember; 11(9): 522-34.
- Garg A. szerzett és örökölt lipodisztrófiák. A New England Journal of medicine. 2004 márc 18; 350 (12): 1220-34.
- de Azevedo Medeiros LB, Candido Dantas VK, Craveiro Sarmento AS, et al. A Berardinelli-Seip veleszületett lipodystrophia magas előfordulása Rio Grande do Norte államban, Északkelet-Brazíliában. Diabetol Metabolit Syndr. 2017; 9: 80.
- Chiquette e, orális EA, Garg A, et al. A generalizált és részleges lipodystrophia prevalenciájának becslése: eredmények és kihívások. Cukorbetegség, metabolikus szindróma és elhízás: célok és terápia. 2017: 375-83.
- Wee K, Yang W, Sugii S, et al. A lipodystrophia és a seipin funkciók mechanisztikus megértése felé. Bioscience jelentések. 2014; 34(5).
- Dollet L, Magre J, Cariou B, et al. Funkciója seipin: új betekintést Bscl2 / seipin knockout egér modellek. Biochimie. 2014 január; 96: 166-72.
- Sim MF, Dennis RJ, Aubry EM és munkatársai. A humán lipodystrophia protein seipin egy ER membrán adapter az adipogén PA foszfatáz lipinhez 1. Molekuláris anyagcsere. 2012; 2(1): 38-46.
- Sim MF, Talukder MM, Dennis RJ, et al. A humán lipodystrophia fehérje seipin természetesen előforduló mutációinak elemzése több potenciális patogén mechanizmust tár fel. Diabetológia. 2013. november; 56(11): 2498-506.
- Payne VA, Grimsey N, Tuthill a, et al. A humán lipodystrophia gén BSCL2 / seipin elengedhetetlen lehet a normális adipocita differenciálódáshoz. Cukorbetegség. 2008 augusztus; 57(8): 2055-60.
- Cohen AW, Hnasko R, Schubert W, et al. A caveolae és a caveolins szerepe az egészségben és a betegségben. Fiziológiai vélemények. 2004. október; 84(4): 1341-79.
- Pilch PF, Liu L. Zsírbarlangok: caveolae, lipidkereskedelem és lipid anyagcsere az adipocitákban. Az endokrinológia és az anyagcsere trendjei: TEM. 2011 augusztus; 22(8): 318-24.
- Hayashi YK, Matsuda C, Ogawa M, et al. Az emberi PTRF mutációk a caveolinok másodlagos hiányát okozzák, ami izomdisztrófiát eredményez generalizált lipodisztrófiával. J Clin Invest. 2009 szept.; 119(9): 2623-33.
- Parton RG, del Pozo MA. Caveolae mint plazmamembrán érzékelők, védők és szervezők. A természet áttekinti a molekuláris sejtbiológiát. 2013 február; 14(2): 98-112.
- Le Lay S, Briand N, Blouin CM, et al. A lipoatrofikus caveolin-1 hiányos egérmodell autofágiát tár fel Érett adipocitákban. Autofágia. 2010 augusztus; 6(6): 754-63.
- Liu L, Brown D, McKee M, et al. A Cavin/PTRF deléciója a caveolae globális elvesztését, diszlipidémiát és glükóz intoleranciát okoz. Sejt anyagcsere. 2008. október; 8(4): 310-7.
- Garg a, Wilson R, Barnes R, et al. A veleszületett generalizált lipodystrophia génje az emberi 9q34 kromoszómára mutat. A Journal of clinical endocrinology and metabolism. 1999 szeptember; 84(9): 3390-4.
- Vogel P, olvassa el R, Hansen G, et al. A veleszületett generalizált lipodystrophia patológiája Agpat2 – / – egerekben. Állatorvosi patológia. 2011 május; 48(3): 642-54.
- Cortes VA, Curtis DE, Sukumaran s, et al. A máj steatosisának és inzulinrezisztenciájának molekuláris mechanizmusai a veleszületett generalizált lipodystrophia AGPAT2-hiányos egérmodelljében. Sejt anyagcsere. 2009 február; 9(2): 165-76.
- Kim CA, Delepine M, Boutet E, et al. Homozigóta nonszensz caveolin-1 mutáció társulása berardinelli-Seip veleszületett lipodisztrófiával. J Clin Endocrinol Metabolit. 2008 ápr.; 93(4): 1129-34.
- Rajab a, Straub V, McCann LJ, et al. Halálos szívritmuszavar és hosszú QT-szindróma a veleszületett generalizált lipodystrophia új formájában, izomrobbanással (CGL4) a PTRF-CAVIN mutációk miatt. PLoS genetics. 2010 márc 12; 6(3): e1000874.
- Payne F, Lim K, Girousse a, et al. Veleszületett lipodystrophiában és zsírmájbetegségben szenvedő embereknél a Kennedy foszfatidilkolin útvonalát megzavaró mutációk. 2014 Jún 17; 111(24): 8901-6.
- Dyment DA, Gibson WT, Huang L, et al. A pparg biallelikus mutációi veleszületett, generalizált lipodystrophiát okoznak, hasonlóan a Berardinelli-Seip szindrómához. Eur J Med Genet. 2014 szept.; 57(9): 524-6.
- Garg A. Clinical review#: Lipodystrophies: genetikai és szerzett testzsír rendellenességek. A Journal of clinical endocrinology and metabolism. 2011. november; 96(11): 3313-25.
- Lima JG, Nobrega LH, de Lima NN, et al. A veleszületett generalizált lipodystrophiában szenvedő betegek nagy sorozatának klinikai és laboratóriumi adatai. Diabetol Metabolit Syndr. 2016; 8: 23.
- Lima GJ, Lima NN, Oliveira CF, et al. Köldöksérv Berardinelliseip szindrómában szenvedő betegeknél: valóban sérv. J Clin Mol Endocrinol. 2015; 1(1): 3.
- Brown RJ, Araujo-Vilar D, Cheung PT, et al. A lipodystrophia szindrómák diagnosztizálása és kezelése: több társadalomból álló gyakorlati útmutató. J Clin Endocrinol Metabolit. 2016 Dec; 101(12): 4500-11.
- Lima JG, Nobrega LH, Lima NN, et al. A Berardinelli-Seip veleszületett Lipodystrophiában szenvedő betegek csontsűrűsége magasabb a trabekuláris helyeken és a 2-es típusú betegeknél. J Clin Densitom. 2016 Nov 25.
- Simha V, Garg A. fenotípusos heterogenitás a testzsír-eloszlásban veleszületett generalizált lipodystrophiában szenvedő betegeknél, amelyeket az AGPAT2 vagy seipin gének mutációi okoznak. J Clin Endocrinol Metabolit. 2003. november; 88(11): 5433-7.
- Musso C, Cochran E, Javor E és mtsai. A rekombináns metionil humán leptin terápia hosszú távú hatása a hyperandrogenismusra és a menstruációs funkcióra nőknél és a hypophysis funkcióra férfi és női hypoleptinaemiás lipodystrophiás betegeknél. Anyagcsere. 2005 február; 54(2): 255-63.
- Jiang M, Gao M, Wu C, et al. A herék seipin hiánya teratozoospermia szindrómát okoz a férfiakban. Proc Natl Acad Sci USA A. 2014 Május 13; 111(19): 7054-9.
- Mitchell O, Feldman DM, Diakow M, et al. A thrombocytopenia patofiziológiája krónikus májbetegségben. Hepat Med. 2016; 8: 39-50.
- Joubert M, Jagu B, Montaigne D, et al. The Sodium-Glucose Cotransporter 2 Inhibitor Dapagliflozin Prevents Cardiomyopathy in a Diabetic Lipodystrophic Mouse Model. Diabetes. 2017 Apr; 66(4): 1030-40.
- Lima JG, Lima NN, Lima RLM, et al. Glargine U300 Insulin as a Better Option than Degludec U100 to Treat a Congenital Generalized Lipodystrophy Patient. Clin Diabetes Res. 2017; 1(1).