コロニー PCRとは何ですか?
Colony PCRは、細菌のコロニーから直接プラスミドに挿入されたDNAの有無を決定するための迅速かつ高スループットPCR法です。
分子クローニングは、長い間DNA変換のための最も一般的な方法の一つです。 しかし、DNAインサートの有無を判定するためには、形質転換実験を行わなければならない。
Colony PCRは、挿入されたDNA特異的プライマーを設計することにより、目的のDNAがプラスミドに挿入されているかどうかを特定する新しい方法です。
しかし、それは我々が議論しているほど単純ではありません。
この記事では、特にコロニー PCR、コロニー PCRの原理、その利点と限界に焦点を当てます。
そのためには、いくつかの用語やトピックを理解する必要があります。 私たちは、基本から私たちのトピックを開始します。 記事の内容は次のとおりです,
主なトピック:
“プラスミドは、細菌の染色体から独立して複製し、遺伝子操作および遺伝子導入に使用される細菌の環状DNAである。”
遺伝的クローニングは、実験室で長い間使用されてきた伝統的な分子遺伝的ツールです。 簡単に言えば、遺伝子クローニングでは、私たちの関心のある遺伝子は、人工的な手段を介してプラスミドに挿入されます。 このDNAは細菌の染色体から独立して複製されます。
プラスミドは、実際には、DNAの短いセグメントの多くのコピーを生成するために使用されます。 細菌は他のどの生物よりも速く複製するので、我々は細菌のプラスミドに挿入することによって我々の関心のある遺伝子の多くのコピーを生成するこ
F-プラスミド、Col-プラスミド、分解プラスミド、耐性プラスミドは、細菌に見られるいくつかの一般的なタイプのプラスミドです。
さらに、プラスミドは、ある細胞から別の細胞に短いDNAセグメントを転送する分子担体として働くことができる。
私たちは、プラスミドDNA上の驚くべき詳細な記事をカバーしています。 ここでそれを読む:プラスミドDNA-構造、機能、単離およびアプリケーション。
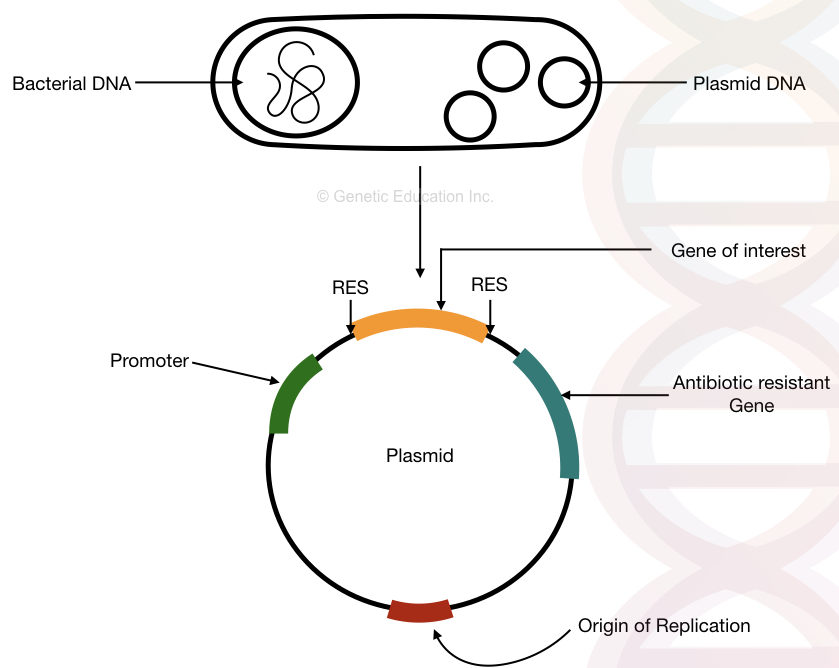
細菌プラスミドDNAの構造、複製の起源、抗生物質耐性遺伝子、プロモーターおよび目的とする遺伝子。
細菌とは別に、他のいくつかの原核生物にもプラスミドDNAが含まれています。 細菌中のプラスミドの主な機能は、過酷な条件下での生存のためのものである。
プラスミドは目的の遺伝子を転送するため、目的の遺伝子がプラスミドに挿入されているかどうかを判断することは非常に重要です。
そのためには、PCRや微生物培養などのいくつかの方法を使用することができます。
コロニーのプラット化には時間がかかり、方法の感度も良くありません。 細菌培養法では、汚染の可能性は常に高い。
なので、結果は正確ではありません。
私たちのPCRもここに役立ちます。 コロニー PCR法を使用して、DNA挿入物を決定または同定することができる。
- DNA抽出ラボのセットアップ方法:包括的なガイド(化学物質、機器、その他のユーティリティ)。
- 染色体6p欠失:痛みがなく、空腹がなく、睡眠がない理由
コロニー PCRとは何ですか?
コロニー PCRは、細菌コロニーをPCRテンプレートとして直接使用する従来のPCRを改変したものです。
目的のDNAを含むプラスミドDNAは、環状温度依存条件で増幅されます。
コロニー PCRのグラフィカルな表現を下の図に示します,
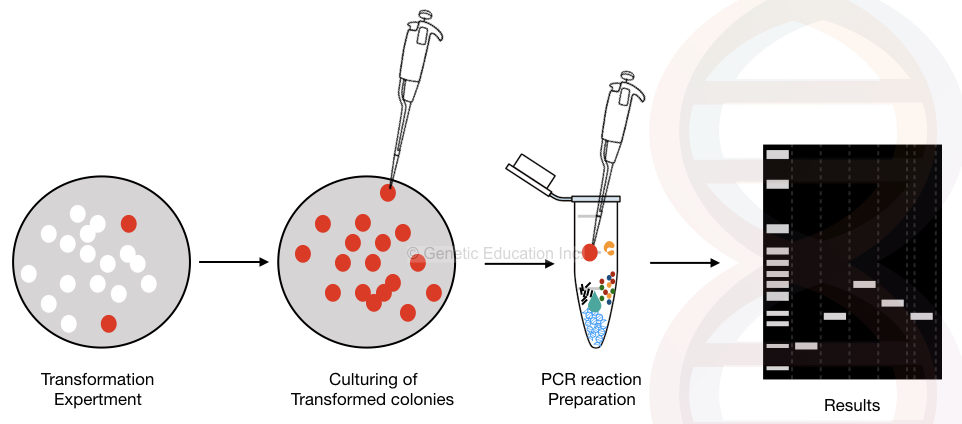
コロニー PCR法の一般的な概要。
:
プラスミドを含む細菌コロニーは、二組のプライマーを用いて直接増幅することができる。 挿入配列を増幅するインサート特異的プライマーと、挿入されたDNA以外のプラスミドDNAを増幅するベクター特異的なフランキングプライマー(インサートの両側
インサートに隣接するプライマー(DNAの残りの部分を増幅する)を使用することにより、DNAインサートのサイズを決定することができます。
細菌コロニーを採取し、すべてのPCR試薬を含むマスターミックスに直接添加する。 加えて、1つの初期加熱ステップをPCRに加えることによって、プラスミドDNAが細菌細胞から出て、反応中に増幅される。
これはコロニー PCRの基本原則ですが、要件に応じて変更することができます。
コロニー PCRのプロトコル:
コロニー PCRは、従来のPCRの優れた修飾の一つです。 鋳型DNAの代わりに、細菌コロニーを反応物に直接添加する。 この他に、TAQ DNAポリメラーゼ、プライマー、PCR反応緩衝液およびDD/WもPCR反応に添加される。
ここでは、コロニー PCRでは、プライマーの選択が非常に重要です。 また、プライマーの選択は、我々の実験の目的に依存する。
私たちのコロニー PCR実験からどのような情報が欲しいですか?
-
-
- 挿入の有無に関する情報のみ。
- 挿入のサイズに関する情報。
- インサートの向きに関する情報。
-
それに応じて、異なるPCRプライマーは、コロニー PCRのために設計されています。
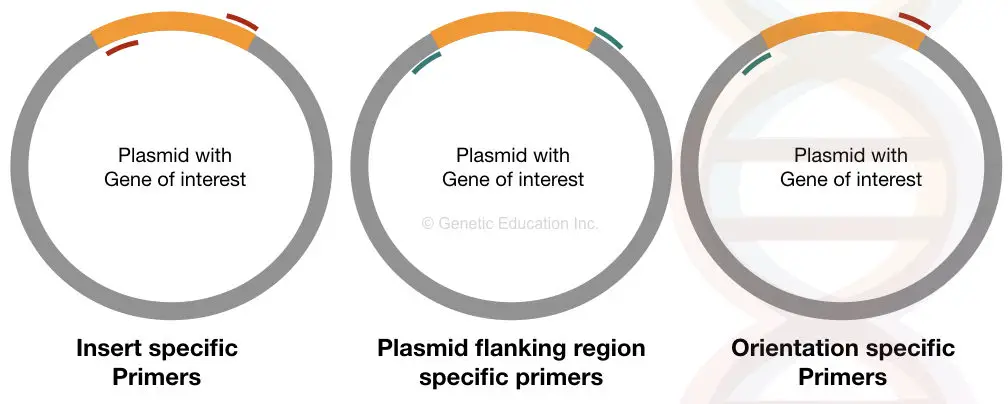
挿入特異的プライマーは、目的の挿入されたDNAの両側の特定の位置に結合する。 それがプラスミドに適切に転写される場合、これらのプライマーはそれに結合することができ、そうでなければ結合することができない。
このプライマーセットは、インサートの有無に関する情報を提供します。
配向特異的プライマーは、一方のプライマーがインサート内で結合し、もう一方のプライマーがプラスミドDNA配列(インサートDNA以外の配列)に結合するユニークなプライマーである。
このタイプのプライマーセットは、私たちの関心のある挿入されたDNAの向きに関する情報を提供します。 私たちの挿入DNAがベクターに適切に連結されていない場合、配列のその側に特異的なプライマーは結合することができず、増幅を得ることはできません。
プラスミド特異的プライマーも配向特異的プライマーと同じくらい重要である。 プライマーのこのセットは私達の興味のDNAの外側に結合する挿入物の隣接する領域から設計されています。
このプライマーのセットは、インサートのサイズを決定するのに役立ちます。 それは挿入DNA以外の領域を拡大する。
コロニー PCRを行うためのPCR反応は以下の通りである,
| 成分 | 濃度 | 量 |
| マスターミックス(コロニー PCRのための特別な
) |
1× | 12 |
| 2mm Mgcl2を用いたPCR反応緩衝液
* |
1× | 5 |
| フォワードプライマー | 10pm | 1μ l |
| リバースプライマー | 10pm | 1μ l |
| 3 | ||
| 水 | 3万円 | |
| 合計 | ——— | 25万円 |
コロニー PCRの手順:
まあ、コロニー PCRは、抽出されたDNAを必要としません。
ここではDNAを抽出していません。 その代わりに、反応の感度を高めるためにいくつかの他の方法が使用される。
さて、なぜ我々はプラスミドDNAのDNAを抽出していないのですか?
理由は単純なので、細菌細胞の細胞膜は非常に滑らかです。
我々はすでに細菌細胞の細胞膜について議論していた。 ここでそれを読む:DNA抽出方法の異なる種類
細菌は、高速で加熱または遠心分離することによって容易に溶解することができる柔らかい細胞膜を含
また、我々は細菌自身のDNAを必要としません。 循環する円形プラスミドは細菌の細胞質中に存在するので、追加の精製工程も同様に必要とされない。 細胞膜を破裂させることによって、私達の型板DNAは拡大の準備ができています。
さて、良いプラスミドDNAを得るための方法を迅速に通過させます。
滅菌ピッカーの助けを借りて、いくつかの細菌コロニーを選び、それをEppendorfチューブに移します。
今度はそれにTEバッファを加え、よく混ぜる。 D/Wも使用できます。
サンプルを沸騰水浴で20分間加熱する。
サンプルを高速で2分間遠心分離する。
上清を別のチューブに移し、鋳型DNAとして使用する。
20μ lのサンプルを反応物に添加する。
追加情報:
なぜ上清でペレットではないのですか?
DNAは生命の生体分子です。 プラスミドDNAは、細菌の核DNAよりもさらに小さい。 それは1000bpから20,000bpまでのいくつかの遺伝子だけを含んでいます。
したがって、遠心分離するだけで、より軽いプラスミドDNAが細胞から出て上清に沈降し、ペレットにはタンパク質と核DNAが含まれているので、使用していません。
今、ポイントに来ています。
私たちのプラスミドは、増幅の準備ができています。
別の方法では、
は細菌コロニーを直接使用します。
この方法は、Hotstart PCRとcolony PCRの組み合わせです。
細菌コロニーを採取し、PCR反応管に添加する。
チューブをPCRマシンに入れます。 1つの追加の加熱ステップが追加されます。
5-7分加熱することにより、プラスミドDNAが細胞から出てくる。
今、挿入特異的プライマーは、我々が挿入したDNAを増幅します。 そして隣接するプライマーは残りのDNAを増幅します。
増幅は20-25サイクルで行われます。 コロニー PCRのサイクル条件は以下の通りです,
| PCRステップ | 初期変性 | 変性 | アニーリング | 拡張 | 最終拡張 |
| 温度 | 95C | 95C | 55-65C | 72C | 72C |
| 時間 | 3分 | 10秒 | 45秒 | 50秒 | 5分 |
| ——- | ——- | 25 サイクル | —– | ——- |
従来のPCRに関する興味深い記事を読む:ポリメラーゼ連鎖反応の完全なガイド
改善のためのヒント:
多くのコロニーが非特異的結合の可能性を高めるので、少数のコロニーのみを使用する。
正のコントロールと負のコントロールを使用します。
陽性対照として、挿入物が存在しない場合でも隣接プライマーを用いたが、PCR反応はプラスミドDNAのDNAバンドを与え、これは我々が調製した反応が正<133><866>陰性対照として、未変換プラスミド(インサートDNAなしのプラスミド)を使用し、このプラスミドDNAはインサートが存在する場合にのみ増幅される。
挿入物として短いDNA配列を使用すると、長いDNA配列は非特異的結合およびPCR反応の失敗の可能性を増加させる。
さらに、短いPCRプログラムを使用します。
コロニー PCRの主な用途は、酵母プラスミドだけでなく、細菌への挿入DNAの正しいライゲーションと挿入の同定にあります。
コロニー PCR反応が完了した後、PCR産物を2%アガロースゲル上で実行する。 実験の結果を下の図に示します,
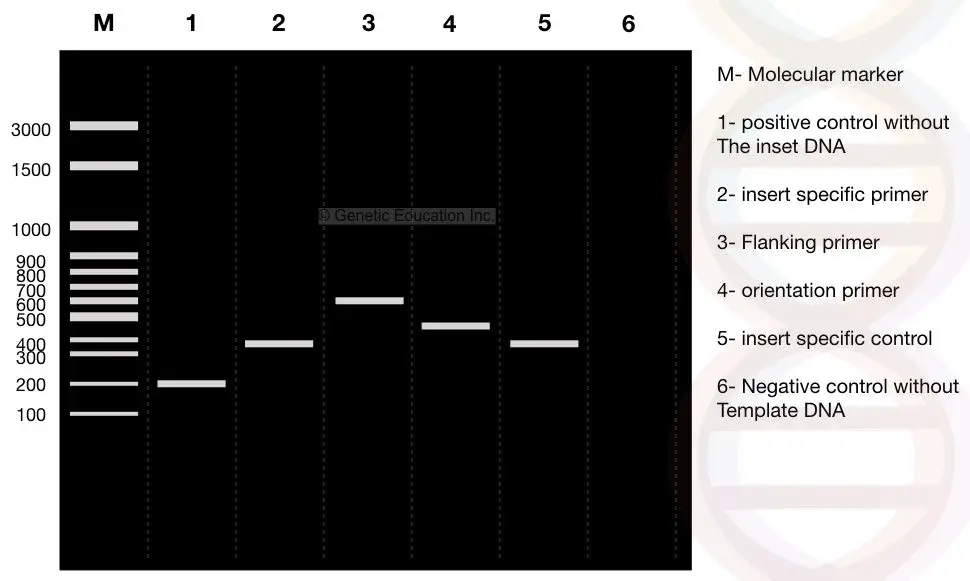
今慎重に結果を観察し、Mは3000bp分子DNAマーカーです。 私たちの関心のあるDNA、”挿入”がプラスミドに挿入された400bp断片であると仮定します。
レーン2を参照してください:私たちの挿入物の400bpの断片。
私達は挿入物の両方の側面からの隣接するプライマー100bpを設計した。 隣接プライマーが挿入物と共にDNAを増幅する場合、生成物は6 0 0bpであり、レーン3(挿入物DNAの4 0 0bp+2 0 0bp隣接領域)を参照されたい。
さて、レーン1を参照してください、それは挿入物のない陽性対照または形質転換されたDNAのない正常なプラスミドである。 したがって、隣接するプライマーは、DNAの200bpを増幅するだけである。
レーン1、挿入なしのDNAの200bp断片(陽性対照)を参照してください。
さて、レーン4を観察してください。 レーン4は、配向特異的プライマーの結果である。 配向特異的プライマーは、インサート特異的プライマーと隣接領域特異的プライマーの組み合わせである。
インサートDNAからの一つのプライマーと隣接領域特異的プライマーからの一つのプライマーは、配向特異的プライマー増幅のために選択されます。
したがって、隣接領域プライマーから100bp断片、インサートDNAから400bpが増幅され、レーン4でDNAの500bp断片が観察される。
レーン5は、400bpのDNA断片を与える挿入特異的対照である。
レーン6は、テンプレートなしの負のコントロールです。 否定的な制御の使用によってどの汚染でも識別することができる。 反応管には鋳型を除くすべての成分が含まれています。 理想的には、このレーンにはDNAバンドは存在しません。
DNAバンドが観察された場合、サンプルは汚染されています。
コロニー PCRの利点:
- この技術は迅速で費用対効果が高い。
- さらに、技術の精度と特異性が高くなります。
- セットアップは従来のPCRと同じように簡単で、DNA抽出やプラスミド精製のような面倒なステップは必要ありません。
- インサートDNAの同定のための制限消化の必要はありません。
- 実験全体は90分以内に完了することができます。
:
- この方法は費用対効果が高く、高速で信頼性がありますが、挿入物の変異は検出できません。
- また、コロニー PCRでは配列情報を得ることができません。 DNA変換の確認のために配列決定を行う必要があります。
- 偽陽性の結果が出る可能性は高い。
続きを読む;
- マルチプレックスPCRとは何ですか?
実験が完了した後、目的のDNA配列を決定できる配列決定のためにサンプルが送られます。
挿入特異的プライマーとプラスミド特異的プライマーの両方を組み合わせることにより、マルチプレックスPCRを行うこともできます。
結論:
遺伝子導入の同定にはコロニー PCRが最良の選択ですが、コロニー PCR技術だけでは結果を解釈するのに十分ではありません。 挿入物に存在する変異のいくつかは、PCRによって検出することができない可能性があります。
結果を確認するためにはDNA配列決定が必要です。 配列順序を決定した後、我々は関心のある私たちの遺伝子が正しく挿入されているかどうかを言うことができます。