チュニジア人集団におけるII期およびIII期大腸癌における腫瘍サイズの予後値
-
腫瘍サイズ(TuS)は、大腸癌における予後であることが報告されている。
-
我々の研究では、我々はTuSの予後の役割を研究し、最高の予測性能を持つカットオフ値を同定した。
-
4cmの大きさは予後に影響を与え、他の予後因子と干渉した。
-
我々は、年齢≥65歳、ステージIII、静脈浸潤とpN+3よりも大きいTuS≥4患者における有意な悪い予後因子であったが、ステージIIIのみが多変量解析における独立した予後因子であったことを観察した。
-
化学療法の投与は、4cm未満のTuS患者における単変量および多変量解析における生存に有意な影響を有する唯一の因子であった。
大腸癌(CRC)は、世界で3番目に一般的な癌であり、欧米諸国では2番目に一般的な癌関連死の原因である。 チュニジアでは、それは公衆衛生上の問題を表しています。 その発生率は過去15年間で増加した。 診断および検査手順の改善にもかかわらず、またスクリーニングプログラムの欠如のために、チュニジアのCRC症例のほとんどは、局所的に進行した(pt3–T4、節陽性)または転移性の段階で検出されたままである。 予後は、学際的な管理で、近年では改善されています; 5年全生存率(OS)は、ステージIIで約70%、ステージIIIで50%と推定されている。 アジュバント療法の恩恵を受ける可能性が最も高い患者を特定するために、CRCのリスク評価因子を改良するために多くの努力がなされてきた。 これらの要因は、主に臨床的、病理学的および最近の分子(マイクロサテライト不安定性/マイクロサテライト安定性、cDNA)であり、そのうちのいくつかは、多くの国で手の届かないままです。 腫瘍サイズ(TuS)は、多くの胃腸癌における生存の代理マーカーである:胃癌、胃腸管間質腫瘍、カルチノイド腫瘍。 CRCにおけるその関連性は不明であり、いくつかの報告されたシリーズで矛盾した結果が報告されている。 TuSは、リスクを評価し、補助化学療法を示す際に考慮すべきマーカーの一つとして国際的なガイドラインを統合していませんでした。 チュニジアの中央地域におけるCRCの1443の新しい症例の病理学的評価を伴う最近の研究では、患者の67.5%が5cmを超えるTuSを有していたが、この知見は 我々の現在の研究では、ステージIIおよびIII CRCの生存を予測するTuSのパフォーマンスを研究し、TuSと既知の予後因子との関係を調べることを目的とした。
患者&方法
結腸および/または直腸腺癌と診断された257人の患者のコホートを遡及的にレビューし、2003年から2014年の間にAbderrahmen Mami HospitalとClinique Taoufik Hospitalの二つの腫瘍学センターで治療した。 米国がん合同委員会(AJCC)/Union Internationale Contre le Cancer(UICC)第7版によると、治癒的意図で治療されたII〜III期の症例が含まれていました。 我々は、完全なワークアップとTuSとフォローアップデータを含む利用可能な病理データを持つ患者のみを検討しました。 研究期間では、治癒療法の完了後、最初の3-4ヶ月ごとに2年間、6ヶ月ごとに3年から5年、その後毎年フォローアップがプログラムされました。 各訪問時に、患者は身体検査を受け、症状および治療毒性がチェックされた。 腹部超音波および胸部x線は6ヶ月ごとに行われ、2012年から胸腹部CTスキャンおよび腫瘍マーカー(癌胎児抗原、CA19–9)は6ヶ月ごとに行われた。
TuSは、最大腫瘍直径によって測定された水平腫瘍拡張として定義された。 生存予測におけるTus性能を決定し,生存に相関するカットオフ値を同定するために,受信機動作特性(ROC)を使用した。 また,カットオフ値による両群の特性を比較し,各群の単変量および多変量解析における予後因子を検討した。
統計分析
すべての分析はSPSS20ソフトウェアを使用して行った。 我々は、ROC曲線を分析し、生存予測におけるTuSの精度を決定するために曲線下面積(AUC)を分析した。 1.0のAUCは患者の癌の誤りのない予測であったが、0.50のAUCは癌状態の正確な予測の半分の可能性を表している。 AUC-ROCが高いほど、結果に対するTuの差別的パワーが大きくなります。 OSは、診断日からフォローアップまたは最新のニュースに任意の原因または損失から死亡するまでの時間として定義されました。 OSは、Kaplan−Meier法に従って評価した。 予後因子は,対数ランク検定を用いた一変量解析およびCox比例ハザードモデルを用いた多変量解析によって評価した。 0.05未満のp値は統計的に有意であると考えられた。
結果
全体の人口の平均年齢は59歳(25-85歳の範囲)、57であった。2%は男性であった。 我々は、それらの間で患者の53%でステージIII疾患37.5%がpn2であった観察しました。 補助化学療法は、III期疾患(オキサリプラチンを含む97.7%)のすべての患者に与えられた。 ステージII疾患では、53%の症例が化学療法を受け、pt4段階で22.5%、12未満のリンパ節で28%を除去し、15%の症例で緊急手術を受けた。 平均TuSは7cmであった。
ROC解析では、生存予測におけるTuSのAUCを図1に示しました。 生存予測におけるtus性能を関与リンパ節数に対する性能と比較した。 AUCは0であった。TuSのための62±0.048および肯定的なリンパ節のための0.60±0.56。

4cmの大きさが生存の予測因子として同定され、感度は88.2%、特異度は59.2%であった。 我々は98tus≥4cmと159TuS以上4cmの患者を観察しました。 4cmを超えるTuSを有する患者は、結腸に位置する癌を有する可能性がより高く(81.1対70.4%、p=0.002)、一般的にはPT4(44対22。4%、p=0.0001)。 我々は、性別、緊急手術、12未満の除去リンパ節率、陽性リンパ節の数、ステージおよびオキサリプラチン投与患者TuS≥4cmとTuS4cm以上の患者との間に有意な差
| 変数 | 腫瘍サイズ≥4cm,%(n=89) | 腫瘍サイズ>4cm,%(n=159) | p値 |
|---|---|---|---|
| 年齢: | |||
| – 平均年齢 –<65歳 –— |
56 73.4 (72) 22.6 (26) |
62.8 (100) 38.2 (59) |
0.32 0.07 |
| 性別: | |||
| – 男性 –女性 |
50 (49) 50 (49) |
57.2 (91) 43.8 (68) |
0.25 |
| BMI†: | |||
| – <30 – ≥30 |
91.3 (63) 8.7 (6) |
85.8 (85) 14.2 (14) |
0.28 |
| 場所: | |||
| – 結腸 –直腸 |
70.4 (69) 29.6 (29) |
81.1 (129) 8.9 (30) |
0.002* |
| 外科的緊急事態: | |||
| – はい -いいえ |
(14) (84) |
11.3 (18) 88.7 (141) |
0.52 |
| <12 リンパ節検査§: | |||
| – はい -いいえ |
34.6 (34) 65.4 (64) |
44.6 (71) 55.3 (88) |
0.11 |
| pN+: | |||
| – 1–3 – >3 |
83.6 (82) 16.4 (16) |
77.9 (124) 22.1 (35) |
0.26 |
| pT: | |||
| pT1–pT3 pT4 |
77.6 (76) 22.4 (22) |
55.9 (89) 44.1 (70) |
<0.01* |
| Stage: | |||
| – Stage II – Stage III |
47.9 (47) 52.1 (51) |
47.1 (75) 42.9 (84) |
0.9 |
| Adjuvant therapy: | |||
| – Yes – No |
76.6 (75) 23.4 (23) |
79.2 (126) 20.8 (33) |
0.6 |
| Oxaliplatine: | 0.48 | ||
| – Yes – No |
48.9 (48) 51.1 (50) |
53.4 (85) 46.6 (74) |
|
| Relapse rate (%) | 35.2 | 37.1 | 0.75 |
| TTR‡(月) | 26 | 34 | 0.13 |
†168人の患者でのみ利用可能です。
‡再発する時間。
§IIおよびIIIの両方の段階で.
*有意なp値。
©Oxford University Press(2017)の許可を得て複製されました。
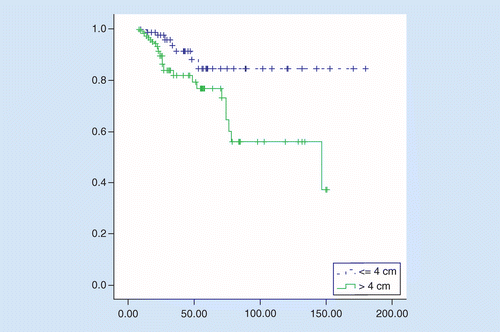
OSはtus≥4cmより大きいTuSと比較して有意に良好であり、平均生存期間は158ヶ月対106ヶ月、ハザード比=2であった。92(95%CI:1.27–6.75、p=0.01)。 患者の5年生存率は、TuS≥4cmの患者で84%、TuSが4cmを超える患者で76%であった(p=0.008;図2参照)。
予後因子を両群で検討した。 単変量解析では、年齢≥65歳、ステージIII、静脈浸潤とpN+3以上の生存に4cm以上のtusを持つ患者の有意な悪い影響を観察しました。 多変量解析のみでは、ステージIIIは独立した予後因子であった。 TuS≥4cmの患者では、アジュバント設定における化学療法が、単変量および多変量解析において生存に有意な影響を及ぼす主な要因であり、他の試験因子の予後への影響はなかった(表2)。
| 変数 | 腫瘍サイズ<4cm(n=159) | 腫瘍サイズ≥4cm(n=159)= 89) | |||||
|---|---|---|---|---|---|---|---|
| 5-5年OS(%) | HR(95%CI) | HR(95%CI) | HR(95%CI) | HR(95%CI) | HR(95%CI) | HR(95%CI)) | |
| 年齢: | |||||||
| – <65 年 -≥65年 |
87 78 |
1.07 (0.208−5.531) | 82 60 |
2.47 (1.35–5.88)* | |||
| pN+: | |||||||
| – 1-3 – >3 |
78 82 |
2.14 (0.41–11.08) | 79 65 |
2.838 (1.25–6.41)* | |||
| pT: | |||||||
| – pT1–pT3 – pT4 |
84 82 |
1.51 (0.29–7.79) | 84 74 |
1.44 (0.67–3.09) | |||
| Venous invasion: | |||||||
| – Yes – No |
80 81 |
0.97 (0.189–5.08) | 63 84 |
2.94 (1.14–7.78)* | |||
| Stage: | |||||||
| – Stage II – Stage III |
77 86 |
0.651 (0.148–2.955) | 85 58 |
0.285 (0.123–0.66)* | |||
| Adjuvant therapy: | |||||||
| – Yes – No |
94 58 |
0.135 (0.025–0.696)* | 78 67 |
0.641 (0.257–1.6) | |||
| Oxaliplatine: | |||||||
| – Yes – No |
92 83 |
0.28 (0.034–2.39) | 78 70 |
0.441 (0.19–1.02) | |||
| Tumor location: | |||||||
| – Colon – Rectum |
90 75 |
0.428 (0.095-1.931) | 75 80 |
2.699 (0.806–9.03) | |||
*重要なHR値。
HR:ハザード比;OS:全生存率。
ディスカッション
今日、欧米諸国では、オカルトスクリーニングプログラムの統合により、初期の段階でCRCの診断が行われました。 2006年から2012年の間の最近の先見者のデータベースの調査では、結腸癌のケースの38%および直腸癌のケースの43%は早い段階で診断されました。 低中所得国では、このようなスクリーニングプログラムは利用できず、ほとんどの場合、tusが高い地域または高度な段階で診断されます。 予後因子の同定は、そのような国での転帰を改善するための重要なツールである。 我々の研究は、チュニジアの人口におけるステージIIおよびIII CRCにおけるTSの予後の役割を検討した。 我々は、TuSが生存に影響を与えるだけでなく、他の予後因子にも干渉することを観察した。 ステージIIIは、多くの”古典的な”予後因子は、小さな腫瘍に影響を与えなかったのに対し、大量の腫瘍では独立した予後因子であった。 いくつかの研究では、生存に関連するTuSの増加が減少したTuSの予後値が報告されていた。 Kornpratらによる研究では。 Tusは結腸における一変量および多変量解析において無増悪および癌特異的生存と有意に関連していたが,直腸癌では関連していなかった。 我々のシリーズでは、高いTuSは結腸癌の場所でより一般的であった。 実際には、結腸癌は直腸癌と比較して診断時に高いTuSを説明し、より長い時間のために無症候性滞在することができます。 しかし、結腸に位置する腫瘍≥4cmと直腸に位置する腫瘍≥4cmの間に生存率に差はなかった。 小さい腫瘍でも腫瘍位置の影響はなかった(<613>4cm)。 したがって、この分析に基づいて、TuSは腫瘍の位置(結腸対直腸)に基づいて予後を予測する役割を持たなかった。 Saha et al. TuSは重要な予後因子と正の相関があり、結腸癌の生存に悪影響を及ぼすことが大規模な一連の患者で報告されている。 直腸癌におけるその役割はまだ明らかではない。
高いTuSはPT4期にも関連しており、T1–2N1期よりも予後が最悪であると報告されていた(グループ間試験INT-0089)。 腫瘍負荷は、腸壁、節および他の器官を通って播種する腫瘍の能力を反映することができる。 実際、我々の研究では、TuSは陽性リンパ数の予測値に近い予測ROC分析値を有していた。 4cm未満の腫瘍では、II期とIII期の患者の生存率の差は観察されなかった。 この所見は、私たちのステージII集団は、予後が悪い(ステージIII予後に近い)高リスク集団であったという事実によって説明することができます:多くのステージpt4、12未満のリンパ節を除去した多くの症例、緊急時に手術された多くの症例(穿孔および閉塞のため)。 二つの先見者のデータベースの研究では、小さな腫瘍は、ステージII疾患である予後が悪かったです。 著者らは、tusが小さいことが生物学的攻撃性の代理マーカーであり、II期の比較的大きなTuSと比較して結果が劣っている可能性があると仮説を立てた。 同じ観測は、イタリアの研究で見られました。 また,Tusによるいくつかの予後因子の役割を検討した。 低Tus患者群では,年齢,病期,関与リンパ節数,腫よう位置などのいくつかの予後因子は有意な影響を及ぼさなかった。 私たちの研究では、補助化学療法は小さな腫瘍にプラスの影響を与えましたが、TuSはII期の”高リスク”因子とみなされるべきですか? この特定の問題に焦点を当てたさらなる研究が必要である。
私たちのシリーズにはいくつかの落とし穴があります: データの小さいサンプルサイズ、遡及的なコレクションおよび精密なTSの評価のための病理学のレポートの中央検討の不在。 正確な腫瘍位置に関する十分な利用可能なデータがなかったため、そのような分析を行うことができませんでした。 分子検査は2015年にチュニジアで導入されましたが、私たちの研究期間では利用できませんでした。 結論を導くには患者の数が少なすぎるため、段階およびオキサリプラチン投与によるTuSの評価は行われなかった。
結論
TuSは病理検査中に容易に測定できる客観的なパラメータです。 これは、局所的に進行した段階の割合が高い集団における追加の予後因子を表す可能性がある。
将来の展望
いくつかの複雑な遺伝的アレトレイオンおよび/または経路は、大腸癌におけるTuSの背後にある可能性があり、腫瘍の大きさを考慮した分子解析は、その予後へのより正確な外植をもたらす可能性がある。
財務&競合する利益開示
著者は、原稿で議論されている主題または資料に対する財政的利益または財政的競合を有する組織または団体と これには、雇用、コンサルタント、honoraria、株式所有またはオプション、専門家の証言、受領または保留中の助成金または特許、またはロイヤリティが含まれます。
この原稿の制作には執筆支援は利用されていませんでした。
研究の倫理的行為
著者らは、適切な機関審査委員会の承認を得たか、すべてのヒトまたは動物の実験調査についてヘルシンキ宣言に概説されている原則に従っていると述べている。 また、被験者を対象とした調査については、関与した参加者からインフォームドコンセントを得ています。
- 1 Torre LA,Bray F,Siegel RL et al. 世界のがん統計、2012。 CA. Cancer J.Clin. 65(2), 87–108 (2015).Crossref,Medline,Google Scholar
- 2Missaoui N,Jaidaine L,Abdelkader AB et al. チュニジア中部の結腸直腸癌:15年間にわたる発生率の増加傾向。 アジアPac. J.Cancer Prev. 12(4), 1073–1076 (2011).Medline,Google Scholar
- 3Missaoui N,Trabelsi A,Parkin DM et al. スース地域、チュニジア、1993-2006における癌の発生率の動向。 Int. J.がん127(11), 2669-2677 (2010).Crossref,Medline,CAS,Google Scholar
- 4Yang J,Du XL,Li ST et al. 異なった位置の結腸直腸癌の特徴は、近位および遠位の分類を支持する:57,847人の患者の集団ベースの研究。 PLoS ONE11(12),e0167540(2016).Crossref,Medline,Google Scholar
- 5Quan J,Zhang R,Liang H et al. Pt4an0m0胃癌患者の生存に及ぼす腫瘍サイズの影響。 アム… 手術…79(3), 328-331 (2013).Medline,Google Scholar
- 6Zhai ZW,Gu J.結腸癌患者の予後に対する腫瘍サイズの影響。 中華魏チャンワイKe Za志。 15(5), 495–498 (2012).Medline,Google Scholar
- 7Huang B,Feng Y,Zhu L et al. 腫瘍サイズが小さいほど、II期結腸癌の生存不良と関連している:SEERデータベースの7719人の患者の分析。 Int. J.サージ-ロンド エングル 33(Pt A),157-163(2016).Crossref,Medline,Google Scholar
- 8Crozier JE,McMillan DC,McArdle CS et al. 腫瘍の大きさは全身性炎症反応と関連しているが、原発性手術可能な結腸直腸癌の患者では生存には関連していない。 J.Gastroenterol. ヘパトール 22(12), 2288–2291 (2007).Crossref,Medline,Google Scholar
- 9Labianca R,Nordlinger B,Beretta GD et al. 早期結腸癌:診断、治療およびフォローアップのためのESMO臨床診療ガイドライン。 アン オンコール 24日(日) ることが示された。Crossref,Medline,Google Scholar
- 10Mandel JS,Church TR,Bond JH et al. 結腸直腸癌の発生率に対する便潜血スクリーニングの効果。 N.Engl. J.Med. 343(22), 1603–1607 (2000).Crossref,Medline,CAS,Google Scholar
- 11Siegel RL,Miller KD,Fedewa SA et al. 大腸がんの統計、2017。 CA Cancer J.Clin. 67(3), 177–193 (2017).Crossref,Medline,Google Scholar
- 12Kornprat P,Pollheimer MJ,Lindtner RA,Schlemmer A,Rehak P,Langner C.大腸癌における予後変数としての腫瘍サイズの値:重要な再評価。 アム… J.Clin. オンコール 34(1), 43–49 (2011).Crossref,Medline,Google Scholar
- 13Saha S,Shaik M,Johnston G et al. 腫瘍の大きさは、結腸癌における長期生存を予測する:国立癌データベースの分析。 アム… J.サージ…209(3), 570-574 (2015).Crossref,Medline,Google Scholar
- 14Le Voyer TE,Sigurdson ER,Hanlon AL et al. 結腸癌の生存は、分析されたリンパ節の数の増加と関連している:グループ間試験INT-0089の二次調査。 J.Clin. オンコール 21(15), 2912–2919 (2003).Crossref,Medline,CAS,Google Scholar
- 15Wang Y,Zhuo C,Shi D et al. IIA期結腸癌における原因特異的生存に対する小さな腫瘍サイズの好ましくない影響、先見者ベースの研究。 Int. J.Colorectal Dis. 30(1), 131–137 (2015).Crossref,Medline,Google Scholar
- 16Santullo F,Biondi A,Cananzi FCM et al. IIa期結腸癌患者の予後因子としての腫瘍サイズ。 アム… J.サージ… doi:10.1016/j.amjsurg.2017.03.038 (2017) (Epub ahead of print).Medline, Google Scholar
- 17 Mejri N, Dridi M, Labidi S et al. P-299 prognostic value of tumor size in stage II and III colorectal cancer in Tunisian population. Ann. Oncol. 28(Suppl. 3), mdx261.296 (2017).Google Scholar