内分泌学におけるFrontiers
はじめに
多嚢胞性卵巣症候群(PCOS)は、生殖年齢の女性の無排卵および不妊の主な原因であり、最も一般的な内分泌障害である。世界の女性の5-10%(1)。 PCOSを有する女性の脂肪分解の加速とその後の脂質異常症は、肥満、インスリン抵抗性および2型糖尿病(T2DM)を含む代謝異常と関連している(2)。 支配的な卵胞(3、4)の濾胞液(FF)の反映された変化は、卵母細胞の質および代謝に直接影響を与える可能性がある。 低悪性度の慢性炎症は、一般的に不妊症の病因論的メカニズムとして非難されている。 炎症性サイトカインは、原因不明の不妊(と女性の間で有意に高い5)。 炎症促進因子は、原因不明の不妊症を有する女性の間で、特に移植段階で、体外受精(IVF)のより高い失敗率と有意に関連していることが示されている(6)。 研究では、インターフェロンγ(IFN-γ)およびインターロイキン-2(IL-2)レベルの上昇と、重要な内因性抗炎症メディエーターであるトランスフォーミング成長因子ベータ(TGF-β)レベルの減少が発見されている(7)移植ウィンドウ(黄体期)の間に肥沃なコントロールと比較して、原因不明の不妊症を有する女性の血漿中で(8)。 さらに、原因不明の不妊患者は、肥沃な女性と比較して、血清IL-2、IL-4、IL-6、IL-21、腫瘍壊死因子α(TNF-α)、およびIFN-γのレベルが上昇していることを示した(5)。
クロムサプリメントの有益な効果は、PCOSに罹患している女性の代謝異常に対して既に報告されている。 Fazelian et al.によって行われたメタ分析では。 (9)、クロムの補足はPCOSの患者の血清のインシュリンおよび自由なテストステロンを減らし、体重を改善しました。 我々はすでに血糖コントロール、cardiometabolicリスクパラメータ、およびIVF(10)の候補であったPCOSと不妊女性の酸化ストレスに8週間クロムサプリメントを取ることの利点 さらに、糖尿病ラットのクロム補充は、ペルオキシソーム増殖剤活性化受容体ガンマ(PPAR-γ)、インスリン受容体基質1(IRS-1)および核因子kB(NF-kB)タンパク質(11)の変 同様に、Wang e t a l. (12)肥満対照ラットと比較して、クロムを補充したものは、骨格筋におけるグルコース処分速度およびインスリン刺激p-IRS-1およびホスファチジルイノシトール-3キナーゼ活性の上昇に有意な改善を有していたことがわかった。 別の動物実験では、糖尿病ラットによる7週間のクロム摂取は、有意にC反応性タンパク質(CRP)、TNF-αおよびIL-6(13)を含む炎症マーカーを減少させた。
クロムの抗糖尿病および脂質低下効果を考慮して(11、14)、我々は、クロム補給は、異なる代謝異常に苦しんでいるPCOSとIVFの候補を持つ女性に有益であ 私たちの最高の知識によると、IVFの候補者であったPCOSを持つ不妊女性におけるインスリン、脂質、および炎症マーカーの遺伝子発現に対するクロム補充の この試験は、PCOSに罹患し、IVFの候補であった不妊女性におけるインスリン、脂質、および炎症マーカーの遺伝子発現に対するクロム補給の効果を決定するこ
材料と方法
試験設計と参加者の特徴
この無作為化二重盲検プラセボ対照試験は、イランのウェブサイトによって臨床試験登録(http://www.irct.ir:IRCT20170513033941N32)に登録され IVFの前の歴史のないIVFのための候補者だった18-40歳のPCOSを持つ四十不妊女性が含まれていました。 この研究は、2018年2月から5月の間にイランのテヘランのTaleghani病院で実施されました。 ロッテルダム基準は、PCOSの診断を確認するために使用された(15)。 甲状腺機能障害、糖尿病または耐糖能障害を含む代謝異常を有する参加者は、研究から除外された。 この調査はHelsinki宣言およびGood Clinical Practice guidelinesに従って行われ、イランのテヘランのShahid Beheshti University of Medical Sciences(SUMS)の研究倫理委員会によって承認されました。 書面によるインフォームドコンセントは、すべての個人によって署名されました。
介入
参加者を介入群に無作為に割り当て、ピコリン酸クロム200μ g/日(N=20)またはプラセボ(Barij Essence、Kashan、Iran)(N=20)のいずれかを8週間服用した。 クロムの補足およびplacebosは形、出現、臭いおよび包装の点では一致しました。 ランダム化は、コンピュータで生成された乱数を使用して行われました。 ランダム化と割り当てプロセスは、最終的な分析が完了するまで、研究者と参加者の両方から隠されていました。 試験に関与せず、ランダムな配列に気づいていない別の人は、被験者を錠剤の番号付きボトルに割り当てました。 試験中、サプリメントとプラセボへの遵守は、個人に薬の容器を持ち帰るように求めて監視されました。 コンプライアンス率を高めるために、すべての参加者は、サプリメントを取るために自分の携帯電話に短い毎日のリマインダーメッ 研究参加者は、介入の第0週、第4週、および第8週に食事記録を完了した。
アウトカムの評価
血清高感度C反応性タンパク質(hs-CRP)レベルを一次アウトカムとみなし、代謝プロファイルを二次アウトカムとした。 空腹時血液サンプル(15mL)は、Taleghani病院(テヘラン、イラン)で8週間の介入の開始と終了時に収集されました。 H S−CRPレベルを、7%未満のアッセイ間およびイントラ係数分散(Cvs)を有する市販のELISAキット(LDN、Nordhorn、Germany)を使用して測定した。 血漿一酸化窒素(NO)レベルは、<5%のイントラアッセイCVsとGriess法(16)を使用して測定した。<5 7 0 2><4 8 4 2>リンパ球細胞の単離<1 8 0 4><1 2 9>血液試料を、5 0%percoll(Sigma−Aldrich,Dorset,UK)を用いてリンパ球細胞を抽出するために使用した。<5 7 0 2><4 8 4 2>リンパ球細胞の単離<1 8 0 4><1 2 9> 細胞数および生存率試験は、トリパンブルー、RNAおよびDNA抽出(17)を用いて行った。<5 7 0 2><4 8 4 2>RNA抽出およびリアルタイムPCR(RT−PCR)<1 8 0 4><1 2 9>rnaは、rnx−plus kit(Cinnacolon,Tehran,Iran)を用いて血液試料から抽出した。 RNA懸濁液を、cDNAが誘導されるまで−2 0℃で凍結した。 各試料から全Rnaを抽出した後、UV分光光度計を用いてRNAを定量した。 1.7–2.1の各サンプルOD260/280比は、タンパク質またはDNAのいずれかで汚染を表さない(17)。 Moloneyマウス白血病ウイルス逆転写酵素(R t)を用いて,単離したRNAをcdnaライブラリーに逆転写した。 PPAR−γ、グルコーストランスポーター1(GLUT−1)、低密度リポタンパク質受容体(LDLR)、IL−1、IL−8、TNF−α、TGF−β、および血管内皮増殖因子(VEGF)の遺伝子発現を、SYBR green detection and Amplicon Kitを使用し、定量的RT−PCR グリセルアルデヒド-3-リン酸デヒドロゲナーゼ(GAPDH)プライマーは、ハウスキーピング遺伝子として使用されました。 プライマーは、Primer Expressソフトウェア(Applied Biosystems,Foster City,USA)およびBeacon designerソフトウェア(Takaposizt,Tehran,Iran)を使用して設計した。 相対転写レベルを、Pffafiまたは2−Δ Δ CT法を用いて計算した。

表1. リアルタイム定量PCRに使用される特定のプライマー。
サンプルサイズと統計的方法
サンプルサイズは、Rctの確立された式を使用して計算され、タイプ1(α)とタイプ2の誤差(β)は0.05と0とみなされました。20 80%の力を提供するため。 以前に公表された研究(18)に基づいて、hs-CRPについての1500.0ng/mLの平均差(d)および1496.1ng/mLの標準偏差(SD)を使用してサンプルサイズを計算した。 各介入群における4つの被験者の可能性のある脱落を考慮すると、最終的なサンプルサイズは、グループごとに20(16+4)の被験者であると決定された。
データの正常性は、Kolmogorov-Smirnov検定を用いて評価した。 分析はintention-to-treat(ITT)アプローチを用いて行った。 独立したサンプルtテストは介入群間のインスリン、脂質および炎症の人体測定測定および遺伝子発現の違いを決定するために適用されました。 炎症マーカーに対するクロム補充の効果は、反復測定ANOVA試験を用いて評価した。 比率の差は、Fisherの正確な検定によって評価した。 P<0.05は統計的に有意であると考えられた。 統計分析は、Statistical Package for Social Science version1 8(SPSS Inc.、シカゴ、イリノイ州、米国)。
結果
個人的な理由により、各介入グループで三つの脱落が報告されました。 そのため、全体で34人の参加者が研究を完了しました(図1)。 ITTアプローチを使用して、すべての40の参加者(各グループの20)は、最終的なデータ分析に含まれていました。 この研究のコンプライアンス率は高く、両方のグループの介入中に錠剤の90%以上が消費された。 この研究では、PCOSを有する女性におけるクロムの消費後に副作用は報告されなかった。

図1. 患者の流れ図の概要。
人体測定測定は、介入群間で統計的に異ならなかった(表2)。 さらに、クロム補充後、子宮内膜の厚さ、回収された卵母細胞の数、受精卵母細胞の数、受精率、妊娠率および胚の数を含むIVFアウトカムは、補充群とプラセボ群

表2. 研究参加者の一般的な特性。
マクロ栄養摂取量およびマイクロ栄養摂取量の平均も、治療を通じて2つの介入群間で有意差はなかった(データは示されていない)。

表3. クロムサプリメントまたはプラセボのいずれかを受けた体外受精のための不妊多嚢胞性卵巣症候群の女性の候補におけるベースラインと8週間の介入後の炎症マーカー。
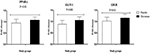
図2. クロムサプリメントとプラセボを受けて、体外受精の候補であった多嚢胞性卵巣症候群と診断された女性におけるPPAR-γ、GLUT-1、およびLDLRの遺伝子発現レベ P値は、独立したt検定から得た。 各グループでN=20。 IL−1、インターロイキン−1;IL−8、インターロイキン−8;ldlr、酸化低密度リポタンパク質受容体;PPAR−γ、ペルオキシソーム増殖因子活性化受容体γ;TNF−α、腫瘍壊死因子α;TGF−β、形質転換
クロム補充はまた、プラセボと比較してPBMCsにおけるIL-1(P=0.004)の遺伝子発現をダウンレギュレートした(図3)。 PCOS患者のPBMCsにおけるIL-8、TNF-α、TGF-β、およびVEGFの遺伝子発現に対するクロム補充の有意な効果はなかった。
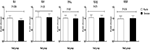
図3. 多嚢胞性卵巣症候群と診断された体外受精の候補者であり、クロムサプリメントおよびプラセボを受けた女性におけるIL−1、IL−8、TNF−α、TGF−β、およびVEGFの遺伝子発現レベルの変化(±Sdsを意味する)。 P値は、独立したt検定から得た。 各グループでN=20。 IL−1、インターロイキン−1;IL−8、インターロイキン−8;ldlr、酸化低密度リポタンパク質受容体;PPAR−γ、ペルオキシソーム増殖因子活性化受容体γ;TNF−α、腫瘍壊死因子α;TGF−β、形質転換
ディスカッション
IVFの候補者であったPCOSを持つ不妊女性における8週間のクロム投与の有益な効果を発見しました。 クロム補充は炎症を低下させ、PPAR-γ、GLUT-1、LDLR、およびIL-1の遺伝子発現を改善したが、IL-8、TNF-α、TGF-β、およびVEGFの遺伝子発現には影響しなかった。 私たちの知る限りでは、これは、PCOSと診断され、IVFの候補と診断された不妊女性におけるインスリン、脂質、および炎症マーカーに関連する遺伝子発現に対す
インスリンおよび脂質代謝の遺伝子発現に対するクロムの影響
PCOS患者は、インスリン抵抗性の増加、脂質異常症および慢性炎症などの異な 現在の研究では、IVFの候補者であったPCOSを持つ不妊女性への8週間のクロム補給は、PPAR-γ、GLUT-1、およびLDLRの遺伝子発現を有意に増加させることが明らかに 我々の知見と一致して、糖尿病ラットへのクロム投与は、おそらくPPAR-γおよびIRS-1タンパク質(の変調にクロムの影響に関連する抗糖尿病活性を示した11)。 Wang et al. (12)またクロムと補われた肥満のラットがかなりブドウ糖の処分率を高めたことが分りました。 また、肥満コントロールと比較して、これらのラットは、骨格筋におけるインスリン刺激p-IRS-1とホスファチジルイノシトール-3キナーゼ活性の上昇を示した。 別の研究では、クロム、ビオチン、またはそれらの組み合わせが有意に効果的なインスリン感作の影響を持っており、糖尿病ラットモデル(におけるイン クロムはまた、GLUT-4輸送およびインスリン刺激グルコース輸送を促進することができる(21)。 同様に、12週間クロムを補充された糖尿病性網膜症を有するラットは、GLUT-1、GLUT-3、およびインスリン(22)の遺伝子発現の改善を示した。 PPAR-γは、脂肪組織で広く発現されるインスリン、グルコースおよび脂質代謝の中心的調節因子である。 PPAR-γは、2型糖尿病の患者だけでなく、糖尿病げっ歯類モデル(におけるインスリン感受性と脂質プロファイルを改善する可能性があります23)。 現在の証拠は、PPAR-γアゴニストが、低血糖の影響とは独立した機構を介して腎皮質脂質およびタンパク尿を減少させるのに有益であり得ることを示唆している(24、25)。
炎症マーカーの遺伝子発現に対するクロムの影響
私たちの研究は、IL-8、TNF-α、TGF-β、およびVEGFの遺伝子発現には影響しなかったが、ivfの候補であったPCOSを持つ不妊女性におけるIL-1および血清hs-CRPレベルの遺伝子発現を8週間にわたって有意に減少させたことを支持した。 炎症マーカーの遺伝子発現およびそれらの循環レベルに対するクロム補充の効果を示す現在の証拠は乏しく、主に動物研究に限定されている。 Zucker糖尿病性脂肪(ZDF)ラットに8週間のクロム補給が有意に彼らの血清CRPレベル(26)を減少させた。 別の研究では、ナイアシン酸クロムを7週間摂取すると、糖尿病ラットの炎症促進性サイトカイン(TNF-α、IL-6、およびCRP)レベル、酸化ストレス、および脂質濃度が減少した(13)。 さらに、ピコリン酸クロム、ホスファチジルセリン、ドコサヘキサエン酸、ホウ素を含む栄養補助食品を12週間投与すると、高脂肪食を与えたラットにおけるCRPおよびTNF-α濃度が有意に減少した(27)。 我々は、IL-8、TNF-α、TGF-β、およびVEGFに対するクロム補給の有意な効果は、異なる研究デザイン、使用されるクロムの種類と投与量、介入の期間および参加者の特 クロムのより高い適量はかなりIL-8、TNF-α、TGF-βおよびVEGFを含む新陳代謝のプロフィールを改善するかもしれません。 炎症および酸化ストレスのマーカーは、多くの糖尿病患者において上昇しており、これは血管の炎症を積極的に表しています(28)。 インスリン抵抗性およびその後の血管炎症は、CVDを発症するための主要な危険因子である(29)。 炎症促進マーカーに対するクロムの抑制効果は、酸化ストレス経路を不活性化し、肝臓のインスリン抵抗性カスケードに関連するAktリン酸化の減少によって促進される可能性がある(30)。 現在の証拠は、炎症性サイトカインの増加がIVFの転帰に関与していることを示している。 Haimoviciらによって行われた研究では。 (31)、彼らの胎児に生きて出産した女性は低いIL-6レベルを持っていました。 IL-1βの存在下でプロゲステロンを産生する黄体細胞の阻害は、移植の失敗につながる要因の一つであり得る(32)。 卵胞TNF-αおよびIL-6の増加は、卵胞の微小環境を悪化させ、それによって卵母細胞および胚の質に悪影響を及ぼす可能性がある(33)。 Levinらによって行われた別の研究では。 (34)、より高いCRPレベルは、IVFの刺激の間に、概念の失敗とかなり関連付けられました。 上記の公表された証拠によれば、IVFの結果は炎症の減少によって影響される可能性があると仮定した。 最近の調査はTNF-αの抑制剤および静脈内の免疫グロブリンを使用してかなりIVFの結果を下記のものを含んで改善したことを示しました; tヘルパー1/Tヘルパー2サイトカインの高レベルを持っていた若い不妊女性の移植、臨床妊娠と生きた出生率(35)。
この研究にはいくつかの制限がありました。 不十分な資金調達のために、我々はクロムレベルを測定することができなかったし、酸化ストレスの遺伝子発現に対するクロムの影響を評価すること
全体として、私たちの研究は、PPAR-γ、GLUT-1、LDLR、およびIVFの候補となったPCOSを持つIL-1in不妊女性の遺伝子発現を改善することにより、炎症マーカーを低下させる
著者の貢献
ZAは、原稿の概念、デザイン、統計分析に貢献しました。 MA、SZ、NM、EA、SSはデータ収集と原稿作成に貢献しました。 ZAは研究を監督しました。
資金調達
この研究は、研究副学長、Shahid Beheshti University of Medical Sciences、およびイランのテヘランからの助成金によって支援されました。
利益相反声明
著者らは、この研究は利益相反の可能性があると解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言
1. Yildiz BO、Bozdag G、Yapici Z、Esinler I、Yarali H.有病率、表現型および異なる診断基準の下での多嚢胞性卵巣症候群の心臓代謝リスク。 ハム-リプロド (2012) 27:3067–73. doi:10.1093/humrep/des232
PubMed要約/CrossRef全文/Google Scholar
2. Amato G,Conte M,Mazziotti G,Lalli E,Vitolo G,Tucker AT,et al. 刺激サイクル中の多嚢胞性卵巣症候群における血清および濾胞液サイトカイン。 産科-婦人科-婦人科-婦人科-婦人科 (2003) 101:1177–82.
3. Valckx SD,Arias-Alvarez M,De Pauw I,Fievez V,Vlaeminck B,Fransen E,et al. 生殖補助治療を受けている正常体重、過体重および肥満の女性の濾胞液の脂肪酸組成:記述的な断面研究。 リプロドバイオリノール… (2014) 12:13. 土井:10.1186/1477-7827-12-13
PubMed Abstract|CrossRef全文|Google Scholar
4. Valckx SD,De Pauw I,De Neubourg D,Inion I,Berth M,Fransen E,et al. 生殖補助治療を受けている女性の濾胞液のBMI関連代謝組成および卵母細胞および胚の質の結果。 ハム-リプロド (2012) 27:3531–9. doi:10.1093/humrep/des350
PubMed要約/CrossRef全文/Google Scholar
7. Letterio JJ,Roberts AB. TGF-βによる免疫応答の調節。 アニュ-レヴュー-イムノル… (1998) 16:137–61
PubMed Abstract | Google Scholar
8. Fornari MC, Sarto A, Berardi VE, Martinez MA, Rocha MG, Pasqualini S, et al. Effect of ovaric hyper-stimulation on blood lymphocyte subpopulations, cytokines, leptin and nitrite among patients with unexplained infertility. Am J Reprod Immunol. (2002) 48:394–403.
PubMed Abstract | Google Scholar
10. Jamilian M, Zadeh Modarres S, Amiri Siavashani M, Karimi M, Mafi A, Ostadmohammadi V, et al. 体外受精のための不妊のpolycystic卵巣シンドロームの女性の候補者のglycemic制御、心臓新陳代謝の危険のマーカー、および酸化圧力のクロムの補足の影響:無作為化された、二重盲検の、偽薬制御試験。 (2018):48-55. 土井:10.1007/s12011-017-1236-3
PubMed Abstract|CrossRef全文|Google Scholar
11. Sahin K,Tuzcu M,Orhan C,Sahin N,Kucuk O,Ozercan IH,et al. 高脂肪食とストレプトゾトシンによって誘導される2型糖尿病ラットにおけるピコリン酸クロムとビオチンの抗糖尿病活性。 Br J Nutr. (2013) 110:197–205. doi:10.1017/S0007114512004850
PubMed要約/CrossRef全文/Google Scholar
13. Jain SK,Rains JL,Croad JL. ストレプトゾトシン処理糖尿病ラットの血液中の脂質過酸化、TNF-α、IL-6、CRP、糖化ヘモグロビン、トリグリセリド、およびコレステロールレベルに対する 無料ラディックバイオレメッド。 (2007) 43:1124–31. 土井:10.1016/j.freeradbiomed.2007.05.019
PubMed抄録/CrossRef全文/Google Scholar
14. Martino F,Puddu PE,Pannarale G,Colantoni C,Martino E,Niglio T,et al. 低用量のクロム-ポリニコチン酸またはポリコサノールは、グルコマンナンとの組み合わせでのみ高コレステロール血症の子供に有効である。 アテローム性動脈硬化症。 (2013) 228:198–202. 土井:10.1016/j.アテローム性動脈硬化症.2013.02.005
PubMed要約/CrossRef全文/Google Scholar
15. Rotterdam ESHRE/ASRM主催のPCOSコンセンサスワークショップグループ。 診断基準と多嚢胞性卵巣症候群に関連する長期的な健康リスクに関する2003年のコンセンサスを改訂しました。 フェチルステリル… (2004) 81:19–25.
17. Dunkley PR、Jarvie PE、Robinson PJ。 シナプトソームの調製のための迅速なパーコール勾配手順。 ナターシャ—— (2008) 3:1718–28. ドイ:10.1038/nprot.2008.171
PubMed要約/CrossRef全文/Google Scholar
18. Jamilian M,Bahmani F,Siavashani MA,Mazloomi M,Asemi Z,Esmaillzadeh A. 多嚢胞性卵巣症候群の女性における内分泌プロファイル、炎症のバイオマーカー、および酸化ストレスに対するクロム補充の影響:無作為化、二重盲検、プラセボ Biol Trace Elem Res.(2016)172:72-8. 土井:10.1007/s12011-015-0570-6
PubMed Abstract|CrossRef全文|Google Scholar
19. Asemi Z,Foroozanfard F,Hashemi T,Bahmani F,Jamilian M,Esmaillzadeh A. カルシウムプラスビタミンD補給は、多嚢胞性卵巣症候群の過体重および肥満のビタミンD欠乏女性のグルコース代謝および脂質濃度に影響を与 クリナップ (2015) 34:586–92. doi:10.1016/j.clnu.2014.09.015
PubMed要約/CrossRef全文/Google Scholar
20. Foroozanfard F,Jamilian M,Bahmani F,Talaee R,Talaee N,Hashemi T,et al. カルシウムプラスビタミンD補給は、多嚢胞性卵巣症候群の過体重およびビタミンD欠乏女性における炎症および酸化ストレスのバイオマーカーに影: 無作為化二重盲検プラセボ対照臨床試験。 クリニーク-エンデクリノールトランスミッション (2015) 83:888–94. 土井:10.1111/cen.12840
PubMed要約/CrossRef全文/Google Scholar
21. Chen G,Liu P,Pattar GR,Tackett L,Bhonagiri P,Strawbridge AB,et al. クロムはグルコーストランスポーター4輸送を活性化し、コレステロール依存性メカニズムを介して3T3-L1脂肪細胞におけるインスリン刺激グルー モロヘイヤ——— (2006) 20:857–70. 土井:10.1210/私.2005-0255
PubMed Abstract/CrossRef Full Text|Google Scholar
24. ベニーニA、ゾジャC、カンパーナM、コルナD、サンガッリF、ロットーリD、et al. 糖尿病性腎症の治療におけるTGFbeta拮抗作用の有益な効果は、治療がいつ開始されるかに依存する。 ネフロン-エクス-ネフロール ら(2 0 0 6)1 0 4:e1 5 8−6 8. 土井: 10.1159/000094967
PubMed Abstract|CrossRef全文|Google Scholar
25. ボブレスクIA. 腎臓の脂質新陳代謝およびlipotoxicity。 クルル-オピン-ネフローゼ。 (2010) 19:393–402. ドイ:10.1097/MNH.0b013e32833aa4ac
PubMed要約/CrossRef全文/Google Scholar
26. ジニコシステイン酸クロムサプリメントは、血中ビタミンCとアディポネクチンの上昇と、zucker糖尿病性脂肪ラットの肝臓におけるNFkappaB、Akt、Glut-2の阻害によって明らかに媒介される血糖、CRP、MCP-1、ICAM-1、クレアチニンを低下させることができる。 (2010)54:1371-80. ドイ:10.1002/mnfr.200900177
PubMed要約/CrossRef全文/Google Scholar
27. Sahin N, Akdemir F, Orhan C, Aslan A, Agca CA, Gencoglu H, et al. A novel nutritional supplement containing chromium picolinate, phosphatidylserine, docosahexaenoic acid, and boron activates the antioxidant pathway Nrf2/HO-1 and protects the brain against oxidative stress in high-fat-fed rats. Nutr Neurosci. (2012) 15:42–7. doi: 10.1179/1476830512Y.0000000018
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Haimovici F, Anderson JL, Bates GW, Racowsky C, Ginsburg ES, Simovici D, et al. 不妊のカップルの両方のパートナーの圧力、心配および不況はcytokineのレベルおよび不利なIVFの結果と関連付けられます。 アム-ジェイ-リプロド-イムノール ら(2 0 1 8)7 9:e1 2 8 3 2. 土井:10.1111/アジ。12832
PubMed要約/CrossRef全文/Google Scholar
32. 王XF、興FQ、陳SL。 卵巣顆粒膜細胞におけるインターロイキン-1β発現および体外受精を受けている女性におけるその臨床的含意。 ディ-イ-ジュン-イ-ダ-スエ-スエ-バオ (2002) 22:934–6.
33. Wunder DM、Mueller MD、Birkhauser MH、Bersinger NA。 子宮内膜症患者の濾胞液中のENA-78の増加。 アクタ産科婦人科 (2006) 85:336–42. 土井: 10.1080/00016340500501715
PubMed Abstract/CrossRef Full Text/Google Scholar